Intuber est une compétence. Extuber est un art.
« Les patients ne meurent pas d’un “échec de l’intubation”. Ils meurent, soit du défaut de cesser d’essayer d’intuber soit de l’intubation œsophagienne non diagnostiquée ».
Scott, DB intubation endotrachéale :. Ami ou ennemi Br Med J (Clin Res Ed). 18 janvier 1986 ; 292 (6514) :157-8.
Il n’y a aucun conflit d’intérêt dans la présentation des divers dispositifs suivants.
Les expériences d’intubation chez l’animal sont anciennes : dès 1542, la technique était décrite par Brassalva et Vesale chez le mouton.
Les premières intubations trachéales chez l’homme ont été réalisées dès le XVIIIe siècle, à l’aide de tubes métalliques décrits dans le traité de Mushin ; les intubations étaient la levée d’obstacles laryngés et la ventilation.

Cette technique fut rapidement délaissée après la publication d’un pneumothorax suffocant gravissime par Leroy en 1827. Remise à l’honneur par Bichat puis Mac Ewen en 1880 et O’Dwyer en 1887, l’intubation est alors réalisée avec succès pour le traitement des obstructions laryngées au cours des diphtéries.
Jusqu’alors, l’intubation trachéale était réalisée à l’aveugle.
La mise au point de la laryngoscopie directe par Kirstein en 1896, puis Chevalier Jackson en 1911 permet l’intubation nasale sous contrôle direct, et Magill et Le major E. Stanley Rowbotham préconisent l’intubation pour administrer une anesthésie. Ces deux anesthésistes, en poste au service de chirurgie plastique de l’armée britannique à Sidcup pendant et après la Grande Guerre de 1914-1918, ont découvert qu’ils offraient un champ opératoire plus grand au chirurgien Sir Harold Gillies, en intubant par le nez les patients avec un tube en caoutchouc sans ballonnet.
La technique se développe durant la Première Guerre mondiale dans le domaine de la traumatologie faciale avec l’utilisation de sondes en gomme.
Depuis les années 1950, l’American society for testing materials définit les caractéristiques des tubes et du ballonnet.
Compte tenu de l’amélioration technique : visualisation directe à l’aide de laryngoscopes de plus en plus performants, matériaux de sonde mieux adaptés et bien tolérés, utilisation de divers masques laryngés, l’intubation dispose de nouveaux outils prometteurs. (source : medix.free.fr)
Voici une revue de détail, du matériel et des techniques disponibles pour faire face aux situations d’intubation difficile.
Certains matériels ne sont pas transposables et transportables pour le pré-hospitalier. À ce moment, les techniques plus simples, prennent le pas sur le matériel sophistiqué.
Le but de cet article est de décrire les matériels disponibles.
Un article sur l’intubation difficile, est également disponible sur le site de la SFAR ou en document PDF en bas de page.
Evaluation
L’évaluation doit être préalablement établie lors d’une consultation par le score de Mallampati. (facteur prédictif mais peu fiable).
Il y a un risque prédictif d’intubation difficile chez l’adulte
- si l’ouverture de la bouche est < 35 mm,
- si la classe de Mallampati est > 2
- et/ou si la distance thyro-mentonnière (ou distance de Patil) est < 65 mm.

On peut ajouter
- Mobilité mandibulaire (morsure de la lèvre supérieure)
- Mobilité du rachis cervical (extension-flexion maximale < 90°, dite classification de l’angle de Bellhouse et Doré).
Étude de la course du maxillaire supérieur, la tête passant de la position neutre, regard à l’horizon, à l’extension complète.
- Stade 1 : mobilité supérieure à 35°.
- Stade 2 : réduction de cette mobilité de un tiers.
- Stade 3 : réduction des deux tiers.
- Stade 4 : mobilité nulle.
Les stades 3 et 4 sont prédictifs d’intubation difficile
Selon le contexte, il est intéressant de rechercher
- IMC>35kg/m2
- périmètre du cou >45,6 cm
- pathologie cervico-faciale
- état pré-éclamptique
- diabète.
Il s’agit d’un classique dont l’incidence ne dépasse pas 2,1 % des diabétiques. Cependant, les signes prédictifs d’intubation difficile chez le diabétique doivent être recherchés, en particulier le classique signe de la prière. Ce dernier est lié à la glycosylation protéique non enzymatique responsable de la constitution d’un réseau collagène prédominant au niveau des articulations des mains. Cette raideur articulaire se traduit par l’impossibilité d’affronter les faces palmaires et les articulations interphalangiennes, réalisant le “signe de la prière”. Si ce signe est présent, le risque d’intubation difficile est réel. En son absence, un diabète évoluant depuis plus de 10 ans est associé à un risque accru d’intubation difficile.
Dans le contexte de l’urgence
– signes d’alerte :
- traumatisme cervico-facial (face ou rachis)
- pathologie ORL (cervico-faciale ou oropharyngée)
- brûlures cervico-faciales
Chez l’enfant, le syndrome de Pierre-Robin signe une difficulté fortement probable, à l’intubation.
Comparaison entre voies aériennes de l’adulte (à gauche) et de l’enfant (à droite) (d’après Riazi).

- 1. Palais ;
- 2. langue ;
- 3. épiglotte ;
- 4. cordes vocales ;
- 5. angle épiglotte-glotte.
- B. Orifice glottique de l’adulte (à gauche) et de l’enfant (à droite).
En parallèle on évalue aussi la ventilation au masque difficile (VMD), dont l’incidence est de 5% en chirurgie générale.
La VMD est présente en cas
- d’amplitude thoracique insuffisante, fuites
- capnogramme incorrect
- spo2 <92%
- utilisation du by-pass plusieurs fois
- appel d’un autre opérateur (ventilation à deux mains)
- pression d’insufflation >25 cm H2O
Les 6 critères prédictifs de VMD
- âge >55 ans
- index de masse corporelle >26kg/m2
- absence de dents
- limitation de la protrusion mandibulaire
- présence d’une barbe
- présence d’un ronflement lors du sommeil
VMD = au moins deux critères
VMD = Intubation difficile X 4
– Tout patient doit être préoxygéné
d’autant plus que :
- intubation difficile prévue
- ventilation au masque difficile prévue
- désaturation prévisible
Il peut être nécessaire de mettre une canule de Guedel, lors de la ventilation. Celle-ci doit se placer sur un patient correctement endormi, afin de supprimer tout risque de laryngospasme.
Il y a une technique que tout étudiant se doit d’apprendre et de maîtriser afin de placer correctement une Guedel. La bonne taille peut se choisir en positionnant la base de la canule à la commissure des lèvres, la pointe de la Guedel devant atteindre soit le lobe de l’oreille, soit le haut du cartilage thyroïde.
Attention chez l’enfant, qui se spasme très facilement, à ne pas trop enfoncer la canule. Il est parfois préférable de s’en priver temporairement à l’induction.
– Facteurs de risque de désaturation pendant l’intubation
- intubation en urgence avec séquence rapide
- VMD
- intubation prévue difficile
- obésité
- enfant < 1 an, ASA 3 ou 4, ronfleur ou infection des VAS
- sujet âgé
- BPCO
Volumes théoriques d’Oxygène chez l’adulte sain (en litres)
d’après Campbell IT
pris à
| emplacement | T0 | 1 minute | 3 minutes |
| CRF | 0,45 | 2,1 | 2,3 |
| SANG | 0,8 | 0,9 | 1 |
| TISSUS | 0,023 | 0,17 | 0,38 |
| TOTAL | 1,2 | 3,2 | 3,8 |
La CRF diminue chez
- l’enfant
- la femme enceinte
- l’insuffisant respiratoire
- l’obèse
- le nourrisson
- l’enfant avec infection des VAS
Ces terrains peuvent désaturer plus vite même si la dénitrogénation est bien conduite. Le temps d’apnée prévisible est court.


– La préoxygénation
la plus efficace
- en ventilation spontanée
- masque occlusif
- ballon de taille adaptée (>2 litres chez l’adulte)
- gaz frais > 5 litres/min
- Fio2 = 1
- pendant 3 min chez l’adulte et 2 min chez l’enfant
solution de rechange
- 8 inspirations profondes en 1 min avec débit d’O2 = 10 l/min
Contrôlée sur la FeO2 et la Spo2
- chez la femme enceinte : 4 capacités vitales pendant 30 secondes
- chez l’obèse VNI en AI+ peep avec proclive 30°
- chez l’insuffisant respiratoire, prolonger la préoxygénation sous contrôle de la FeO2
Il est recommandé de ventiler les patients dont la Spo2 chute en dessous de 95 %, même si estomac plein
Il est également important de bien connaître les critères d’extubation actualisés.
Définition de la SFAR : On considère qu’une intubation est difficile pour un anesthésiste expérimenté, lorsqu’elle nécessite plus de 10 minutes et/ou plus de deux laryngoscopies, dans la position modifiée de Jackson, avec ou sans compression laryngée (manœuvre de Sellick).
Il convient en ce cas, de changer de stratégie.
Soit en passant la main à un praticien plus expérimenté, soit en utilisant du matériel adapté.
L’expérience démontre qu’il vaut mieux éviter le recours à l’intubation nasale. Le risque d’épistaxis est important et peut s’avérer être une gêne.
Rappelons que l’intubation n’est pas indispensable, sauf en cas d’estomac plein. Si le patient n’est pas intubable mais ventilable, cela peut suffire à changer d’orientation stratégique, voire à couvrir l’intervention si celle-ci n’excède pas une limite raisonnable (inférieure à 30 minutes).
Enfin, l’avènement du sugammadex peut être une aide précieuse et sa présence doit être discutée car le coût n’est pas négligeable. Mais les études démontrent que ce surcoût réel, est contre-balancé par une économie en soins de suite (ventilation, voire complication comme le syndrome de Mendelson)
En gardant toujours à l’esprit que chaque cas est à apprécier individuellement, et qu’il n’y a pas de recette transposable à tous.
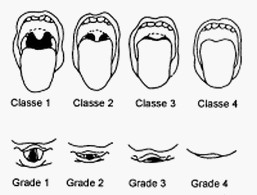
En pratique, avec une bonne exposition on doit visualiser ceci :
Cette classification, dite de Cormack-Lehane est faite lors de la laryngoscopie.
(Cormack RS, Lehane J. Difficult tracheal intubation in obstetrics. Anaesthesia1984 ; 39 : 1105-11)
A, B, C, D. Classes de Mallampati .
- A. Classe 1 : visibilité du palais mou, de la luette, des piliers et de la paroi postérieure du pharynx.
- B. Classe 2 : visibilité du palais mou, de la luette et de la paroi postérieure du pharynx.
- C. Classe 3 : visibilité du palais mou et de la base de la luette.
- D. Classe 4 : le palais mou est invisible.
Les classes 3 et 4 sont prédictives d’intubation difficile.
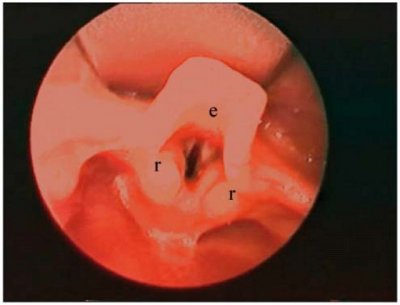
E, F, G, H. Grades laryngoscopiques de Cormack et Lehane .
- E. Grade 1 : la glotte est entièrement exposée.
- F. Grade 2 : la glotte est partiellement exposée ; la commissure antérieure n’est pas visualisée.
- G. Grade 3 : la glotte ne peut être exposée ; seule est visualisée l’épiglotte.
- H. Grade 4 : même l’épiglotte est inexposée.
Les grades 3 et 4 sont considérés comme une laryngoscopie difficile (d’après Samsoon et Young)
Le score POGO (percentage of glottic opening)
Le pourcentage d’ouverture de la glotte (POGO) représente la partie de la glotte visualisée. Le score varie de 0 % lorsqu’aucune glotte n’est vue à 100 % lorsque toute la glotte, y compris la commissure antérieure, est vue.
Dés études comparent les scores quand d’autres comparent les matériels utilisés.
En cas d’intubation difficile ou supposée l’être
commençons par
– changer de technique
Cette remarque s’adresse surtout aux étudiants.
– Corrigez votre geste, ne tenez pas votre manche du bout des doigts, positionnez vous en le tenant "comme un marteau", ne le tenez pas trop près de la lame.
– Ecartez-vous du patient. La "bavette dans la bouche du patient" n’est pas un bon geste. Il faut se décoller afin d’avoir une vue globale et garder la profondeur du champ visuel.
– Et surtout attention à ne pas becquer. La direction à donner à son manche de laryngoscope est vers les pieds et le plafond.
– Attention aux lèvres, surtout l’inférieure. Dégagez-la après introduction du laryngoscope.
– Enfin, évitez les doigts dans la bouche, peu hygiénique, car vos gants imprégnés de salive risque de contaminer le matériel (manche, respirateur, ballon...).
— -
— -
— -
- Les principes de l’intubation

– changer de sonde.
Parfois une sonde d’un diamètre trop important peut être une gêne à l’intubation. D’où la nécessité d’avoir un jeu de trois tailles différentes.
Certains plient la sonde, pour lui donner une courbe supplémentaire "pour aller chercher" la glotte plus facilement. Outre que les personnes qui utilisent cette technique, prennent leur sonde au niveau de la pliure, le bénéfice est loin d’être flagrant. Un article en parle.
– Si vous voulez vraiment être efficace, mettez l’extrémité de la sonde dans le raccord, en formant une boucle fermée. En laissant la sonde durant 5 minutes, la forme sera mémorisée et vous aurez une vraie efficacité, plus qu’une simple courbure qui est faussement rassurante.
– Position amendée de Jackson
En surélevant la tête (coussin sous l’occiput), la visualisation de la glotte en laryngoscopie est améliorée. Le rachis cervical doit être indemne de toute lésion.
En avoir la preuve : The Importance of Proper Positioning for Airway Management for Obese Patients
– La manœuvre BURP
La manœuvre BURP (backward upward rightward pressure, ) est une pression antéro- postérieure avec traction en haut et à droite du cartilage thyroïde, qui permet d’améliorer l’exposition de la glotte, grâce à un déplacement du cartilage thyroïdien du patient dans un mouvement d’abord postérieur puis céphalique. Cette manœuvre est pratiquée par un aide lors de l’exposition et de la tentative d’intubation.
Vidéo de la manœuvre burp
Elle ne doit pas être confondue avec la manœuvre de Sellick.
– La manœuvre de Sellick
Elle a pour but de prévenir la régurgitation du contenu gastrique et œsophagien vers le pharynx et son inhalation bronchique et alvéolaire lors de l’induction anesthésique. Elle n’est pas proprement dite une technique d’aide à l’intubation, mais est décrite ici afin de fixer les différences avec la manœuvre burp
Elle consiste à appliquer une force sur le cartilage cricoïde qui va alors comprimer l’extrémité supérieure de l’œsophage contre le corps vertébral de la vertèbre cervicale sous-jacente. L’appui se fait sur le cartilage cricoïde et non sur la pomme d’Adam, car le cartilage cricoïde est circulaire. En cas de vomissements, il faut arrêter cet appui, afin d’éviter l’hyper pression gastrique et œsophagienne.
La pression est exercée par les trois premiers doigts de la main d’un autre opérateur.
Le médius et le pouce maintiennent le cartilage cricoïde sur la ligne médiane. L’index exerce une pression perpendiculaire à l’axe du rachis cervical.
On fera cet appui dès la perte de conscience jusqu’au gonflage du ballonnet et la vérification de la bonne position de la sonde d’intubation.
Schmidt A (Acta Anaesth Scand 2001) a montré que 69 % des médecins ne connaissaient pas le niveau de pression à atteindre, et que des forces supérieures à 60 Newtons (6 kg) étaient exercées par 61 % des médecins dans son étude.
L’amplitude de la force doit être d’environ 3 kg. Cette force est suffisante pour prévenir la régurgitation et met à l’abri de la rupture œsophagienne.
On peut trouver une équivalence en appuyant ses doigts sur l’arête de son nez, jusqu’à entraîner une douleur ou on peut estimer la pression à l’aide d’une seringue de 50 ml, remplie d’air et obstruée à son extrémité selon le modèle de Ruth et Griffith. Avec le piston à la graduation 50 mL, exercer une dépression de :
- 12 mL (piston à 38 mL)= 20 N
- 17 mL (piston à 33 mL)= 30 N
- 20 mL (piston à 30 mL)= 40 N
Pour déplacer le piston jusqu’au repère 38 (ml) il faut appliquer une force de 2 kg, pour atteindre 33 (ml) il faut une pression de 3 kg. (Flucker CJ (The 50-millilitre syringue as an inexpensive training aide in the application of cricoïd pressure, Eur J Anaesth. 2000 ; 17(7) 443-7)
Pratiquement, jusqu’à la perte de la conscience, exercez une pression de 10 à 20 N. Dès la perte de la conscience jusqu’à la vérification de la position de la sonde d’intubation, la pression doit être égale à 30 N. En cas de survenue de régurgitation, il faut intensifier la force d’appui jusqu’au 40 N.
“En 2008, 22 articles avaient été publiés dans la littérature, parmi ceux-ci, Ralph & Wareham. (Anaesthesia 1991 ;46:40-1) Décrivent un cas de rupture œsophagienne lors de la pratique de la manœuvre de Sellick chez un patient éveillé.
La manœuvre de Sellick peut parfois perturber les conditions d’intubation, Snider (The "BURP" maneuver worsens the glottic view when applied in combination with cricoid pressure. Can J Anaesth. 2005 Jan ;52(1):100-4) écrivent que la manœuvre de Sellick ne perturbe pas les conditions d’intubation dans 65 % des cas, que par contre la manœuvre de Sellick seule détériore la visualisation de la glotte dans 12,5 % des cas (p = 0,279), et que la manœuvre de Sellick associée au BURP (Backward, Upward, Rightward Pressure) détériore la visualisation glottique dans 30 % des cas. notre conclusion est donc qu’il faut savoir arrêter la manœuvre de Sellick lorsque celle-ci compromet les conditions d’intubation sous laryngoscopie directe.” (source intubation.fr)
On retiendra
- En cas où la pression exercée n’est pas médiane, il y a un risque de déviation trachéale ;
- Une pression d’appui très forte peut mener à un aplatissement de la lumière trachéale ;
- Si l’opérateur applique la manœuvre avant que le patient perd conscience, le patient peut alors tousser d’où augmentation de la pression intra-gastrique ;
- Cette méthode est strictement contre indiquée chez les patients souffrant de vomissements actifs.
Cette critique de la manœuvre de Sellick est confirmée par une première étude menée chez près de 3 500 patients
Un groupe de recherche clinique réunissant 10 centres hospitalo-universitaires français sous la direction du Dr. Aurélie Birenbaum et du Pr. Bruno Riou de l’Hôpital de la Pitié-Salpêtrière, AP-HP et Sorbonne Université, a conduit la première grande étude randomisée sur l’intérêt de la manœuvre de Sellick dans l’induction de l’anesthésie générale en séquence rapide. La manœuvre de Sellick consiste à réaliser une occlusion manuelle de l’œsophage au niveau cervical en comprimant fermement le cartilage cricoïde sur les vertèbres cervicales pendant qu’est réalisée l’induction de l’anesthésie générale.
Les résultats de ces travaux, financés par le Programme Hospitalier de Recherche Clinique (PHRC national 2012) et menés chez 3 472 patients, sont publiés dans la revue JAMA Surgery.
La très faible incidence d’inhalation bronchique observée dans deux groupes de patients (manœuvre de Sellick vs manœuvre simulée) ne permet pas de démontrer de manière significative la non-infériorité de la manœuvre simulée, en d’autres termes que son absence n’augmente pas l’incidence des inhalations.
Cette étude implique des équipes de recherche de Sorbonne Université et de l’AP-HP, de nombreuses universités (Paris-Sud, Paris-Diderot, Paris 13, Amiens, Bordeaux, Haute-Normandie, Montpellier, Toulouse) et CHU (Amiens-Picardie, Bordeaux, Lille, Nîmes, Rouen, Toulouse).
Ces résultats ouvrent la voie à la remise en cause d’un dogme proposé en 1961 et suivi par la plupart des recommandations professionnelles internationales jusqu’à maintenant.
La manœuvre de Sellick consiste à réaliser une occlusion manuelle de l’œsophage au niveau cervical en comprimant fermement le cartilage cricoïde sur les vertèbres cervicales pendant qu’est réalisée l’induction de l’anesthésie générale. Cette manœuvre est recommandée dans l’induction en séquence rapide (ISR) de l’anesthésie générale lorsque le jeûne pré-anesthésique n’a pu être respecté (en cas d’urgence) ou lorsque l’estomac reste plein malgré le jeûne (occlusion intestinale, diabète, obésité, etc..). Elle vise à prévenir l’inhalation bronchique du contenu gastrique pendant l’induction de l’anesthésie, source de complications graves parfois mortelles (syndrome de détresse respiratoire aigu).
Bien que prônée dans la plupart des recommandations internationales, l’efficacité de cette manœuvre reste actuellement controversée. En effet, elle peut rendre l’intubation trachéale plus difficile pour l’anesthésiste et être source de complications traumatiques, voire favoriser de manière paradoxale les régurgitations du contenu gastrique.
Dans cette étude randomisée et menée en double aveugle, le groupe de recherche a évalué l’intérêt de la manœuvre de Sellick lors de l’induction en séquence rapide de l’anesthésie générale chez 3 472 patients. Les chercheurs ont comparé l’incidence de l’inhalation bronchique (critère principal) dans deux groupes de patients répartis de manière aléatoire : un groupe où la manœuvre était systématiquement appliquée (groupe Sellick) et un autre où elle n’était que simulée (groupe Sham). En dehors de l’application de cette manœuvre, la prise en charge des patients suivis pendant 28 jours ou jusqu’à leur sortie de l’hôpital était comparable.
Une inhalation bronchique a été observée chez 10 patients (0,6%) du groupe Sellick et 9 patients (0,5%) du groupe Sham.
Par ailleurs, les critères de jugement secondaires évaluant la qualité de l’exposition de la glotte lors de l’intubation trachéale (temps d’intubation, grade de Cormack et Lehane) étaient significativement différents et suggéraient plus de difficultés dans le groupe Sellick. Les autres critères de jugement secondaires n’étaient pas significativement différents (incidence des pneumopathies, durée du séjour à l’hôpital, mortalité).
Le Dr Birembaum et le Pr Riou concluent que cette première grande étude randomisée réalisée chez des patients nécessitant une induction en séquence rapide n’a pas permis de démontrer la non-infériorité de la procédure simulée de la manœuvre de Sellick dans la prévention de l’inhalation bronchique. Toutefois, la très faible incidence des inhalations dans les 2 groupes et l’existence de difficultés augmentées lors de l’intubation trachéale remettent en cause l’intérêt de cette manœuvre. Ils préconisent de rediscuter les recommandations d’experts sur l’intubation trachéale en anesthésie à l’aune des résultats de cette étude.
D’autres études randomisées seront nécessaires dans les populations exclues de cette étude, à savoir les femmes enceintes et les patients bénéficiant d’une intubation trachéale en urgence en dehors du bloc opératoire, notamment en médecine d’urgence pré-hospitalière.
Ce travail a été couronné par le 1er prix du comité scientifique en anesthésie-douleur lors du Congrès 2018 de la Société Française d’Anesthésie et de Réanimation (SFAR).
Source : Service de presse APHP, publié le 17/10/2018.
Effect of the cricoid pressure compared with a sham procedure in the rapid sequence induction of anesthesia : The IRIS randomized clinical trial
Aurélie Birenbaum, David Hajage, Sabine Roche, Alexandre Ntouba, Mathilde Eurin, Philippe Cuvillon, Aurélien Rohn, Vincent Compere, Dan Benhamou, Matthieu Biais, Remi Menut, Sabiha Benachi, François Lenfant, Bruno Riou.
JAMA Surgery 17 octobre 2018 17h 11am US ET / DOI : 10.1001/jamasurg.2018.3577
– Changer de lame
Lames droites de Miller permettant de charger l’épiglotte, manœuvre ayant ses pour et ses contre. (Il est préférable d’éviter de charger l’épiglotte).
Elle permet aussi de réaliser une intubation rétro-molaire, la lame dans la commissure labiale gauche, faisant un angle de 45° la sonde d’intubation dans la commissure labiale droite, longeant la deuxième molaire, avec le même angle. Les deux se retrouvant devant la glotte.
– Lames de Henderson
Récemment introduite, cette lame en forme de 2/3 de C, semble être de bon confort. Elle est commercialisée par le laboratoire Storz.
– Lames Américaines Anglaises ou Allemandes
Ceci n’a que peu d’importance mais il est bon de montrer quelques différences conceptuelles pour un acte qui reste standardisé quelque soit la latitude où il s’exerce.
La source lumineuse US est plus éloignée, et la partie supérieure est aplatie. Le design de Macintosh a peu évolué aux États-Unis qui sont restés très proches du modèle initial, mais les européens ont su y apporter un design plus élaboré.
– Utiliser une lame métal
qui semble donner un petit plus par rapport aux lames jetables en plastique.
– Changer de laryngoscope
Laryngoscope à bout becqué, dit laryngoscope de Mac Coy , un levier situé le long du manche du laryngoscope permet de relever l’extrémité distale mobile de la lame
– Mettre un manche court
pour les patients obèses, et dont le thorax peut être une gêne à l’exposition.
– Utiliser le masque laryngé
si l’intubation n’est pas nécessaire. (Temps opératoire réduit, pas d’estomac plein ou de reflux gastro-oesophagien). il est préférable d’utiliser des masques laryngés à usage unique,
en vue du principe de précaution pour les dispositifs en contact avec les muqueuses amygdaliennes.
Existe également en version armée
(Essayez gonflé avec 15 à 20 ml d’air pas plus et ne rajoutez rien. 100 % de succès avec cette technique)
A voir également cette vidéo
Il existe le Masque laryngé SureSeal®
doté d’un témoin de pression du coussinet : le Cuff pilot™
A quelle problématique répond-t-il ?
La mise au point du Cuff Pilot™ a été motivée par le nombre de preuves attestant de la nécessité de contrôler de façon systématique la pression des ballonnets des masques laryngés.
Des revues scientifiques ont mis en évidence un nombre croissant d’effets indésirables liés à un gonflage excessif du ballonnet ou par des fuites dues à son gonflage insuffisant.
Conçu pour garantir le contrôle des valeurs d’un simple coup d’œil, ce système permet d’avoir une réactivité en cas de changements de ces valeurs.
Toutefois un petit truc simple suffit à s’affranchir définitivement de ce contrôle fastidieux.
(extrait de l’article eurékiade)
NDLR : La pression du ballonnet est un “dada” des étudiants en anesthésie. Outre le contrôle à la seringue, en laissant revenir le piston naturellement, ou le contrôle avec le manomètre de pression, il existe un petit truc qui permet de s’affranchir définitivement de la contrainte que peut représenter cette vérification régulière, si vous introduisez du protoxyde d’azote.
Après intubation, raccorder le patient au respirateur et mettre d’emblée en circuit fermé. (La couche d’ozone vous en saura gré.) Puis au bout de 10 minutes, le temps que les concentrations s’équilibrent, dégonfler le ballonnet complètement, (l’équipe chirurgicale ne sera pas prête, et le patient ne risque pas d’être déjà en position de Trendelenbourg) prélever au niveau du filtre 10 ml de mélange gazeux et le réinjecter dans le ballonnet de la sonde d’intubation. Vérifier la pression de gonflage au manomètre, ajuster aux normes. La pression du ballonnet étant égale à celle du mélange donné, le gaz ne diffusera plus dans le ballonnet.
30 ans d’expérience valident ce "truc d’IADE" qui prend 5 secondes dans le pire des cas. ( Arnaud BASSEZ)
Impact of laryngeal mask airway cuff pressures on the incidence of sore throat in children.
Paediatr Anaesth. 2009 Mar 5.
Wong JG, Heaney M, Chambers NA, Erb TO, VON Ungern-Sternberg BS.
Department of Anaesthesia, Princess Margaret Hospital for Children, Subiaco, WA, Australie.
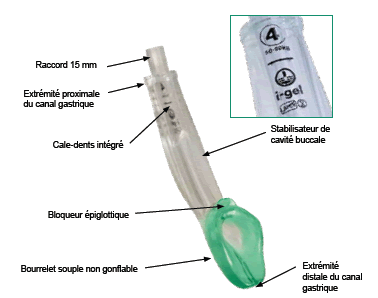
Un autre type de masque laryngé, le i-gel®,
dont la mise en place est aisée, et le procédé astucieux. fabriqué dans un élastomère thermoplastique de type gel souple. Il ne nécessite pas de gonflage, et il possède un petit ergot qui empêche la rétraction de l’épiglotte, ainsi qu’un canal en rapport direct avec la bouche œsophagienne, permettant l’aspiration directe.
Le i-gel est également disponible en taille pédiatrique (1,5-2-2,5)
— -
The Laryngeal Mask Airway : Expanding Use Beyond Routine Spontaneous Ventilation for Surgery
– Le copa (Cuffed Oropharyngeal Airway)
Se présente comme une canule de Guedel à laquelle on a ajouté un ballonnet gonflable. Ne protège pas les voies aériennes, tout comme le masque laryngé. semble être totalement passé de mode.
Coupe anatomique montrant le “cuffed oropharyngeal airway” (COPA) en place.
Le ballonnet antérieur relève la base de langue, le ballonnet postérieur assure l’étanchéité avec le nasopharynx.
Le COPA : choix de la taille
- A. COPA trop court : la base de langue fait hernie devant l’extrémité distale. L’étanchéité du nasopharynx n’est pas assurée par le ballonnet postérieur.
- B. COPA trop long : l’épiglotte est rabattue devant les voies aériennes.
- C. COPA en bonne position.
– Le fastrach®
C’est un bon moyen d’intuber. Une sonde d’intubation coulisse dans le masque laryngé et, suite à une traction levant l’orifice du masque laryngé pour le mettre face à l‘ouverture de la glotte on pousse la sonde dans la trachée.
Nécessite toutefois un certain apprentissage et devrait être utilisé sur les patients faciles, afin d’emmagasiner de l’expérience.
Citons également la variante avec écran, le LMA C-trach.
Bien qu’analogue au fastrach "classique", l’ajout de l’écran peut être un avantage, car il permet de visualiser l’intromission de la sonde dans la trachée. Toutefois, la lourdeur relative du système et de la manœuvre, n’en font sans doute pas le meilleur choix en cas de recours à un système palliatif rapide.
– Le mandrin d’Eschmann
On l’introduit par son côté becqué, sous contrôle visuel autant que faire se peut, jusqu’à sentir une "butée", signant l’arrivée sur lla carène. L’aide fait coulisser la sonde d’intubation autour du guide, comme une méthode de Seldinger. L’introduction se fait toujours sous contrôle visuel. Une fois la sonde en place, on la maintient pendant que l’aide retire le mandrin d’Eschmann. Un risque d’extubation restant possible durant cette manœuvre.
— -
– Le S-Guide
Dérivant du guide d’Eschmann, le S-Guide est un guide malléable pour la gestion des voies aériennes difficiles. On peut également apporter de l’oxygène sur la taille 11Fr et 15 Fr mais pas pour le 8 Fr. Son embout souple atraumatique apporte un surplus de confort au patient.

La partie malléable permet au S-Guide d‘être modelé à la géométrie requise entre l‘extrémité orange et la marque à 42 cm. La forme en crosse de hockey à l‘extrémité distale et l‘angle droit au niveau du connecteur sonde ET peuvent être facilement obtenus sans compromettre l‘oxygénation.
« La danse de la sonde endotrachéale »
L‘utilisation d‘un mandrin ou bougie malléable fait partie des algorithmes de gestion des voies aériennes difficiles. Leur utilisation en intubation de routine augmente du fait du récent développement de la vidéo-laryngoscopie. Toutefois la manoeuvrabilité de l‘extrémité distale de la sonde endotrachéale peut être nécessaire pour passer de l‘ouverture de la glotte à l‘intérieur de la trachée. La rigidité spécifique du S-Guide le rend compatible avec la technique de « danse de la sonde endotrachéale »*.
En combinant la rotation de la sonde endotrachéale avec le retrait du S-Guide on obtient un mouvement tridimensionnel de l‘extrémité de la sonde (Fig. 1 and 2). Le S-Guide doit être lubrifié et courbé au marquage noir épais pour former un angle approximatif de 35°. Le retrait du guide va déplacer la partie distale de la sonde pendant que la rotation va conduire l‘extrémité à « danser » (mouvement circulaire de haut en bas). L‘extrémité orange peut dépasser de la sonde endotrachéale. Ces manoeuvres du S-Guide pendant l‘intubation sous vidéo laryngoscopie peuvent être extrêmement utiles lors de difficultés rencontrées pour avancer la sonde au delà de la glotte en cas d‘anatomie modifiée ou de tumeurs oropharyngées.


VBM S-Guide with video laryngoscope (english)
Voir une autre vidéo du S-Guide
En savoir plus sur les guides
- Grape, S / Schoettker, P :. The role of tracheal tube introducers and stylets in current airway management. J Clin Monit Comput. 2016 Apr 16.
- *Schoettker, P. : The orotracheal tube dance. Eur J Anaesthesiol. 2015 Jun ; 32(6) : 443-4.
- Batuwitage, B. et al : Comparison between bougies and stylets for simulated tracheal intubation with the C-MAC D-blade videolaryngoscope. Eur J Anaesthesiol 2014
- Apfelbaum, JL et al : Practice guidelines for management of the difficult airway : an updated report by the American Society of Anesthesiologists Task Force on Management of the Difficult Airway. Anesthesiology 2013 ; 118 : 251-70
- Evans, H. et al : Tracheal tube introducers : choose and use with care. Anaesthesia 2010 ; 65 : 859
– Le combitube®
description faite par le Dr Ph Rault sur le site adrenaline112.org
c’est un dispositif à double lumière, fait de deux sondes accolées.
– Une sonde sans ouverture à son extrémité distale, et perforée en sa partie médiane.
– Une sonde trachéale, légèrement plus courte et aux deux extrémités ouvertes.
Ce dispositif est muni de 2 ballonnets
– un ballonnet distal de petite taille destiné à assurer l’étanchéité soit dans l’œsophage soit dans le trachée,
– un ballonnet proximal oro-pharyngé de grande taille.
Avantage : protège des régurgitations.
Mise en place
Introduction à l’aveugle avec la main droite en restant médian avec un mouvement légèrement incurvé vers le bas.
On gonfle alors le ballonnet proximal (85 à 100 ml en fonction de la taille du dispositif) jusqu’à fixation solide.
On gonfle alors le ballonnet distal (5 à 12 ml ou 5 à 15 ml en fonction de la taille du dispositif).
Ventilation
En position œsophagienne
Le combitube® se place en position œsophagienne dans 90% des cas, la première tentative de ventilation est effectuée sur la sonde œsophagienne et l’air pénètre dans la trachée par les perforations de sa partie médiane. La seconde lumière sert à l’aspiration gastrique.
En position trachéale
Quand le contrôle auscultatoire au niveau des poumons reste négatif, le Combitube® est en position trachéale. Il suffit alors de changer de connecteur et de ventiler par la sonde plus courte.
Voir une vidéo de démonstration
– Le tube laryngé LTD-S
Système supraglottique des voies respiratoires. Le LTS-D, est un outil qui offre une perméabilité des voies respiratoires et la ventilation à pression positive. LTS-D, est facile à insérer et est stratégiquement conçu pour minimiser les traumatismes des voies respiratoires. Le LTS-D offre la possibilité de passer facilement d’une sonde gastrique par un deuxième canal de la voie aérienne.
VBM LTS-D Animation FR.
Emergency airway management in trauma patients using laryngeal tube suction.
Schalk R, Meininger D, Ruesseler M, Oberndörfer D, Walcher F, Zacharowski K, Latasch L, Byhahn C.
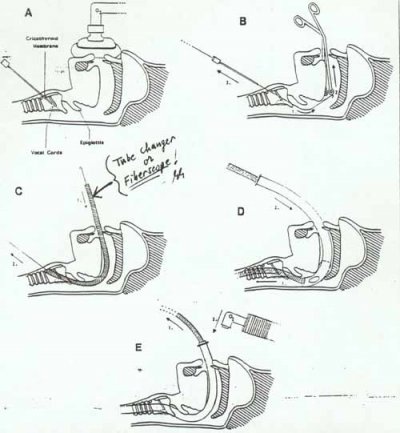
– Utiliser le stylet lumineux ou trach light®
Permet une intubation à l’aveugle, sans mobiliser le rachis. La technique repose sur le principe de trans-illumination au travers de la membrane crico-thyroïdienne et permet ainsi l’intubation "à l’aveugle".
– Utiliser le laryngoscope de Bullard
Le laryngoscope de Bullard permet une visualisation de la glotte et une intubation, il nécessite 6 mm d’ouverture de bouche, il existe en trois tailles de poids adulte, pédiatrique, néonatale. Il se stérilise à froid.
ou une variante, le laryngoscope de Upsher.
– Le laryngosope de Bonfils
Le laryngoscope de Bonfils est un laryngoscope rigide pour intubation rétro molaire, il est réutilisable.
Il peut s’associer à un système de visualisation.
Une publication décrit son utilisation en extrahospitalier, cette publication concerne six patients traumatisés portant une minerve, dont un ayant eu deux échecs d’intubation sous laryngoscopie.
Les auteurs rapportent 100 % de réussite au premier essai ( Byhahn C et all, Eur J Emerg Med 2007 Feb ;14(1):43-6 )
mais cette étude est contredite par celle de Boedeker
– Le laryngoscope de Berman
Permet de forcer la courbure de la sonde d’intubation
– Le glidescope.
Instrument servant à visualiser les cordes vocales par vidéo. La nouveauté résidant à une vue indirecte, puisque sur un écran décalé du patient.
Je vous renvoie sur ce site, où vous y verrez des vidéos, ainsi que sur la videothèque et ses suivantes.
À noter, depuis le mois de juin 2007, l’arrivée du système Cobalt, à usage unique facilitera l’utilisation de ce matériel.
– Le laryngoscope de Mc Grath
N’est ni plus ni moins qu’une lame de glidescope avec un écran portatif, monté sur le manche. La vidéo nous le montre, mais l’utilisateur manque de pratique...
La lame de visualisation est recouverte par une lame en plastique jetable. Les lames x blade sont une aide supplémentaire, de par leur courbure accentuée. Etonnamment il n’y a pas de lames 5 destinées aux obèses.
On peut avancer la lame sur trois positions en fonction de la morphologie du patient
Ce laryngoscope est un outil très utile, pratique et léger. Il reste toutefois fragile par son écran dénué de protection. (bris, rayure...) et par une consommation de piles importante. (il convient de les ôter du manche).
Le Mc Grath semble s’imposer comme l’alternative la plus utilisée actuellement.
Le sccore POGO : Pourcentage d’Orifice Glottique Observable ou Percentage of Glottic Opening.
La méthode de classification la plus couramment utilisée est la méthode de Cormack Lehane.(cf plus haut). L’expression numérique du pourcentage de l’ouverture glottique (POGO = percentile de l’ouverture glottique) est une autre façon de quoter la visualisation. un score POGO de 100 % compte pour une visualisation complète du larynx à partir de la commissure antérieure vers la partie postérieure cartilage, tandis que 0 % indiquaient une absence totale d’ouverture glottique.
Assessment of laryngeal view : percentage of glottic opening score vs Cormack and Lehane grading
Cette vidéo montre une astuce pour changer aisément et de façon économique, les piles du Mc Grath.
La forme de la sonde donnée par le mandrin court (à angle droit, voire presque contre-coudé) peut être évitée, en glissant un mandrin d’Eschmann en lieu et place. On peut alors se poser la question de l’intérêt du mac Grath dans ces conditions.
A noter le nouveau design du Mc Grath depuis 2012.
Enfin, pour la petite histoire, l’entreprise Aircraft Medical fondée par Matt McGrath a été rachetée par Medtronic le 17 novembre 2015, pour 110 millions de dollars.
Pour finir, il est intéressant de relever la "filière Écossaise" concernant la production des laryngoscopes.
- Laryngoscope de Mac Intosh
- Lame de Mac Coy
- Laryngoscope de Mac Grath
– Laryngoscope de Coopdech
Concept très proche du Mac Grath. La taille de l’écran peut faire la différence. En vision et en poids...
– Le laryngoscope de Venner
Variation sur le thème du macGrath.

– UE Video Laryngoscope
Encore et toujours le même principe.

– Le Copilot VL
Toujours basé sur l’angulation de la lame suivant le principe du glidescope.
Présenté par Amy Sheppard et Jay Tydlaska, CRNA (IADE américains)
(ergonomiquement, il serait mieux de le placer sur le côté du patient que derrière soi...)
On peut voir d’autres vidéos
– L’airtraq
Concept de laryngoscope avec une lame type glidescope. La vue se fait en directe.
Variation sur le thème du glidescope et du laryngoscope de Mac Grath. L’airtraq et d’un dispositif d’intubation par visualisation directe de la glotte. C’est un dispositif à usage unique, existant en taille adulte et pédiatrique.
Il se compose d’un dispositif de visée optique, associé à une gouttière placée sur le côté droit, dans laquelle se place la sonde d’intubation.
Ce dispositif a été inventé par le docteur Pedro Acha Gandarias, urgentiste et ophtalmologiste.

– Airway scope

Très proche de l’airtraq

— -
– Res-Q-scope

Air traq avec un écran "à la mac Grath".
– Laryngoscope King Vision


Sur le même principe que l’airtraq entre autre.
– Ambu ascope2

Pour en savoir plus sur le produit
– Le respiscope

Proche de l’airtraq avec un nuage d’Upsher. A voir
– Le trueView

Concept intéressant et innovant, permettant apparemment une facilité d’exécution. Développé par la société truphatek
Lire le document PDF (en anglais) en fin d’article

Le truphatek evolution2 se pare d’une vision haute.

– Le Easyscope
derrière ce nom se trouve un nouveau concept, simple et apparemment facile d’utilisation.
– Le Trach view

"Mariage" entre un laryngoscope et un fibroscope.

– La sonde d’intubation etview

Dans la lignée de l’intubation sur un écran, l’etview propose une sonde d’intubation munie à son orifice, d’une source lumineuse par led et un micro capteur ccd couleur dont l’image se projette sur un écran portatif de 7 pouces, autonome car avec une batterie et monté sur roulettes, à l’image du glidescope.
A noter que l’on peut aussi connecter la sonde sur un ordinateur ou sur tout autre support compatible. (L’idéal serait peut-être l’i-phone ou un téléphone portable à écran suffisamment large pour permettre une utilisation large même en espace réduit).
On utilise toujours le laryngoscope classique. Le bout de la sonde d’intubation "filme" la progression vers la glotte.
Les tailles disponibles sont 7, 7.5 et 8

Intérêt :
– Les intubations difficiles
– Les intubations sélectives car on peut aller dans la bronche souche désirée et vérifier in situ les éventuelles sutures bronchiques.
– La formation avec la simulation sur mannequin
Limitations :
– Le coût non négligeable, à ce jour. Une sonde coûte 110 euros l’unité.
L’importateur offre le moniteur (400 euros) dès un certain nombre de sondes commandées.
A pondérer toutefois avec l’achat d’un fibroscope et son entretien.
Il n’est pas dit que ces sondes soient moins "compétitives" en terme de prix, de maintenance et d’hygiène.
– Le site etview
Ricardo Riveros MD et al. Canadian Journal of Anesthesia/Journal canadien d’anesthésie, February 2013
– Introduction
Le vidéolaryngoscope GlideScope® possède une lame recourbée à 60°, et la lame du vidéolaryngoscope Truview PCD™ dispose d’une lentille optique qui fournit une vue réfractée à 46° de l’angle de vision. Malgré les bons résultats obtenus avec le GlideScope chez l’adulte, peu d’études publiées portent sur son utilisation chez l’enfant. C’est pourquoi nous avons testé notre hypothèse primaire en deux volets, soit que les vidéolaryngoscopes GlideScope et Truview PCD offraient une meilleure visualisation que la laryngoscopie directe et qu’ils n’étaient pas inférieurs quant au temps nécessaire à l’intubation.
– Méthode
Cent trente-quatre patients (nouveau-nés à 10 ans, statut physique ASA [American Society of Anesthesiologists] I-III) devant subir une intervention en chirurgie générale ont été randomisés à recevoir une intubation trachéale avec un vidéolaryngoscope Truview PCD ou GlideScope ou avec une laryngoscopie directe (lame de Macintosh). La visualisation de la glotte a été notée à l’aide d’une échelle de Cormack-Lehane. Le temps nécessaire à l’intubation (défini comme le temps entre le moment où le dispositif est entré dans la bouche du patient jusqu’à détection de CO2 télé-expiratoire) et le nombre de tentatives ont été notés.
Résultats
Les scores de Cormack-Lehane obtenus à l’aide du GlideScope (P > 0,99) et du Truview PCD (P = 0,18) n’étaient pas supérieurs à ceux obtenus par laryngoscopie directe. En outre, le score obtenu avec le GlideScope était significativement moins bon que celui obtenu par laryngoscopie directe (P < 0,001). Il y a eu moins de scores de Cormack-Lehane de grade I avec le GlideScope qu’avec le Truview PCD (14 % vs. 82 %, respectivement ; intervalle de confiance [IC] 95 % −91 % to −46 %). Les médianes [Q1, Q3] du temps nécessaire à l’intubation étaient : 39 [31, 59] sec, 44 [28, 62] sec, et 23 [21, 28] sec avec le GlideScope, le Truview PCD, et la laryngoscopie directe, respectivement, et les médianes des différences étaient de 14 sec (IC 95 % 7 à 26, GlideScope – laryngoscopie directe) et 17 sec (IC 95 % 6 à 28, Truview PCD – laryngoscopie directe).
– Conclusion
Les scores de Cormack-Lehane obtenus à l’aide des vidéolaryngoscopes GlideScope et Truview PCD n’étaient pas supérieurs à ceux obtenus par laryngoscopie directe. Avec le GlideScope, la visualisation était significativement moins bonne qu’avec la laryngoscopie directe. L’utilisation des systèmes GlideScope et Truview PCD devrait se restreindre aux patients présentant des indications spécifiques.
A lire : Improvement in Cormack and Lehane grading with laparoscopic assistance during tracheal intubation
D’autres documents sont disponibles en fin d’article
– Intubaid flex
Sorte de guide d’Eschmann avec vision en direct de la glotte. Laboratoire ezcmedical
– Le disposcope
Semble assez simple à utiliser.
– Le laryngaSEE
Là encore, un masque laryngé avec une source vidéo afin de mieux contrôler le geste.
(hélas, le site a supprimé toute photo du produit...)
– InnoScope
Un guide, une source vidéo portable. C’est le matériel proposé ici.
– Le laryngoscope de Magboul
Sans doute le plus étrange et curieux. Ce laryngoscope semble faire la synthèse de beaucoup de matériel vu ci-dessus.
– Laryngoscope de Cantrell
Sortie en 2006. Le concept est d’appuyer sur un levier pour soulever l’épiglotte.
– Le laryngoscope IntuBrite™
Assortie de deux lampes, la vision est en améliorée. Utilisé par le corps des marines américains, ainsi que les pompiers et les paramedics des USA.
A voir le site de la société
– Le fibroscope
A ce titre, je persiste à dire que les IADE doivent au même titre que les MAR pouvoir bénéficier d’une formation à la fibroscopie. Il semble qu’enfin je sois entendu car une formation concernant les médecins comme les IADE est délivrée. Reste à savoir si au quotidien on nous laissera la main...
Actuellement considérée comme la technique de référence pour les intubations difficiles, elle ne s’applique toutefois pas au contexte de l’urgence. Un apprentissage est nécessaire à sa bonne manipulation.
Il est indispensable d’avoir un patient à jeun, afin de pouvoir réaliser la fibroscopie sous sédation, en ventilation spontanée conservée.
Le passage par la voie nasale est la plus commune, mais elle n’épargne pas pour autant l’épistaxis.
De plus les sécrétions envahissantes peuvent gêner la visualisation. Sans parler de la mauvaise qualité de la lumière froide ou des fibres optiques en cas de matériel un peu vieux.
– Cricothyrothomie
« Le plus difficile dans la cricothyroïdotomie c’est de trouver le couteau » Peter Rosen, MD
Au bloc, sera idéalement exécutée par le chirurgien. En pré hospitalier, il convient d’utiliser le matériel approprié. Le quicktrach®
ou
Enfin pour mémoire, je cite la fameuse technique du stylo bille. Mais de nos jours, il me semble plus facile d’avoir dans son kit un cathlon de 14 gauge qu’un stylo bic®.
Il faut piquer dans la dépression du cartilage thyroïdien, la membrane intercricothyroïdienne, pointe inclinée vers le thorax. On visualise la bonne position par aspiration d’air par une seringue. Deux techniques : soit la seringue est vide et l’air sera aspiré sans effort, soit la seringue peut contenir quelques millilitres de lidocaïne pour injection en locale et faciliter la tolérance du système. L’air aspiré fera des bulles dans la lidocaïne et marquera la bonne positon du catheter. (on peut utiliser du sérum physiologique en lieu et place de la lidocaïne).
Le corps d’une seringue de 20 ml s’adaptera sur le cathlon et on pourra y placer une sonde d’intubation à l’intérieur, ballonnet gonflé.
Cette solution n’est préconisée que dans des cas désespérés, loin de toutes structures sanitaires.
A lire la trachéotomie de sauvetage
– La jet-ventilation

est une technique un peu tombée en désuétude, mais qui apporte un bénéfice au praticien ORL notamment.
La technique est la même que celle décrite ci-dessus.
Cependant, elle n’est pas en première ligne de "l’arsenal" des techniques d’urgences en cas de grandes difficultés d’intubation. Ce qui peut être dommage car elle est assez simple à mettre en place.
Il faut posséder le matériel adapté et maîtrisé un tant soit peu la ponction intercricothyroïdienne.
– GuideIN Tube
Petit dernier de la panoplie, proposé par une équipe de l’Université hébraïque de Jérusalem, programme de Biodesign. Il s’agit d’un système qui s’apparente à un fibroscope. Cet appareil identifie automatiquement les poumons en utilisant une source infrarouge et navigue vers elle. Le dispositif a été testé avec succès sur des cadavres au Centre médical Hadassah, et les essais cliniques débuteront dès 2014.
Une source de lumière infrarouge est placée contre la peau à l’extérieur de la trachée du patient. Des détecteurs placés à la fin du tube GuideIN "voient" que la lumière brille à travers l’intérieur de la trachée, et dirigent la sonde comme élément de guidage souple du tube pour pointer dans sa direction. L’élan vers l’avant du tube est fourni par la main, mais il se dirige seul.
« Nous avons vraiment pensé à l’ambulancier », a déclaré Itai Hayut , l’élève-ingénieur qui a mis en place ce projet. « Nous voulions quelque chose de simple et compact. Quelque chose auquel chacun peut se fier à coup sûr. Et je crois que nous avons réussi le pari. »
NDLR Il est intéressant de noter les propos du Dr Elchanan Fried, directeur de l’unité de soins intensifs au Hadassah Medical Center, et expert clinique du groupe.
“Je crois fermement que GuideIn Tube représente l’avenir de l’intubation. Le dispositif vise un marché de 3 milliards de dollars, qui devrait augmenter de 5 % par an.”
Parler d’argent avant de parler de bénéfices...pour les patients, comment dire... ?
NB : Edit du 18 mai 2019. Les propos du Dr Fried ne sont plus sur le site de la chambre du commerce d’Israël. Sans doute une prise de conscience à retardement les aura fait supprimer... (AB)
– Le Kepler Intubation System (KIS)
Mis au point par le Dr Thomas M. Hemmerling, spécialiste au Centre universitaire de santé McGill (CUSM) et professeur en anesthésie à l’Université McGill et son équipe, le KIS faciliterait la procédure d’intubation et diminuerait les complications associées au contrôle de la ventilation. La première intubation mondiale entièrement robotisée d’un patient a été réalisée à l’Hôpital général de Montréal par le Dr Hemmerling en avril 2011.
« Le KIS nous permet d’utiliser un laryngoscope robotisé équipé d’une vidéo et dirigé depuis un poste de travail à distance, explique le Dr Hemmerling, qui est également chercheur en neurosciences à l’Institut de recherche du CUSM. Ce système robotisé permet à l’anesthésiste d’insérer une sonde endotrachéale dans la trachée du patient avec une haute précision. »
Les difficultés dues aux caractéristiques variables des patients [...] seraient grandement éliminés avec l’utilisation du KIS.
« L’équipement de haute technologie a révolutionné la manière dont la chirurgie est pratiquée, permettant au chirurgien d’exercer avec une plus grande précision et quasiment sans effort physique. Selon moi, le KIS peut apporter à l’anesthésie ce que les systèmes robotisés ont apporté à la chirurgie », déclare le Dr Armen Aprikian, directeur du département d’urologie du CUSM, qui a réalisé l’opération pratiquée sur le premier patient intubé à l’aide de KIS.
« Nous pensons que le KIS peut aider les anesthésistes à utiliser leur bras et leurs mains avec moins de force, mais avec une plus haute précision et plus sûrement. Un jour, il pourrait devenir la pratique standard de la gestion des voies respiratoires », conclut le Dr Hemmerling, dont le laboratoire a développé McSleepyTM en 2008, le premier système d’anesthésie robotisé au monde qui permet l’administration automatique de médicaments d’anesthésie.
source : mcgill.ca
— -
– Naso-Flo®
Extrait de la plaquette publicitaire du dispositif
Le dispositif d’intubation nasopharyngée Naso-Flo® permet une administration directe d’oxygène, tandis que les évents d’humidification positionnés vers l’extrémité distale facilitent le transfert de chaleur et d’humidité. Il peut également être fourni avec un indicateur respiratoire optionnel avec ou sans filtre hydrophobe.
- Fabriqué à partir de silicone souple réduisant le risque de traumatisme lors de l’insertion
- Fournit de l’oxygène directement dans le pharynx, réduisant l’espace mort anatomique
- Une fois le volume courant du patient dépassé, les voies respiratoires supérieures deviennent un réservoir naturel pour l’oxygène restant
- Rentable - Réduit le besoin d’un masque à oxygène avec l’avantage supplémentaire d’améliorer la visibilité de la cavité buccale du patient
- Convient à une large gamme d’applications cliniques
– La sonde de NIM (nerve integrity monitor)
Pendant l’intervention une sonde d’intubation comportant deux capteurs est placée en regard des cordes vocales. Le chirurgien dispose d’un petit stylet ou neurostimulateur. Quand ce stylet est positionné à proximité du nerf récurrent, il entraîne une mobilisation de la corde vocale qui vient au contact du capteur et déclenche un signal. Ce monitoring permet de confirmer la localisation précise du nerf et de vérifier une fois la première lobectomie réalisée que le nerf fonctionne bien avant de débuter la chirurgie controlatérale dans les thyroïdectomies totales.

source : chirurgie-thyroide.fr
– En pré hospitalier
La technique décrite ci-dessous ne relève que de ma propre expérience. Elle n’a fait l’objet d’aucune étude ni publication. Je ne l’ai pratiqué qu’une seule fois, devant un patient ayant un fracas facial, alors que j’étais en poste en unité de médecine préhospitalière. Elle m’est venue spontanément à l’esprit. Je ne l’ai pas reproduite depuis dans le confort du bloc opératoire et avec tous les matériels disponibles actuellement.
De là à l’appeler la technique d’intubation de BASSEZ...
On peut utiliser la technique suivante :
– La double intubation
Intuber volontairement l’œsophage et gonfler le ballonnet. Puis avec un mandrin rigide malléable, donner une inclinaison à 45° à la sonde qui ira « chercher » plus facilement la glotte, voire utiliser un mandrin d’Eschmann (indisponible au moment de la réalisation de ce geste). On peut aussi mettre l’extrémité de la sonde (là où il y a le ballonnet), dans le raccord à l’autre extrémité, (raccord standardisé « Cobb ») afin de former un cercle entier. La sonde au bout de quelques minutes prend la forme et l’extrémité ainsi courbée ira facilement dans la glotte. Suppose donc une certaine difficulté prévisible pour façonner la sonde de cette manière...et la capacité à ventiler le patient sans problème.
Une fois en place, après les vérifications d’usage, la sonde "œsophagienne" pourra être ôtée. En cas de vomissement, le contenu stomacal peut être dirigé à l’extérieur à condition qu’il ne bouche pas la sonde "œsophagienne"en partie ou en totalité. Dans ce cas, une aspiration in situ dans la sonde pourra vider légèrement l’estomac ou limiter les effets du reflux.
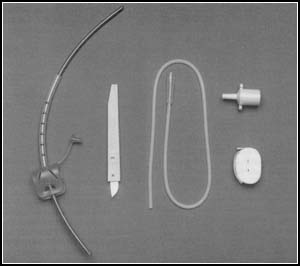
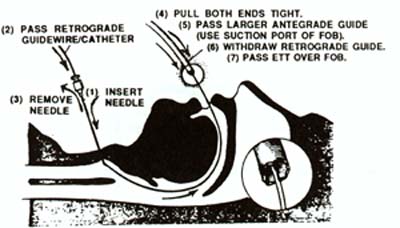
– L’intubation rétrograde.
Technique un peu abandonnée. Mais elle reste utile dans certains cas (fracas facial par exemple).
Il faut garder à l’esprit les risques de saignement et de ponction de la thyroïde si les repères anatomiques ne sont pas maitrisés.
Dans ce cas il appartient au médecin d’apprécier le bénéfice/risque.
La technique est assez simple : il faut palper au niveau du cou, sous le corps thyroïdien, une petite dépression cartilagineuse : la membrane intercricothyroïdienne. On utilise un matériel adapté, sinon, un cathéter veineux long de 60 cm peut faire office, ou un set de péridurale qu’on aura pris soin de prendre au bloc...
On ponctionne le creux avec une aiguille montée sur une seringue, le vide à la main, en inclinant la ponction vers la tête (et pas vers les pieds).
On aspire progressivement au fur et à mesure, jusqu’au moment où l’on sera dans la trachée et où l’aspiration ramènera de l’air.
On introduit le cathéter à travers l’aiguille, jusqu’à ce qu’il apparaisse dans la bouche, on le saisit grâce à la pince de Magill et on le passe dans la sonde d’intubation en s’assurant qu’il dépasse du côté de l’opérateur. (Même technique que le mandrin d’Eschmann)
On retire l’aiguille et on bloque le cathéter avec une pince quelconque (Péan, Köcher…) ou un aide le tient correctement.
On descend la sonde jusqu’à buter. On relâche le cathéter qui sera entraîné par la sonde dans la trachée.
On retire le cathéter, on gonfle le ballonnet, on ausculte.
*document metro health anesthesia
– Intubation inverse, technique dite de "l’intubation au piolet"
Texte tiré de la regrettée revue urgence-pratique ; (le terme IADE étant complètement absent de l’article...je me suis permis de l’ajouter, car si les urgentistes intubent, l’expertise indéniable de l’IADE est un atout qu’il convient de mettre en avant, même si celui-ci n’est pas un personnel médical. Il peut toutefois apporter une contribution non négligeable. Il serait temps que les médecins urgentistes s’en aperçoivent !).
"Dans le contexte de l’urgence extra-hospitalière, l’intubation oro-trachéale pose parfois un problème d’apparence insoluble. Le patient peut en effet se trouver dans une position ne permettant pas au médecin (ou à l’IADE) de l’aborder en se positionnant « côté tête » (obstacle ou excavation interdisant l’accès). Il peut en outre être temporairement impossible ou inopportun de déplacer la victime pour rendre ses voies aériennes plus accessibles (victime tombée au fond d’un puits, incarcération sous une charge, suspicion de fracture du rachis). Dans ces conditions il peut être très utile de connaître la technique d’intubation inverse également appelée « intubation au piolet ».
Technique
L’accès côté tête étant impossible, la technique consiste à modifier les habitudes de positionnement de l’opérateur par rapport à la victime étendue sur le sol. Les auteurs proposent d’enjamber le patient afin de se positionner face à lui, buste fléchi.
Le laryngoscope est tenu en main droite et sa lame est dirigée vers le haut (comme un piolet). Elle est introduite délicatement dans la bouche et enfoncée prudemment jusqu’au sillon glosso-épiglottique en ayant bien soin de ne pas charger l’épiglotte. On exerce alors une traction douce sur le manche, en direction des pieds du patient pour permettre l’exposition correcte de la glotte et des cordes vocales.
La sonde d’intubation, tenue en main gauche, concavité de la courbure vers le haut, est alors introduite. Il est conseillé d’utiliser un mandrin préformé pour faciliter le guidage de la sonde jusqu’à l’orifice glottique. Dès que le ballonnet a disparu derrière les cordes vocales il ne reste plus qu’à le gonfler et à fixer la sonde solidement.
Le médecin, (ou l’IADE) surtout si il est assez grand, peut avoir intérêt à s’agenouiller complètement au dessus de la victime (sans prendre appui sur le thorax !) pour pouvoir approcher son visage le plus possible de la bouche du patient et aligner l’axe de son regard avec l’axe bouche - pharynx - larynx de la victime.
Avantages
L’intubation peut être réalisée lorsqu’il est impossible de se placer à la tête du patient.
Une fois passée la surprise initiale (inversion des habitudes de travail, inversion des repères anatomiques) force est de constater que la méthode de travail devient très vite naturelle, surtout pour un opérateur peu expérimenté. En effet, le laryngoscope est tenu en main droite (plus de précision pour les opérateurs droitiers), et la traction sur le manche s’exerce selon un axe qui ne permet pas de réaliser un malencontreux mouvement de levier contre les arcades dentaires (risque de bris de dents diminué par rapport à la méthode classique).
Il est possible de sécuriser la manœuvre en plaçant un secouriste latéralement par rapport à la tête du patient afin d’en assurer le maintien pendant l’opération. Il est tout à fait possible de s’entraîner à cette technique (ou de la tester pour se faire une opinion) en utilisant un mannequin d’intubation.
Inconvénients
Un léger temps d’adaptation est nécessaire pour retrouver ses repères dans cette position où tout est inversé par rapport à la technique conventionnelle.
La prise en main du laryngoscope étant particulièrement ergonomique, on peut parfois avoir tendance à enfoncer la lame un peu trop loin et à charger malencontreusement l’épiglotte. Ce risque peut être limité par l’emploi systématique d’une lame courbe de taille 3.
Conclusion
La technique de « l’intubation au piolet » nous paraît devoir intéresser le médecin (ou l’IADE) de premiers secours qui est souvent amené à travailler dans des situations aussi inconfortables qu’inattendues. Elle constitue, dans certaines situations difficiles, une alternative intéressante aux procédés classiques d’intubation.
L’acquisition du geste ainsi que sa réalisation pratique nous semblent relativement simples. Cette facilité d’utilisation nous permet même d’en conseiller l’usage (à condition que l’indication en soit correctement posée) aux médecins ne pratiquant l’intubation que de manière occasionnelle."
– L’intubation pédiatrique
L’enfant a une anatomie et une configuration différente. On ne ventile pas et on intube pas un enfant (nouveau-né à nourisson) comme un adulte.
– Caractéristiques des voies aériennes pédiatriques
Les voies aériennes pédiatriques présentent de nombreuses différences par rapport à celles de l’adulte. Tout d’abord, à la naissance, le larynx est situé au niveau de la quatrième vertèbre cervicale, pour descendre progressivement au niveau de la sixième vertèbre cervicale à l’âge adulte. Par sa position haute, l’épiglotte repose directement contre le palais mou, ce qui fait que les nouveau-nés ont une respiration nasale obligatoire durant les trois à six premiers mois de vie. L’épiglotte a une base d’attache étroite sur le cartilage thyroïde avec une forme en oméga. De surcroît, les tissus mous, et plus précisément les replis ary-épiglottiques ainsi que la muqueuse des cartilages aryténoïdes, ont tendance à collaber lors de l’inspiration (figure 1). La membrane thyrohyoïdienne est courte, de sorte que l’os hyoïde recouvre en partie le cartilage thyroïde ; l’incisure thyroïdienne ne peut donc pas être utilisée comme repère anatomique lors d’une trachéotomie.
- Figure 1
Epiglotte de nourrisson.
L’épiglotte (e) est en forme d’oméga ; les replis ary-épiglottiques (r) sont courts et ont tendance à collaber.
Le cartilage cricoïde est le seul cartilage circonférentiel des VA. Il forme la sousglotte, l’endroit le plus étroit des VA pédiatriques. Son diamètre est de 5,5 mm chez un nouveau-né à terme, soit un diamètre muqueux de 4,5 mm. Selon la loi de Poiseuille, un rétrécissement d’un millimètre représente environ 70% de diminution du flux aérien. Tout rétrécissement à la naissance, même minime, est donc cliniquement significatif. D’autres caractéristiques anatomiques contribuent encore à la spécificité des problèmes pédiatriques : le cou court, la relative grosse tête, une longue luette, des parois thoraciques « pliables », et une dilatation gastrique avec du reflux. (extrait Evaluation des voies aériennes chez l’enfant Rev Med Suisse 2008 ;4:2089-2093)
Il ne faut pas basculer la tête en arrière, car la trachée, très molle, est écrasée par ce geste. Il ne faut pas charger l’épiglotte de principe, par soucis d’éviter un traumatisme possible et par pure élégance du geste.
— -
— -
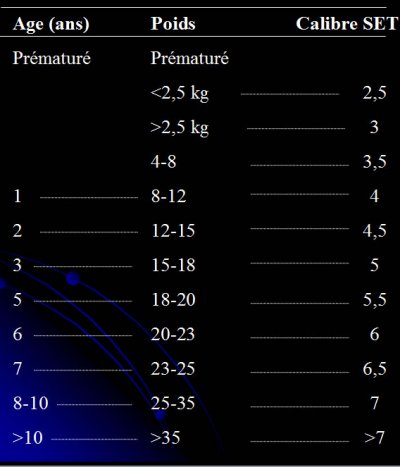
Quel diamètre choisir ?
Le numéro associé à une sonde intubation indique son diamètre interne, par contre le diamètre externe varie en fonction de la marque et du type de sonde.
Le diamètre externe est important chez enfant, la norme veut que ce chiffre soit mentionné sur les sondes de petite taille jusque taille 6
En fonction de l’âge, la formule de calcul varie en fonction de la présence d’un ballonnet
– Prématuré
- <2,5 kg => taille 2,5 sans ballonnet
- >2,5 kg => taille 3 sans ballonnet
– Puis pour les sondes sans ballonnet
- 4 à 8 Kg => taille 3,5 sans ballonnet (3 avec ballonnet)
- 8 à 12 kg => taille 4 sans ballonnet ( 3,5 avec ballonnet)
– Au-delà de 2 ans, choix du diamètre interne :
- Avec ballonnet D.I. mm. = (âge en années /4) + 3
- Sans ballonnet (D.I. mm.) = (âge en années /4) + 4
pour les sondes endotrachéales sans ballonnet, la formule retenue est
Diamètre = (age + 16) / 4
– Pour les sondes à ballonnet, on peut également appliquer la formule de Khine
Taille = (age /4) + 3
– Ou la formule de Cole : DI (mm)= âge/4 + 4 chez les enfants de plus de 2 ans
– Ou la formule de Khine modifiée : DI (mm)= âge/4 + 3,5
A lire
Si vous avez le temps...dure 49’51"
– Des articles en anglais sur le choix raisonné de la taille des sondes d’intubation.
Current Practices in Endotracheal Tube Size Selection for Adults
Austin C. Cao BA, Shruthi Rereddy MD, Natasha Mirza MD
First published : 29 October 2020
https://doi.org/10.1002/lary.29192
Citations : 2
Editor’s Note : This Manuscript was accepted for publication on October 9, 2020 The authors have no funding, financial relationships, or conflicts of interest to disclose.
Podium presentation at the American Bronchoesophagological Association (ABEA) Annual Meeting, as part of the Combined Otolaryngology Spring Meetings (COSM), presented in a virtual format on April 24, 2020.
Austin Cao, Dr. Shruthi Rereddy, and Dr. Natasha Mirza had full access to all the data in the study and take responsibility for the integrity of the data and the accuracy of the data analysis.Abstract
Objectives/Hypothesis
Intubation with inappropriately sized endotracheal tubes (ETT) can cause long-term tracheal and laryngeal injuries often requiring surgical intervention. Although tracheal size has been demonstrated to vary based on height and sex, it is unclear whether these guidelines are regularly implemented in patients undergoing endotracheal intubation. The objective of this study is to determine the rate of appropriate ETT size selection in patients undergoing intubation and assess provider decision making in ETT size selection.
Study DesignRetrospective cohort study.
Methods
The study population was all patients who underwent endotracheal intubation over a two-week period at a tertiary academic medical center. Data were collected on patient age, gender, height, BMI, comorbidities, ETT size, duration of intubation, bronchoscopies, and type of practitioner who performed the intubation. A height-based nomogram for ETT size selection was used to determine the recommended ETT size for each patient.
Results
One hundred five patients met the inclusion criteria. 22% of patients were intubated with an inappropriately large tube, defined as 1.0 mm larger than the recommended size. Women were more likely to be intubated with an inappropriately large ETT (OR = 13.58, P = .001), as were patients with height less than 160 cm (OR = 141, P = .001). Other factors related to disease severity, anticipation for bronchoscopy, and BMI were not risk factors for the use of inappropriately large ETT.
Conclusions
Although there is compelling evidence that height is a strong predictor of tracheal morphology and appropriate ETT size, height-based guidelines have yet to be universally adopted for ETT size selection. Laryngoscope, 131:1967–1971, 2021
Volume131, Issue9
September 2021
Pages 1967-1971
Recommended
- Effect of the size of a tracheal tube and the efficacy of the use of the laryngeal mask for fibrescope‐aided tracheal intubation
- K. Koga, T. Asai, I. P. Latto, R. S. Vaughan
- Anaesthesia
- Evaluation of a new recommendation for improved cuffed tracheal tube size selection in infants and small children
- B. Salgo, A. Schmitz, G. Henze, K. Stutz, A. Dullenkopf, S. Neff, A. C. Gerber, M. Weiss
- Acta Anaesthesiologica Scandinavica
- Size matters : choosing the right tracheal tube
- S. Farrow, C. Farrow, N. Soni
- Anaesthesia
- Tracheal tube size in adults undergoing elective surgery – a narrative review
- S. Karmali, P. Rose
- Anaesthesia
§§§
– Chariot d’intubation difficile
La présence d’un chariot regroupant le matériel en vue de faire face à une intubation difficile est recommandée à proximité de tout site d’anesthésie.
Son emplacement doit être connu de toute l’équipe.
Sa composition doit être établie en rapport avec le type de patients reçus dans la structure hospitalière (pédiatrie, adultes).
La vérification régulière du matériel est indispensable.
En complément
– le glidescope
– le matériel d’intubation
– comment intuber ?
– l’intubation pédiatrique
– protection des dents (tout bête, mais efficace)
– Un autre système, sans doute moins pratique par rapport à celui ci-dessus


A lire en complément
– Un article sur l’intubation avec beaucoup de liens
– La crise de la profession pourrait-elle être jugulée par ce biais ? Ne le souhaitons pas.
– Des vidéos sur les techniques récentes d’intubations
– Evaluation and Management of the Physiologically Difficult Airway : Consensus Recommendations From Society for Airway Management
La Society for Airway Management (SAM) a été fondée en 1995 en tant que forum interdisciplinaire pour les médecins et les non-médecins de 28 pays différents qui se spécialisent dans la gestion des voies respiratoires. L’un des objectifs de la SAM est de contribuer à l’avancement scientifique de la gestion des voies respiratoires grâce à la représentation de plusieurs spécialités ; ces recommandations visent à combler ce vide en créant des recommandations physiologiquement dirigées provenant d’un groupe multidisciplinaire de prestataires. Les membres du SAM comprennent des anesthésistes, des infirmières anesthésistes, des médecins urgentistes, des pneumologues, des spécialistes des soins intensifs, des chirurgiens, des ambulanciers paramédicaux, des ambulanciers, des thérapeutes respiratoires, des membres de l’industrie et d’autres personnes à travers le monde.
– La Difficult airway society (DAS) est une structure anglaise, dédiée à la gestion des voies aériennes et ses difficultés inhérentes. Elle produit des guidelines.
— -
Arnaud BASSEZ
IADE/enseignant CESU
Administrateur du site
Il n’y a aucun conflit d’intérêt sur le matériel présenté et les liens éventuels mis en ligne.
Quand des MAR de Bourgogne veulent la jouer fine
– Suite à cet article, des MAR de Bourgogne (sic) m’ont écrit.
« les anesthésistes de bourgogne utilisent un fibro sur un chariot d’urgence
or vous dites que ceci est inutilisable en urgence.
Pouvez vous me donner les références biblio
Cordialement
OD »
NDLR : On passera sur l’absence totale d’un simple bonjour ; même dans un mail, il parait que cela se pratique...
Voici ma réponse
« Bonjour
Il se trouve que ce sont les recommandations d’experts de votre société savante, qui a édicté son guide de bonne pratique.
Vous pourrez donc leur demander à leur tour leur bibliographie, car je ne doute pas que votre intérêt pour la question ne se limitera pas à la demander au seul IADE que je suis.
Je vous donne la liste complète de ces "experts" dont la présence en salle d’opération est très certainement envahissante. Ce qui leur donne le crédit, que je ne saurais avoir avec ma pratique et mon expérience professionnelle.
D. Boisson-Bertrand (Nancy), J.L. Bourgain (Villejuif), J. Camboulives (Marseille), V. Crinquette (Lille), A.M. Cros (Bordeaux), M. Dubreuil (Bordeaux), B. Eurin (Pans), J.P. Haberer (Paris), T. Pottecher (Strasbourg), D. Thorin (Lausanne), P. Ravussin (Lausanne), B. Riou (Paris)
Une simple mise en exercice des choses, permet aisément de se rendre compte que le fibroscope n’est pas idéal dans l’urgence.
Nous utilisons dans le CHU où j’exerce très modestement, le guide d’Eschmann en première intention de secours, après une impossibilité d’intubation.
Ceci me semble plus logique dans une situation d’urgence, où la perméabilité des voies aériennes est essentielle, et où l’installation d’un fibroscope requiert plus de temps.Mais pour connaître ceci, point n’est besoin d’être expert auprès de la SFAR.
Un peu d’expérience suffit.Je vous cite un court passage de cette recommandation.
Toutefois, cette technique connaît des limites en raison de 1’obscurcissement de l’objectif (sécrétion, sang), de la modification du tonus de l’oropharynx (anesthésie, curarisation) ou des repères anatomiques (œdème, traumatisme), ou de l’obstruction des voies aériennes. Cette technique n’est donc pas la meilleure dans les situations d’urgence ou après de multiples tentatives d’intubation chez un patient anesthésié
Je vous félicite par avance, de voir votre pratique intégrer à n’en pas douter les référentiels de la SFAR, car je gage que vous saurez aisément les convaincre de son innocuité, et ne manquerai pas de la publier en complément de mon article.
Bien cordialement
AB »
– NDLR : A ce jour, la SFAR n’a toujours pas intégré le fibroscope comme élément d’intubation en urgence... mais uniquement dans l’algorithme intubation avec ventilation efficace prévue.
Le MAR de Bourgogne est à consommer avec modération...
Il est à signaler que les recommandations sur l’intubation difficile ont été réactualisées en 2017.
Un article sur l’intubation difficile, est également disponible sur le site de la SFAR, pour les mar de Bourgogne ou d’ailleurs.
Un site à consulter (en langue anglaise) openairway.org
Les documents liés à l’intubation difficile
En complément. 87 documents
Le mécanisme ventilatoire
A lire pour bien comprendre.
Estomac plein et intubation
Grand classique de notre exercice, l’estomac plein s’entend pour plusieurs types de patients.
- Urgence médicale ou chirurgicale
- Occlusion
- Obèse (être obèse ne gêne pas la vidange gastrique, mais ce principe de précaution est souvent appliqué)
- Diabètique
- Gastroparésie
- Antécédents de by-pass ou de sleeve
- Prise d’opiacés
- Dénervation vagale
- Tétraplégie, maladie de Parkinson
- Travail obstétrical (la grossesse en dehors du travail n’altère pas la vidange gastrique)
- Ethylisme aigu
Lors de l’induction anesthésique, l’estomac plein concerne un patient ayant un volume gastrique résiduel supérieur à 0,4 ml/kg et un pH est inférieur à 2,5, ce qui constitue le préalable du syndrôme de Mendelson.
La sonde gastrique peut être une aide à la vidange si le bol alimentaire ne comporte pas d’aliments trop gros pour être aspirés dans la sonde. La vidange de l’estomac par un tube de Faucher n’est pas pratique courante au bloc.
Le fait de retirer une sonde gastrique en place, avant l’induction peut se discuter. Il arive parfois, que certaines difficultés d’insertion se fassent. Certes, le retrait de la sonde gastrique avant l’induction permet de redonner une compétence au sphincter inférieur de l’œsophage, mais on peut aussi aspirer en permanence, le temps de l’induction, jusqu’à intubation complète, ballonnet gonflé et ausculation des deux champs pulmonaires effectuée avec une objectivation de quatre cycles ventilatoires avec capnie ne s’effondrant pas, signal d’une bonne position de la sonde d’intubation.
Certaines équipes, notamment en obstétrique, utilise du citrate de sodium 0,3 molaire ou un mélange de cimétidine et citrate de sodium. Il doit ête bu environ 10 minutes au préalable.
L’erythromycine a été proposé. C’est un antibiotique macrolide. En dehors de son action antibiotique, elle a des propriétés prokinétiques qui permettent d’accélérer la vidange gastrique chez les patients présentant une gastroparésie.
On peut mettre le patient en proclive.
Une dénitrogénation efficace doit être entreprise systématiquement.
La manœuvre de Sellick se discute de plus en plus. Il y a les tenants de la manoeuvre, qui se pose en reflexe binaire, et d’autres qui la rejettent devant les complications possibles qu’elle pourrait entrainer.
Les drogues d’anesthésie restent là encore, un débat pas tranché, car chaque patient a des particularismes. Entre l’etomidate, le thiopental et le propofol, le choix peut être compliqué ou facile. La kétamine à doses anesthésique n’est en général pas utilisée pour l’induction en estomac plein.
Les morphiniques aussi sont sources de discussion. Leur délivrance peuvent favoriser les inhalations par leur effet émétisant et peuvent être une contre-indication en cas d’estomac plein, à cause du risque possible des vomissements et d’inhalation.
La succinylcholine reste le curare de référence. Le rocuronium à double de la dose soit 1.2 mg/kg est proposée. Il y a même des propositions à 2 mg/kg. le gantacurium pourrait être la solution dans un avenir proche.
– En lire plus sur le sujet
Anesthésie pour estomac plein (date un peu)
New Drug Developments for Neuromuscular Blockade and Reversal : Gantacurium, CW002, CW011, and Calabadion retrouvez cet article traduit, sur l’article sur les curares. Le calabadion étant quant à lui, la future star des antagonistes, car il fonctionne sur tous les curares avec une affinité in vitro sur le rocuronium 89 fois celle du sugammadex.
Etonnamment, la SFAR ne voit rien à redire sur la prise de chewing gum et de bonbon avant la prise en charge anesthésique... D’autres publications suggèrent le contraire. C’est étrange quand on sait que les chewing-gum et les bonbons favorisent l’hypersécrétion stomacale.

Critères d’extubation en 2011. Guide de bonnes pratiques
d’après une communication à la SFAR 2011.
L’extubation se fait de façon communément admise, lorsque le patient a recouvré un niveau de conscience suffisamment efficient, si les drogues d’anesthésie n’influent plus sur les voies aériennes si la fonction respiratoire est spontanée, si le bloc neuro musculaire a disparu, si le pouls est stable et si l’hypothermie est contrôlée.
– La conscience
L’extubation se fait sur un patient parfaitement réveillé, répondant aux ordres simples (ouvrez les yeux, serrez la main). Pour certains cas, on peut extuber le patient encore "endormi". Cela peut être le cas en pédiatrie, pour éviter parfois le spasme sur le tube, sur certaines éventrations pour éviter que le patient ne tousse sur la sonde d’intubation au grand dam du chirurgien, certaines chirurgies du globe oculaire, laryngée ou de l’oreille moyenne.
Il convient de s’entourer de professionnels aguerris si on ne possède pas la technique.
– La respiration
Patient en VS, avec un volume courant entre 5 et 8 ml/kg
une fréquence entre 12 et 25 /minute (exception faite de la néonatalogie), des pressions inspiratoires inférieures à 20 cm d’H20, une capnie régulière et dans les normes.
Le réflexe de toux n’est pas un critère à l’extubation.
– La décurarisation
L’extubation doit se faire une fois le bloc neuro musculaire complètement levé. Le contrôle à l’adducteur du pouce par le train de quatre (TOF) doit correspondre à un rapport de T4/T1>0,9.
Le DBS (double burst stimulation) n’est pas aussi fin que le TOF et gère plus une curarisation profonde que résiduelle.
Le head lift test n’est plus à considérer car il peut induire des réponses jugées positives alors que le T4/T1 est <0,7.
Le réflexe de déglutition doit être récupéré. Il signe le retour à la protection des voies aériennes.
– La saturation sur oxymètrie pulsée
Elle doit être > à 95 % avec une FiO2 < à 0,5 % et une pression expiratoire positive (PEP) < ou = à 5 cm H2O
ou être au moins équivalente à celle à l’entrée en salle d’intervention.
La PaO2 > ou = à 60 mmHg
La PaCo2 < ou = à 50 mmHg
– Cardiovasculaire
La PA et le pouls ne doivent pas varier de plus de 20 % de la valeur référente initiale.
– Les autres critères
- Une normothermie ou > à 36°C
- Une analgésie anticipée en per-opératoire
- Absence de complications chirurgicales immédiatement décelables (hémorragie, drain arraché...)
L’incidence des complications apparait de manière significative suivant l’extubation plutôt que l’induction, et sont de l’ordre d’obstruction des voies aériennes et de détresses respiratoires.
Le laryngospasme est le plus souvent mis en avant. C’est un réflexe de protection sous l’influence de la Xeme paire des nerfs crâniens (pneumogastrique), lors de présence de sang ou de salive ou de corps étranger. C’est une contraction complète ou pas des muscles laryngés entrainant une fermeture des cordes vocales, et évoluant vers une hypoxie, une ventilation impossible voire un arrêt cardiaque en l’absence de traitement.
Attention chez le petit enfant !
Se méfier également des fumeurs,des asthmatiques, ou des infections des voies respiratoires. (risque multiplié par 10)
idem pour la chirurgie pharyngée et buccale.
– Traitement du laryngospame.
- Suppression du stimulus irritant
- O2 fiO2 1 en pression positive si les cordes vocales ne sont pas fermées.
- Sinon propofol, 0, 25 à 1 mg/kg en première intention
- Si insuffisant ou inefficace, succinylcholine 0, 1 mg/kg
- Si la gêne est liée à un œdème, un traitement médicamenteux pourra être nécessaire.
- Si la gêne est un hématome compressif, il faudra consulter rapidement le chirurgien.
– L’extubation à risque le devient si
- L’intubation a été difficile
- Une pathologie préexistante (goitre, trachéomalacie)
- La chirurgie touche la région du cou
- Patient obèse, porteur d’une apnée obstructive du sommeil
- Mobilité du rachis limitée
- Utilisation d’une sonde de diamètre majorée entrainant un œdème de la glotte.
- Position déclive prolongée.
- Chirurgie de longue durée.
Conduite à tenir en cas d’extubation à risque
- Patient réveillé
- Décubitus dorsal ou proclive
- Ventilation spontanée
- Aspiration buccale et endo bronchique anticipée
- Contrôle et suppression des effets résiduels de la curarisation (T4/T1 >0,9)
- Laryngoscopie ou fibroscopie d’évaluation
- O2 fiO2 =1
- Dégonflage lent du ballonnet (limite ou annihile le réflexe de toux)
- Mise en place d’un guide d’Eschmann
- Trachéotomie par un chirurgien à envisager
- Extubation en fin d’inspiration en pression positive pour supprimer les atelectasies, notamment chez les enfants.
La FiO2 à 1 n’est pas recommandée en temps normal en phase d’extubation et donc de réveil. (voir l’article compil utile)
Une fiO2 à O,5 % n’entraine pas de désaturation chez les patients ASA 1 & 2
NDA : comme les certitudes médicales possèdent une demi-vie de 5 ans, il semble toutefois qu’il faille maintenant mettre en fio2% à 1 tous les patients lors de l’extubation (en dehors cependant des nouveaux-nés et des bpco pour qui l’oxygène pur est nocif). Les zones d’atélectasies créées par l’oxygène à 100% seront prises en compte par une extubation en pression positive permettant un recrutement alvéolaire. Car même à 0,8% c’est "priver" le patient des 20% restants au cas où ...
On peut malgré tout s’interroger sur cette assertion médicale entendue le 30 mai 2018, lors d’une réunion organisée par le laboratoire MSD sur le thème « Contrôle des voies aériennes en anesthésie : quoi de neuf en 2018 ? », animée par les Professeurs Benoît Plaud- Anesthésie- Hôpital St-Louis (Paris) et Olivier Langeron- Réanimation Chirurgicale Polyvalente- Hôpital La Pitié Salpêtrière (Paris), et le Docteur Jean-Louis Bourgain Anesthésie- Gustave Roussy (Villejuif). En effet, sur un patient ASA 1 à 2, quel est l’impact réel d’une fi02% à 0.8% par rapport à une fio2% à 1 ? Est-ce qu’un apport 4 fois supérieur à la fraction naturelle et physiologique ne suffit pas lors d’une phase de réveil post-chirurgical ? Même si le concept "qui peut le plus peut le moins" joue en faveur de la fio2% à 1, ceci est en contradiction avec les recommandations actuelles.
Quid par conséquent ?
Enfin, il n’est pas recommandé d’aspirer dans la sonde durant l’extubation, car cela majore les atelectasies déjà induites par l’O2 à 100 %, (réduisez à 80% maximum), et collabe les alvéoles..
Si vous devez le faire, aspirez pendant le sommeil, et reprenez une ventilation à la main afin de réexpandre les poumons. Vous pouvez aussi faire une procédure de recrutement par paliers ou en simple "coup" selon le respirateur dont vous disposez.
Pour ceux qui veulent en savoir plus sur la nocivité de la fio2 à 1 en phase de réveil, lire compil utile (les articles en relation sont en anglais).
Il existe beaucoup de lames de laryngoscope, qui n’apparaissent pas dans l’article ci-dessus. Pour la culture de chacun.
- Bainton
- Belchman
- Bellhouse
- Bizzarri-Giuffrida
- Bowen-Jackson
- Bryce-Smith
- Callander-Thomas
- Choi
- Dance
- DeCiutiis
- Diaz
- Flagg
- Freiburg
- Gabuya-Orkin
- Gould
- Grant
- Guedel
- Huffman
- Jackson-Wisconsin
- Kessel
- Larson
- Magill
- McCoy
- McWinnie
- Miller
- Nunn
- Onkst
- Orr
- Oxford
- Parrott
- Phillips
- Polio
- Pope
- Racz
- Racz-Allen
- Robertshaw
- Schapira
- Seward
- Siker
- Snow
- Soper
- Whitehead
Des lames comme s’il en pleuvait
— -
Le test ultime pour savoir si vous êtes bon...
§§§
NB : Une petite perle. Recherche google amenant sur cet article : « position en amande de Jackson ». (j’aime bien) AB

Intubation difficile : formation insuffisante
Au total, 508 réanimateurs ont répondu à courrier électronique anonyme de 40 questions concernant les intubations difficiles en réanimation. Les résultats montrent que plus de la moitié des réanimateurs (53 %) n’ont jamais essayé de cricothyroïdotomie sur mannequin et 63 % d’oxygénation transtrachéale. En situation d’urgence les techniques de préoxygénation sont incorrectes pour 35 % des réanimateurs. Finalement 4 réanimateurs sur 10 estiment que leur formation à l’intubation difficile est inexistante ou non adaptée et 9 sur 10 souhaiteraient à des simulations sur mannequin.
Un constat peu rassurant !
Dr Emmanuel Cuzin (JIM)
Références
Tuberlin A et coll. : Enquête nationale sur l’intubation difficile dans les services de réanimation français. 42e congrès international de la Société de réanimation de langue française (Paris) : 15-17 janvier 2014.
— -
Les IADE ont une expertise dans le geste de l’intubation. Au bout du compte ils intubent bien plus souvent que les médecins anesthésistes, les réanimateurs et les urgentistes (ces derniers devant intuber en un an, ce qu’un(e) IADE fait en une semaine (repos inclus).
A lire, cet article sur les secrets de l’intubation réussie.
Utilisation du masque laryngé dans l’adéno-amygdalectomie pédiatrique
Publié le 18/09/2011
L’objectif des auteurs était de comparer l’utilisation du masque laryngé et de la sonde d’intubation dans l’adéno-amygdalectomie pédiatrique. L’indication la plus commune de l’intervention était la survenue d’apnées du sommeil obstructives. L’asthme était la comorbidité la plus fréquemment associée.
Dans cette étude prospective randomisée, 131 enfants âgés de 2 à 12 ans (âge moyen 5,6 ans) ont été inclus. Les critères d’exclusion étaient un index de masse corporelle (IMC) supérieur à 35 et les anomalies crânio-faciales. Les enfants ont été répartis dans deux groupes de façon randomisée : intubation (71 enfants) et masque laryngé (60 enfants). Un protocole d’anesthésie standard était utilisé. Les auteurs ont en particulier évalué pour chaque groupe l’incidence du laryngospasme pré- et postopératoire, le temps opératoire, le temps d’anesthésie, le temps avant le réveil. L’un des principaux objectifs de l’anesthésiste durant l’intervention est la protection des voies aériennes. L’intubation endotrachéale est habituelle mais n’est pas dénuée de risques (traumatismes et oedèmes laryngés, blessures des lèvres, fractures dentaires, bronchospasme, laryngospasme dont l’incidence chez l’enfant est estimée entre 4 et 14 %). L’une des alternatives est l’utilisation du masque laryngé. Parmi les 60 enfants du groupe « masque laryngé », 12 ont finalement été intubés (bronchospasme à l’induction chez 2 d’entre eux ; flexion du tube et visualisation insuffisante en peropératoire pour les autres). Dans l’analyse statistique finale, on compte donc 83 enfants dans le groupe « intubés » et 48 dans le groupe « masque laryngé ».
Il n’a pas été observé de différence statistiquement significative entre les deux groupes concernant : âge, ethnie, IMC, grade ASA, incidence du laryngospasme postopératoire. Le temps chirurgical moyen était de 13,39 minutes chez les enfants avec masque laryngé contre 18,26 minutes chez les enfants intubés. Le temps nécessaire depuis la fin de l’intervention jusqu’à l’extubation était diminué de façon significative de 4,06 minutes dans le groupe « masque laryngé ». Le temps passé en salle de réveil était similaire dans les deux groupes
L’adéno-amygdalectomie pédiatrique est l’intervention présentant l’une des incidences les plus élevées de laryngospasme. Le masque laryngé représente une alternative en protégeant les voies aériennes tout en minimisant les stimuli cardiaques et respiratoires susceptibles de l’induire. Selon les auteurs, cela en fait un instrument idéal dans les procédures chirurgicales courtes chez l’enfant. Ils recommandent néanmoins des études incluant un plus grand nombre d’enfants prédisposés au laryngospasme et au bronchospasme (enfants asthmatiques ou présentant un reflux gastro-oesophagien). Chez ces enfants, le masque laryngé pourrait offrir un avantage supplémentaire en diminuant la stimulation réflexe de voies aériennes supérieures hyperréactives. Enfin, un problème commun lié à l’utilisation du masque laryngé est l’obstruction du tube. Elle serait due à une anesthésie trop peu profonde débouchant sur un laryngospasme. L’étiologie exacte reste à préciser afin de pouvoir la prévenir. Les auteurs indiquent que l’utilisation d’un masque laryngé plus petit était associée à une diminution des taux d’obstruction, en plus d’un champ opératoire plus accessible. L’adoption, en routine, du masque laryngé dans l’adéno-amygdalectomie pédiatrique nécessite des études complémentaires afin de déterminer les causes d’obstruction et de tenter d’en prévenir la survenue.
Dr Michel Ballester
– Références
Peng A et al. Use of laryngeal mask airway in pediatric adenotonsillectomy.
Arch Otolaryngol Head Neck Surg 2011 ; 137 : 42-6.
Copyright © Len medical, OPA pratique, juin 2011
Un meilleur pronostic pour les très grands prématurés intubés « du premier coup »
Publié le 04/04/2016
L’intubation trachéale peut être un geste salvateur à la naissance. Chez les très grands prématurés [TGP], elle est délicate et peut demander plusieurs tentatives pour réussir. Le nombre de tentatives d’intubation en salle de naissance semble avoir un impact sur le pronostic à moyen terme de ces enfants.
Une étude rétrospective a comparé le devenir de 35 TGP intubés dès la première tentative et de 53 TGP intubés après plus d’une tentative, qui pesaient moins de 1 kg et ont été suivis jusqu’à la fin de la 2e année de vie.
L’intubation trachéale avait eu lieu en salle de naissance, au cours des 5 premières minutes de vie ou jusqu’à 10 min de vie en cas de bradycardie < 100/min.
Les deux groupes de TGP avaient des termes et des poids de naissance moyens similaires (26 sem. et environ 760 g).
Le risque de séquelles et de décès réduit de 60 %
Les TGP intubés du premier coup ont eu plus rarement besoin d’un massage cardiaque externe et/ou d’adrénaline que ceux intubés après 2 tentatives ou plus. Ils ont eu tendance à faire moins souvent des hémorragies intra-ventriculaires sévères (grade 3 ou 4), des leucomalacies périventriculaires, des entérocolites ulcéro-nécrosantes (≥ stade 2 de Bell), et des pneumothorax. Toutefois, les différences entre les deux groupes n’étaient pas significatives.
Surtout, les TGP intubés du premier coup ont plus souvent survécu sans paralysie cérébrale, surdité, cécité, et déficit mental (QI <70) que ceux intubés après 2 tentatives ou plus. A 18-22 mois, le taux de décès ou de séquelles neurodéveloppementales lourdes était de 29 % chez les premiers versus 53 % chez les seconds. Avec une intubation du premier coup, le risque composite de décès et de séquelles était réduit de 60 % (Odds Ratio ajusté : 0,40 ; Intervalle de Confiance 95 % : 0,1-1,0 ; p < 0,05).
Parmi les TGP intubés du premier coup il y avait un excès de filles (p = 0,02), qu’on peut attribuer à une exposition plus facile du larynx par le laryngoscope.
Effet nocif des tentatives répétées responsables d’une hypoxie prolongée
L’étude est rétrospective et de petite taille, mais elle suggère fortement que le nombre de tentatives d’intubation en salle de naissance est un facteur de pronostic chez les TGP, indépendamment de leur sexe. L’effet nocif des tentatives répétées d’intubation s’explique par la prolongation de l’hypoxie et l’aggravation de l’hypertension intracrânienne qu’elles entraînent.
Ce que l’étude n’objective pas c’est le rôle crucial de l’expérience de l’opérateur dans la réanimation à la naissance des enfants de très petit poids. Les intubations trachéales de ces enfants doivent être décidées et effectuées par des médecins chevronnés. Les médecins en formation doivent s’exercer sur des mannequins ou des nouveau-nés plus stables.
Dr Jean-Marc Retbi
RÉFÉRENCE
Wallenstein MB et coll. : Failed endotracheal intubation and adverse outcomes among extremely low birth weight infants. J Perinatol., 2016 ; 36 : 112-115
Copyright © http://www.jim.fr
Le masque laryngé plutôt que la sonde d’intubation pour l’anesthésie des enfants de moins de 1 an
Publié le 27/01/2017
Depuis son introduction en 1983, les avantages apportés par le masque laryngé (ML) ne sont plus à démontrer : sécurité anesthésique accrue, gain de temps, moindre survenue de blessures “anesthésiques” qu’avec le tube endo-trachéal (TET). Néanmoins, malgré les efforts des constructeurs, les ML pour les enfants de moins de 1 an nécessitent trop souvent des manipulations afin de réduire les fuites aériennes, ainsi que la conversion en intubation endo-trachéale, poussant plusieurs équipes à travers le monde à préférer l’intubation en première intention au cours de l’anesthésie générale chez les tout-petits.
Les complications respiratoires péri-opératoires (CRPE) qui sont redoutables en anesthésie pédiatrique (15 %) et qui sont responsables d’un tiers des arrêts cardiaques, surviennent le plus souvent chez les enfants de moins d’un an (30 %). Or, chez l’enfant de plus de un an, le masque laryngé (ML) entraîne moins de CRPE que le tube endo-trachéal (TET). Mais qu’en est-il chez l’enfant de moins de 1 an ?
Fort logiquement, des auteurs australiens ont donc proposé de comparer la survenue de CRPE avec ces deux dispositifs chez les enfants de moins de 1 an sous anesthésie générale associée ou non à une anesthésie locale ou régionale, lors d’une étude prospective observationnelle contrôlée monocentrique, alors que les autres études antérieures sur le sujet n’étaient qu’observationnelles. L’induction reposait sur le sévoflurane ou le propofol et l’entretien sur le sévoflurane et le fentanyl : 1 μg/kg ou moins en cas de chirurgie réglée mineure. Ont été exclus ceux présentant des contre-indications à l’intubation ou au masque laryngé, une pathologie cardiaque, une malformation thoracique, ou bien recevant du midazolam en prémédication, (en raison d’une plus grande fréquence de survenue des CPRE après prémédication au midazolam, dans l’expérience personnelle des auteurs) et surtout ceux admis pour chirurgie dite majeure (des voies aériennes, thoracique ou abdominale). L’objectif principal était le dénombrement des CRPE avec l’une ou l’autre technique.
5 fois plus de bronchospasmes ou de laryngospasmes et 3 fois plus de complications respiratoires sous intubation
De juillet 2010 à mai 2015, parmi 239 enfants de moins de 1 an, 181 ont été jugés éligibles avec les interventions suivantes : réfection de hernie (36 [20 %]), cystoscopie (24 [13 %]), IRM et TDM (17 [9 %]), orchidopexie (12 [7 %]), hypospadias (11 [6 %]), et circoncision (9 [5 %]).
Dans l’analyse en intention de traiter, des CRPE sont survenues chez 53 % (50 %) des enfants sous TET (n = 95) et chez seulement 15 (18 %) de ceux sous ML (n = 85) (risque relatif [RR] 2,94, intervalle de confiance à 95 % [IC] 1,79–4,83, p<0,0001).
Et les auteurs de conclure que lors de chirurgies réglées mineures pour des enfants de moins de an, le ML est associé à 3 fois moins de complications respiratoires cliniquement significatives et à 5 fois moins de complications respiratoires majeures (laryngospasmes, bronchospasmes) que le tube endo-trachéal. Ce qui devrait conduire à un changement de paradigme...
So What To Do ?
Mais est-ce bien aussi simple s’interrogent dans un éditorial, deux autres anesthésistes américains, faisant remarquer que les laryngospasmes sont rares si l’enfant est extubé lorsqu’il est bien réveillé, c’est-à-dire avec des réflexes et une force pharyngée normaux, selon l’aphorisme qui dit qu’un tube pédiatrique n’est jamais laissé trop longtemps, mais qu’il est seulement retiré trop tôt ?
Or, dans cette étude, si les auteurs ont bien défini l’extubation de l’enfant encore endormi, ils n’ont pas défini l’extubation de l’enfant bien réveillé. De plus, ont été inclus dans la définition des CRPE, la toux et les désaturations oxymétriques (< 95 % pendant un temps par ailleurs non défini), mais sont-ce bien là des CRPE en l’absence de significativité clinique ?
Et de supputer sur une plus grande sécurité apportée dans l’avenir par des ML pédiatriques de nouvelle génération, tout en recommandant aux anesthésistes pédiatriques de se faire une idée par eux-mêmes et de confirmer ces données très favorables au masque laryngé par d’autres études multicentriques.
Dr Bernard-Alex Gaüzère
– Références
Drake-Brockman TF, Ramgolam A, Zhang G, Hall GL, von Ungern-Sternberg BS : The effect of endotracheal tubes versus laryngeal mask airways on perioperative respiratory adverse events in infants : a randomised controlled trial. Lancet. 2017 ; publication avancée en ligne le 17 janvier. doi : 10.1016/S0140-6736(16)31719-6.
Fladjoe J, Litman R : Laryngeal mask airways in anaesthetised infants : a paradigm shift ? Lancet. 2017 ; publication avancée en ligne le 17 janvier. doi.org/10.1016/S0140-6736(17)30120-4
source : jim.fr
— -
NDLR : Il est intéressant de lire ci-dessous, cet article de 2005, à la lumière de celui ci-dessus.
Les données médicales sont obsolètes au bout de 10 ans. Une étude de 2007, How quickly do systematic reviews go out of date ? A survival analysis. Shojania KG1, Sampson M, Ansari MT, Ji J, Doucette S, Moher D. a montré que la demi-vie de la connaissance médicale avant l’apparition d’un signal d’obsolescence est de 5,5 ans.
Au bout de 10 ans,tout ce que l’on a appris est faux. (AB)
Contre le masque laryngé en pédiatrie
Auteur : Pr Isabelle Murat
Service d’Anesthésie Réanimation
Hôpital d’enfants Armand Trousseau, 75571 Paris, France
E mail : isabelle.murat@trs.aphp.frLe masque laryngé (ML) est un dispositif permettant d’assurer la perméabilité des voies aériennes et la ventilation chez le patient anesthésié. Ce dispositif conçu par Archie Brain initialement pour la pratique adulte a été appliqué secondairement à la pratique pédiatrique. Le ML classique était à usage multiple. Plusieurs compagnies ont développé des ML à usage unique (MLuu) qui sont en cours d’évaluation en pédiatrie.
Le masque laryngé classique est condamné à disparaître.
A une époque où l’attention du public et des responsables de la santé est focalisée sur le risque d’infection nosocomiale, on peut considérer que le ML classique est condamné à disparaître. Celui-ci pouvait être restérilisé jusqu’à 40 fois selon les recommandations du fabricant. Or dans les conditions habituelles, le nettoyage des masques laryngés reste difficile et on peut détecter la présence de protéines résiduelles sur la majorité des ML nettoyés1-5. Le risque de transmission du variant de la maladie de Creutzfeldt-Jakob (vCJD) par le biais d’un contact prolongé d’un dispositif médical avec les structures amygdaliennes (zone à risque de transmission de type 2), a conduit à privilégier l’emploi de matériel à usage unique pour limiter ce risque signant de ce fait la fin de l’emploi du ML classique6 ;7. Ces recommandations font l’objet d’une circulaire ministérielle recommandant l’utilisation de l’usage unique pour le matériel en contact avec les tissus à risque (circulaire n°DGS/SC/DHOS/E2001/138 du 14/03/2001). Même si ce risque de transmission du vCJD reste à l’heure actuelle très théorique, la population pédiatrique est la population qui nécessite le plus de précaution compte tenu de la durée de l’espérance de cette population. Pour ces raisons, le ML classique restérilisable doit disparaître de l’équipement des blocs opératoires pédiatriques.
Le masque laryngé à usage unique est en cours d’évaluation. Les complications attendues sont celles du ML classique.
Bien conscient des limites du ML classique, les fabricants proposent actuellement des masques laryngés à usage unique qui sont en cours d’évaluation. Chez l’adulte et le grand enfant, ses propriétés paraissent identiques à celles du ML classique8-11. Partant de cette équivalence probable entre les dispositifs (ML classique et à usage unique), il reste à développer les arguments contre l’utilisation du ML.
L’incidence des complications respiratoires liées à l’utilisation du ML est élevée chez le jeune enfant si on compare son utilisation à celle d’un masque facial12 ou à une sonde d’intubation trachéale mise en place par des anesthésistes expérimentés13 ;14. En effet, dans une étude randomisée réalisée chez des nourrissons, Harnett et coll12 retrouvent une incidence de complications respiratoires égale à 55% avec un ML taille 1 ou 2 contre 23% lorsque la perméabilité des VAS était maintenue à l’aide d’un masque facial adapté. Parmi les complications observées, les auteurs mettent en garde contre l’apparition secondaire d’une obstruction des VAS lors de l’entretien de l’anesthésie. Les auteurs ne disposait pas à l’époque d’un ML taille 1,5. Ce dernier a été évalué chez 68 patients d’âge moyen 8,7 mois15. L’incidence des complications respiratoires dans cette étude était de 42%, similaire à celle rapportée dans l’étude précédente. Dans une large étude comportant 1400 patients, l’incidence globale des complications respiratoires en rapport avec le ML était de 11,5%, mais cette incidence était plus élevée chez les patients ayant bénéficié d’un ML taille 1 (22.4%), en chirurgie ORL et lorsque l’anesthésiste était inexpérimenté16. Plusieurs études ont montré que, lors d’un contrôle fibroscopique, les ML de petite taille (1, 1.5 et 2) étaient fréquemment mal positionnés permettant la vision de tout ou partie de l’épiglotte favorisant une obstruction secondaire des VAS17-19.
L’utilisation d’un ML chez les enfants ayant une infection des VAS fait l’objet d’une controverse. Dans une étude randomisée, Tait et coll. retrouvent une moindre incidence de complications respiratoires avec le ML par rapport à une sonde d’intubation (5% vs 25%)20. Une autre étude conclue également en faveur du ML21. Inversement, une étude prospective récente portant sur 1996 anesthésies pédiatriques retrouve 157 complications respiratoires périanesthésiques soit une incidence de 7,9%13. Cette incidence était plus faible lorsque les voies aériennes étaient maintenues perméables à l’aide d’un masque facial (4,7%) que lorsqu’un masque laryngé ou une sonde d’intubation trachéale (SIT) étaient utilisés (10,2% et 7,4% pour le ML et la SIT respectivement). Les complications les plus fréquentes avec le ML étaient le déplacement (25%) et autres complications mécaniques telles que les difficultés d’insertion (21%) ou de ventilation en pression positive (17%) alors que les laryngospasmes et les bronchospasmes étaient les complications les plus fréquentes lors de l’emploi d’une SIT. En analyse multivariée, trois facteurs significatifs de risque de complications respiratoires étaient retrouvés : l’âge < 6 ans (OR 1,84), l’utilisation d’un ML (OR 2,32) et l’existence d’une infection des voies aériennes (OR 3,72). Dans une étude personnelle portant sur un gros collectif de patients (plus de 24000 anesthésies), l’incidence des complications respiratoires chez les patients intubés était très faible et ceci peut être considéré comme représentant la pratique d’un hôpital pédiatrique spécialisé où le ML n’est utilisé que dans moins de 2% des interventions14. A côté des complications respiratoires souvent bénignes, le masque laryngé peut être responsable de complications plus graves. Parmi celles-ci on peut citer un cas de neuropraxie bilatérale des nerfs laryngés récurents22, une atteint bilatérale des nerfs hypoglosses23 et un œdème important de la langue après une chirurgie de longue durée (5h)24.
A côté des complications liées au positionnement des ML, il faut mentionner les complications liées à la ventilation mécanique sur un ML. Bien que cette technique soit couramment pratiquée, elle nécessite une surveillance rigoureuse tant du patient que des conditions chirurgicales25. En effet, le risque majeur est lié aux fuites potentielles et à l’insufflation gastrique progressive qui favorise la survenue d’un reflux gastro-oesophagien. Dans une étude récente réalisée chez 100 enfants âgés de 3 à 11 ans, il a été montré qu’une dilatation gastrique (détectée à l’aide d’un microphone placé sur la région épigastrique) survenait chez 10% des enfants lorsque le ML n ‘était pas idéalement placé, ce qui représentait 50% des ML insérés par des anesthésistes expérimentés26. Les auteurs concluaient qu’une grande vigilance était nécessaire chez les enfants ventilés à l’aide d’un ML. D’autres auteurs ont montré une incidence élevée de reflux gastro-oesophagien infraclinique mesuré à l’aide d’une sonde de pHmétrie chez les enfants en ventilation spontanée et encore plus lors de la ventilation contrôlée avec le ML (66% et 92% respectivement)27.
La mise sur le marché des ML à usage unique pose un autre problème, celui du coût de ces dispositifs. Leur prix est actuellement environ 10 fois supérieur à celui d’une sonde d’intubation trachéale à usage unique (1.08 Euros vs 12 Euros, prix AP-HP), ce qui doit amener les utilisateurs à faire des choix raisonnés.
Un bémol en guise de conclusion
Malgré les restrictions concernant son usage, la technique de pose du ML doit être enseignée, car la mise en place d’un ML fait partie intégrante des algorithmes de prise en charge des voies aériennes en cas d’intubation potentiellement difficile. Cette technique a fait les preuves de son efficacité chez les enfants ayant une score de Cormack et Leehane grade 3 ou 428 mais elle ne permet pas toujours un maintien adéquat de la perméabilité des VAS chez les enfants ayant un syndrome de Treacher Collins29. Par ailleurs le ML est une aide intéressante pour faciliter la réalisation d’une intubation fibroscopique chez l’enfant.
-References
1. Miller DM, Youkhana I, Karunaratne WU, Pearce A : Presence of protein deposits on ’cleaned’ re-usable anaesthetic equipment. Anaesthesia 2001 ; 56 : 1069-72
2. Brimacombe J, Stone T, Keller C : Supplementary cleaning does not remove protein deposits from re-usable laryngeal mask devices. Can.J.Anaesth. 2004 ; 51 : 254-7
3. Coetzee GJ : Proteinaceous material on routinely cleaned laryngeal mask airways. Anesth.Analg. 2004 ; 98 : 1817-8
4. Stone T, Brimacombe J, Keller C, Kelley D, Clery G : Residual protein contamination of ProSeal laryngeal mask airways after two washing protocols. Anaesth.Intensive Care 2004 ; 32 : 390-3
5. Tordoff SG, Scott S : Blood contamination of the laryngeal mask airways and laryngoscopes—what do we tell our patients ? Anaesthesia 2002 ; 57 : 505-6
6. Blunt MC, Burchett KR : Variant Creutzfeldt-Jakob disease and disposable anaesthetic equipment-balancing the risks. Br.J.Anaesth. 2003 ; 90 : 1-3
7. Walsh EM : Time to dispose of nondisposable LMAs. Anesth.Analg. 2005 ; 100 : 896-7
8. Al Shaikh B, Van Zundert AA : Randomized evaluation of the single-use softseal and the re-usable LMA classic laryngeal mask. Anaesth.Intensive Care 2004 ; 32 : 595
9. Glaisyer HR, Yule C : The Portex ’Soft Seal’ single use laryngeal mask — a preliminary study in pediatric anesthesia. Paediatr.Anaesth. 2005 ; 15 : 110-4
10. Orlikowski CE : An audit of the Single Use Portex Laryngeal Mask. Anaesth.Intensive Care 2004 ; 32 : 693-6
11. Paech MJ, Lain J, Garrett WR, Gillespie G, Stannard KJ, Doherty DA : Randomized evaluation of the single-use SoftSeal and the re-useable LMA Classic laryngeal mask. Anaesth.Intensive Care 2004 ; 32 : 66-72
12. Harnett M, Kinirons B, Heffernan A, Motherway C, Casey W : Airway complications in infants : comparison of laryngeal mask airway and the facemask-oral airway. Can.J Anaesth. 2003 ; 47 : 315-8
13. Bordet F, Allaouchiche B, Lansiaux F, Combet S, Pouyau A, Taylor P, Bonnard C, Chassard D : Risk factors for airway complications during general anaesthesia in paediatric patients. Paediatr Anaesth 2002 ; 12 : 762-9
14. Murat I, Constant I, Maud’huy H : Perioperative anaesthetic morbidity in children : a database of 24,165 anaesthetics over a 30-month period. Paediatr Anaesth 2004 ; 14 : 158-66
15. Bagshaw O : The size 1.5 laryngeal mask airway (LMA) in paediatric anaesthetic practice. Paediatr.Anaesth. 2002 ; 12 : 420-3
16. Lopez GM, Brimacombe J, Alvarez M : Safety and efficacy of the laryngeal mask airway. A prospective survey of 1400 children. Anaesthesia 1996 ; 51 : 969-72
17. Dubreuil M, Laffon M, Plaud B, Penon C, Ecoffey C : Complications and fiberoptic assessment of size 1 laryngeal mask airway. Anesth Analg 1993 ; 76 : 527-9
18. Park C, Bahk JH, Ahn WS, Do SH, Lee KH : The laryngeal mask airway in infants and children. Can.J.Anaesth. 2001 ; 48 : 413-7
19. Mizushima A, Wardall GJ, Simpson DL : The laryngeal mask airway in infants. Anaesthesia 1992 ; 47 : 849-51
20. Tait AR, Pandit UA, Voepel LT, Munro HM, Malviya S : Use of the laryngeal mask airway in children with upper respiratory tract infections : a comparison with endotracheal intubation. Anesth Analg 1998 ; 86 : 706-11
21. Parnis S, Barker D, Van der Walt J : Clinical predictors of anaesthetic complications in children with respiratory tract infections. Paediatr Anaesth 2001 ; 11 : 29-40
22. Sacks MD, Marsh D : Bilateral recurrent laryngeal nerve neuropraxia following laryngeal mask insertion : a rare cause of serious upper airway morbidity. Paediatr.Anaesth. 2000 ; 10 : 435-7
23. Sommer DD, Freeman JL : Bilateral vocal cord paralysis associated with diabetes mellitus : case reports. J.Otolaryngol. 1994 ; 23 : 169-71
24. Stillman PC : Lingual oedema associated with the prolonged use of an inappropriately large laryngeal mask airway (LMATM) in an infant. Paediatr.Anaesth. 2003 ; 13 : 637-9
25. Sidaras G, Hunter JM : Is it safe to artificially ventilate a paralysed patient through the laryngeal mask ? The jury is still out. Br.J.Anaesth. 2001 ; 86 : 749-53
26. Wahlen BM, Heinrichs W, Latorre F : Gastric insufflation pressure, air leakage and respiratory mechanics in the use of the laryngeal mask airway (LMA) in children. Paediatr Anaesth 2004 ; 14 : 313-7
27. Cebrian J, Avellanal M, Morales JL : Continuous monitoring of oesophageal pH during general anaesthesia with laryngeal mask airway in children. Paediatr.Anaesth. 2000 ; 10 : 161-6
28. Walker RW : The laryngeal mask airway in the difficult paediatric airway : an assessment of positioning and use in fibreoptic intubation. Paediatr.Anaesth. 2000 ; 10 : 53-8
29. Takita K, Kobayashi S, Kozu M, Morimoto Y, Kemmotsu O : Successes and failures with the laryngeal mask airway (LMA) in patients with Treacher Collins syndrome - a case series. Can.J.Anaesth. 2003 ; 50 : 969-70
— -
Vidéo-laryngoscopie aux urgences : pas plus d’intubations réussies qu’une laryngoscopie directe, mais plus de complications sévères….
15 février 2017
Source : Univadis par Nathalie Barrès
Dans les services d’urgence, l’intubation orotrachéale peut être associée à une augmentation du risque de complications car cette intervention doit parfois être réalisée en urgence par un opérateur non expert. Depuis quelques années des vidéo-laryngoscopes ont été développés pour faciliter l’intubation orotrachéale. La plupart des études réalisées pour évaluer l’intérêt de ces dispositifs ont été conduites dans le cadre de chirurgies programmées. Une équipe française vient de publier dans la revue JAMA les résultats d’une étude évaluant le bénéfice en service d’urgence de l’utilisation d’un vidéo-laryngoscope par rapport à l’utilisation d’un laryngoscope direct de type Macintosh, sur le taux de réussite d’intubation orotrachéale dès la première laryngoscopie.
- Méthodologie
L’étude MACMAN (McGrath Mac Vidolaryngoscope Versus Macintoch Laryngoscope for Orotracheal Intubation in the Critical Care Unit) est un essai ouvert, multicentrique, mené sur deux groupes parallèles randomisés et conduit dans 7 services de réanimation médicale en France entre mai 2015 et janvier 2016.
Tous les patients admis aux urgences et ayant besoin d’une intubation orotrachéale pouvaient être inclus s’ils ne présentaient pas l’un des critères d’exclusion suivants : contre-indications à l’intubation trachéale, patients pour lesquels l’urgence ne laissait pas de temps nécessaire à la randomisation lors de l’inclusion , sujets de moins de 18 ans, grossesse ou allaitement, sujets sous tutelle, sans régime de sécurité sociale, patient refusant de participer (lui-même ou l’un de ses proches), participation antérieure à un essais sur l’intubation.
Les patients ont été randomisés en deux groupes : Vidéo-laryngoscope Mc Grath ou laryngoscopie directe Macintosh.
Critère principal d’évaluation : proportion de patients intubés dès la première laryngoscopie.
Critères secondaires d’évaluation : proportion d’intubation orotrachéale réussie, durée totale de l’intubation orotrachéale réussie, score de visibilité glottique Cormack-Lehane, score de visibilité glottique POGO (Glottic Opening scale score), proportion d’intubation difficile, proportion de recours à des techniques alternatives d’intubation, fréquence de survenue de complications, durée de la ventilation, durée du séjour aux urgences, durée du séjour hospitalier.
Un opérateur expert était défini comme un médecin qui travaillait aux urgences depuis au moins 5 ans, ou travaillait aux urgences depuis au moins un an et avait reçu une formation d’anesthésiste durant au moins deux ans.
Tous les médecins travaillant aux urgences avaient reçu une formation pour utiliser le vidéo-laryngoscope et le laryngoscope conventionnel. Les intubations réalisées par des opérateurs non experts étaient toujours supervisées par un expert.
- Résultats
- Sur 489 patients intubés éligibles à l’étude, 371 ont été inclus. L’âge moyen des participants était de 62,8 ±15,8 ans, 36,7% étaient des femmes et 365 ont été inclus dans les analyses per protocole.
- Les caractéristiques des patients étaient similaires dans les deux groupes. La première tentative d’intubation orotrachéale a été réalisée par des non experts chez 83,8% des patients (sans différence statistique entre les deux groupes).
- Le taux d’intubation réussie dès la première laryngoscopie n’était pas statistiquement différent entre les deux groupes : 67,7% dans le groupe vidéo-laryngoscope et 70,3% dans le groupe laryngoscopie directe (différence absolue -2,5% [IC95% : -11,9% à 6,9%], p=0,60). L’analyse en per protocole n’a pas modifié la teneur de ces résultats.
- La fréquence de l’échec de l’intubation dès la première laryngoscopie n’était pas différente entre les deux groupes, même après ajustement sur l’expertise de l’opérateur.
- Le taux d’intubation réussie, quel que soit le nombre de laryngoscopie réalisée, n’était pas différent entre les deux groupes.
- Aucun recours à une autre technique d’intubation n’a été nécessaire.
- S’il n’y avait pas de différence de succès dès la première intubation en fonction de l’expertise de l’opérateur entre les deux groupes, un pourcentage plus important de première intubation réussie a été obtenu par des opérateurs experts 91,7% vs 64,6%, soit une différence absolue de 27,1% ([IC95% : 18,2%-35,8%], p=0,001).
- Le taux de complications majeures était plus élevé dans le groupe vidéo-laryngoscopie vs laryngoscopie directe (9,5% vs 2,8%), soit une différence absolue de 6,7% ([IC95% : 1,8%-11,6%], p=0,01), alors qu’il n’y avait pas de différence significative entre les deux groupes en ce qui concerne les complications modérées ou mineures.
- Limitations
- Un seul type de vidéo-laryngoscope a été évalué. Celui-ci présentait une lame courbe similaire au laryngoscope direct.
- La plupart des premières tentatives d’intubation ont été réalisées par des opérateurs non experts.
- Étude ne pouvant pas être réalisée en aveugle.
- Financements
Étude financée par le centre hospitalier départemental de la Vendée.
- À retenir
Chez les patients admis en service d’urgence et nécessitant une intubation, le vidéo-laryngoscope ne permet pas d’améliorer le taux de succès de l’intubation dès la première laryngoscopie par rapport à la laryngoscopie directe. Par ailleurs, la technique utilisant le vidéo-laryngoscope a été associée à un taux plus élevé de complications sévères. D’autres études sont nécessaires pour comparer l’efficacité de ces deux stratégies dans des situations cliniques différentes et avec des opérateurs ayant différents niveaux de compétences.
Références
Lascarrou JB et al. Video laryngoscopy vs direct laryngoscopy on successful first-pass orotracheal intubation among ICU patients. JAMA. Published online January 24, 2017. Doi:10.1001/jama.2016.20603.
L’EtCO2 pour confirmer l’intubation des grands prématurés en salle de naissance
Publié le 15 mai 2018
L’intubation trachéale est un geste essentiel de la réanimation en salle de naissance. Sa réussite est confirmée par l’accélération du rythme cardiaque et la détection du CO2expiré [EtCO2] (7e édition du National Resuscitation Program). Dans cette indication les détecteurs colorimétriques de CO2 expiré à usage unique, qui changent de couleur pour des valeurs-seuils d’EtCO2, sont en général préférés aux capnographes, qui affichent le tracé de la pression du CO2 durant le cycle respiratoire. Rendent-ils le même service qu’eux, notamment dans les intubations difficiles, nécessitant plusieurs essais et laissant planer un doute sur l’emplacement de la sonde (trachée ou œsophage ?).
Une étude récente a déterminé avec le capnographe d’un moniteur de fonction respiratoire (NM 3, de Philips) les temps que l’EtCO2 mettait à être détecté, puis à atteindre les valeurs de 4 et 15 mmHg chez des grands prématurés intubés. Les valeurs de 4 et 15 mmHg correspondent au début et à la fin du changement de couleur du papier réactif d’un détecteur colorimétrique de CO2 expiré (Pédicap, de Nellcor), ce qui a permis de préciser indirectement les temps de réponse de ce détecteur.
L’intubation trachéale de 64 prématurés de 23 à 34 sem. (médiane : 27 sem.) pesant de 485 à 2 370 g (médiane : 904 g), a été réussie entre 0 et 11 min de vie (médiane : 2 min.), au 1er essai (n = 46), au 2e essai (n = 11) ou au 3e essai (n = 7). Les capnogrammes du moniteur de fonction respiratoire ont été analysés rétrospectivement, de l’intubation à l’instillation de surfactant.
Après une intubation effective, l’EtCO2 était détecté par le capnographe en moins de 45 s. (médiane : 3,7 s.), un délai bien plus court que les temps de réponse aux seuils de 4 et 15 mmHg (p < 0,001).
Les capnographes détectent l’EtCO2 plus tôt que les appareils colorimétriques
Chez un bébé ré-intubé plusieurs fois et réanimé pendant 30 minutes, l’EtCO2 est toujours resté en dessous de 4 mmHg. Ce cas excepté, il a atteint 4 mmHg en 0 à 12 min (médiane : 5,3 s.) et 15 mmHg en 0 à 14 min. (médiane : 8,1 s.). Les temps de réponse ont été supérieurs à 30 s. au seuil de 4 mmHg chez 12 patients et à 50 s. au seuil de 15 mmHg chez 12 patients. Ces temps peuvent paraître très longs à un opérateur qui ne dispose que d’un détecteur colorimétrique et l’inciter à extuber et à ré-intuber inutilement des patients !
Il y avait une corrélation inverse entre les temps de détection de l’EtCO2 et l’âge gestationnel (r de Spearman = - 0,44 au seuil de 4 mmHg, et r = – 0,48 au seuil de 15 mmHg ; p < 0,001 pour les deux) ou le poids de naissance (r = - 0,35 au seuil de 4 mmHg et r = – 0,37 au seuil de 15 mmHg ; p < 0,01 pour les deux). En revanche, il n’y avait pas de corrélations significatives entre les temps de détection de l’EtCO2 et les scores d’Apgar à 1 et 5 min. de vie.
Dans 6 essais d’intubation, la détection de l’EtCO2 a permis d’affirmer que la sonde était bien dans la trachée, alors que l’opérateur pensait avoir échoué.
Ainsi, le temps que met l’EtCO2 à être détecté après une intubation trachéale réussie, et encore plus à atteindre 4 mmHg et 15 mmHg, est très variable chez les grands prématurés, ce qui souligne l’importance des critères cliniques d’intubation à côté de l’EtCO2 pour affirmer que la sonde est bien dans la trachée. Les capnographes détectent l’EtCO2 plus tôt que les appareils colorimétriques.
Dr Jean-Marc Retbi jim.fr
RÉFÉRENCE
Hunt KA et coll. : Detection of exhaled carbon dioxide following intubation during resuscitation at delivery. Arch Dis Child Fetal Neonatal Ed. 2018 ; publication avancée en ligne le 17 mars. Doi : 10.11366/archdischild-2017-313982
Essayer d’abord la « bougie » pour les intubations difficiles en urgence
Publié le 17/06/2018
Chaque année aux États-Unis, environ 300 000 intubations sont pratiquées dans les services d’Urgences avec environ 12 % « d’effets indésirables » et seulement 85 % de succès de la première tentative. En France, grâce au système de soins pré-hospitalier médicalisé, l’épidémiologie de l’intubation trachéale est assez bien connue : 8 % des interventions primaires des SMUR y conduisent, soit 40 000 à 50 000 intubations extra-hospitalières. La fréquence de l’intubation difficile en médecine d’urgence pré-hospitalière est bien plus élevée qu’au bloc opératoire, parce que le médecin n’a pas connaissance des antécédents d’intubation difficile et parce que le dépistage systématique d’une intubation difficile par la classification de Mallampati, la mesure de la distance thyromentale et l’examen de la mobilité cervicale sont peu rentables dans un service d’urgences traumatologiques, car applicables seulement à moins du tiers des patients intubés (1).
8 à 15 % des patients sont difficiles à intuber sous laryngoscopie directe
Dans les études menées dans des systèmes de soins paramédicalisés, notamment aux États-Unis, les pourcentages de succès d’intubations extra-hospitalières varient de 95 % à 50 % ! Pour faire simple, retenons que de 8 à 15 % des patients restent ainsi difficiles à intuber sous laryngoscopie directe et qu’environ 60 % des patients vus aux Urgences présentent des variations anatomiques qui rendent difficiles l’exposition correcte de leur larynx et le passage de la sonde. C’est dire l’importance pour la survie du patient de pouvoir être intubé lors de la première tentative et de pouvoir être correctement oxygéné pendant la procédure.
L’introducteur de la sonde d’intubation – décrit par Macintosh en 1949 - est un mandrin long béquillé (modèle pour adulte long de 60 cm, diamètre interne de 6 à 10 mm, marquage tous les 10 cm et angulation de 40°), plus connu sous le nom de bougie (même chez les Anglo-Saxons), est généralement utilisé pour faciliter l’intubation trachéale lorsque l’exposition sous laryngoscopie directe est médiocre ou après l’échec d’une tentative d’intubation. D’après les recommandations les plus récentes en matière d’intubation difficile (prévisible), la bougie n’est qu’une des techniques alternatives (ainsi que le masque laryngé de type FastrachTM) qui permettrait de résoudre (96 %), des cas d’intubation difficile juste avant de devoir recourir à la cricothyroïdotomie.
Mais pourquoi donc attendre l’échec de l’intubation conventionnelle avant de recourir à la bougie ? Qu’en serait-il du succès primaire de l’utilisation en première intention de la bougie dès la première tentative d’intubation versus la sonde d’intubation à grand-papa, s’est interrogée une équipe américaine ?
Déplaçons-nous dans le service d’urgence du Hennepin County Medical Center, un service universitaire urbain de Minneapolis (États-Unis), de septembre 2016 à août 2017. Lors d’un essai clinique randomisé, les patients âgés de 18 ans et plus ont été assignés au hasard soit dans le groupe première tentative d’intubation par bougie (n = 381), soit dans le groupe sonde endotrachéale (n = 376). Ont été exclus, les détenus, les femmes enceintes et les porteurs d’anomalies trachéales dont les tumeurs laryngées (qui constituent pourtant d’excellentes indications à la bougie). Tous ces patients étaient redevables d’une intubation orotrachéale en urgence avec lame de laryngoscope Macintosh pour un arrêt respiratoire, une détresse respiratoire ou bien pour protection des voies respiratoires.
Taux de succès de la première tentative d’intubation plus élevé avec la bougie
L’objectif principal était la mesure du taux de succès de la première tentative d’intubation chez les patients présentant au moins une caractéristique d’intubation difficile des voies respiratoires (fluides corporels masquant la vue laryngée, obstruction des voies respiratoires ou œdème, obésité, cou court, petite mandibule, macroglossie, traumatisme facial ou nécessité d’immobilisation de la colonne cervicale). Les objectifs secondaires étaient la mesure du taux de succès de la première tentative chez tous les patients, le succès de la première tentative d’intubation sans hypoxémie, la durée de la première tentative, l’intubation œsophagienne et l’hypoxémie. Fait important aux États-Unis, toutes les intubations de cette étude ont été réalisées par des médecins et non par des paramédics.
Parmi les 757 patients inclus (âge moyen 46 ans ; 30 % de femmes, tous ont complété l’essai. Parmi les 380 patients présentant au moins une caractéristique d’intubation difficile, le taux de succès de la première tentative d’intubation a été plus élevé dans le groupe bougie (96 %) que dans le groupe sonde endotrachéale (82 %) (différence absolue entre les groupes, 14 % [intervalle de confiance IC 95 %, 8 - 20 %]). Pour l’ensemble des patients, le taux de succès de la première tentative d’intubation dans le groupe bougie (98 %) s’est également avéré supérieur à celui du groupe sonde endotrachéale (87 %) (différence absolue, 11 % [IC 95 %, 7 - 14 %]). La durée médiane de la première tentative d’intubation (38 secondes vs 36 secondes) et l’incidence de l’hypoxémie (13 % vs 14 %) n’ont pas différé significativement entre les groupes bougie et sonde endotrachéale.
Candle in the Wind ?
Dans ce service d’urgence-là, l’utilisation d’une bougie par rapport à une sonde endotrachéale s’est traduite par un taux plus élevé de succès de la première tentative d’intubation chez les patients nécessitant une intubation endotrachéale en urgence, ce qui peut logiquement s’expliquer par le calibre plus petit de la bougie et la moindre gêne de la vision de l’opérateur qui en découle.
De quoi chambouler les recommandations actuellement en vigueur ? Modestes et d’une prudence ancestrale de Sioux, les auteurs préconisent à d’autres équipes et à d’autres services d’urgence de confirmer ou d’infirmer leurs résultats avec d’autres essais tout aussi prospectifs et randomisés que le leur. Quoi qu’il en soit, parions qu’aux États-Unis, compte tenu des moins bons résultats en matière d’intubation par les paramédics, la bougie éclairera rapidement l’intubation pré-hospitalière.
Dr Bernard-Alex Gaüzère
Références
- 1) Prise en charge d’une intubation difficile en pré-hospitalier. Réanimation (2010) 19, 627—632.
- 2) Driver BE, Prekker ME, Klein LR, Reardon RF, Miner JR, Fagerstrom ET, Cleghorn MR, McGill JW, Cole JB. Effect of Use of a Bougie vs Endotracheal Tube and Stylet on First-Attempt Intubation Success Among Patients With Difficult Airways Undergoing Emergency Intubation : A Randomized Clinical Trial. JAMA. 2018 ; 319 : 2179-2189. doi : 10.1001/jama.2018.6496.
- 3) Intubation difficile et extubation en anesthésie chez l’adulte 2017. Recommandations formalisées d’experts. Actualisation de recommandations. Société Française d’Anesthésie et de Réanimation
Copyright jim.fr
Un point sur la pratique actuelle de l’intubation trachéale chez les nouveau-nés
Publié le 18/02/2019
L’intubation trachéale [IT] est l’acte qui symbolisait la réanimation néonatale jusqu’à l’an 2000. Ce n’est plus le cas actuellement. L’abandon de l’aspiration trachéale systématique chez les nouveau-nés à terme qui naissent dans un liquide méconial et le développement de techniques d’assistance respiratoire non invasives chez les prématurés ont réduit notablement le nombre des IT en période néonatale.
Une enquête récente fait le point sur les indications, les procédures et les effets indésirables de cet acte en se basant sur 598 séances d’IT en salle de naissance [SN], et 2 009 séances d’IT en en unité de soins intensifs néonatale [USIN]. Ses données sont tirées d’un registre électronique alimenté, via Internet, par dix centres périnataux universitaires des USA (7), du Québec (1), d’Allemagne (1) et de Singapour (1).
La population intubée est composée en majorité de grands prématurés, l’âge gestationnel médian des bébés intubés étant de 30 sem. en SN et 28 sem. en USIN.
Les indications de l’IT comprennent l’hypoventilation, l’hypoxie, les apnées et bradycardies et/ ou l’instillation de surfactant… mais en SN elles sont dominées par l’impression clinique (61 %).
Le premier opérateur est rarement un résident (2 % en SN, 15 % en USIN). Une prémédication avec des sédatifs ± un curare est effectuée dans 64 % des IT en USIN. La technique la plus répandue est toujours la laryngoscopie directe, mais la vidéo-laryngoscopie est utilisée en premier dans 11 % des IT en SN et 21 % des IT en USIN. Par rapport à la voie orale, la voie nasale est peu empruntée (1 % en SN, 6 % en USIN).
Près d’une intubation sur deux est réussie dès le premier essai, quel que soit le site (46 % en SN, 49 % en USIN). Le taux de réussite après un et deux essais dépend du niveau d’expérience de l’opérateur (résident < fellow < assistant ; p < 0,001 pour un et 2 essais). Au total, ≥ 95 % des séances d’intubation sont couronnées de succès.
Former les internes et recourir à la vidéo-laryngoscopie
En SN, 31 % des IT sont marquées par des désaturations profondes (baisse de la SpO2 ≥ 20 %) et 17 % par au moins un autre évènement indésirable, qui est sévère dans 5 % des IT (intubation prolongée de l’œsophage, bradycardie extrême et arrêt cardiaque, laryngospasme, etc.). En USIN, le taux des désaturations profondes est plus élevé (49 % des IT), mais les taux d’évènements indésirables hors désaturations sont similaires (18 % des IT pour tous les évènements, 4 % des IT pour les évènements sévères). Toujours en USIN, la probabilité des évènements indésirables hors désaturations augmente avec une instabilité hémodynamique et la répétition des essais d’IT, et elle diminue avec l’utilisation de la vidéo-laryngoscopie (Odds Ratio ajusté [ORa] : 0,46 ; Intervalle de Confiance de 95 % [IC95 %] : 0,28-0,73) et d’un curare en prémédication (ORa : 0,38 ; IC95 % : 0,25-0,57).
Les désaturations profondes et les évènements indésirables au cours des IT varient beaucoup d’un centre à l’autre (de 29 % à 69 %, p = 0,001, et de 9 % à 50 %, p < 0,001, respectivement).
Cette enquête a plusieurs intérêts. Elle pose la question de la formation à l’intubation des internes (résidents) se destinant à la néonatologie. Elle permet à un centre de comparer sa pratique de l’IT à celle des autres centres. Elle suggère des pistes pour augmenter la réussite des IT dès le 1er essai et leur sécurité, surtout dans les USIN : prémédication avec un curare et vidéo-laryngoscopie.
Dr Jean-Marc Retbi
RÉFÉRENCE
Foglia EE et coll. Neonatal intubation practice and outcomes : an international registry study. Pediatrics 2019 ; 143(1) :e20180902
Source :jim.fr
Ventilation au masque durant l’intubation des patients en état critique ?
Publié le 01/03/2019
L’hypoxémie est la complication la plus courante lors de l’intubation trachéale de l’adulte en état critique et peut majorer le risque d’arrêt cardiaque et de décès. Il est un lieu commun de constater que les patients intubés en service de réanimation le sont avec moins de précautions que ceux intubés au bloc opératoire pour une chirurgie programmée après avoir bénéficié d’une consultation d’anesthésie bien au calme. Or les patients de réanimation sont bien moins stables, sans aucune réserve physiologique, et riche en mauvaises surprises de dernière minute, que l’intubation en séquence rapide ne peut toutes éviter…
Une question est de savoir si la ventilation par pression positive à l’aide d’un masque à poches pendant l’intubation trachéale préviendrait l’hypoxémie sans pour autant augmenter le risque d’inhalation. Question à laquelle s’est proposé de répondre un essai multicentrique randomisé mené dans sept unités de réanimation des États-Unis, en répartissant de façon aléatoire les adultes devant être intubés à recevoir soit une ventilation à l’aide d’un masque à poches, soit aucune ventilation entre induction et laryngoscopie. L’objectif principal était la mesure de la plus faible saturation en oxygène dans les 2 minutes qui séparent l’induction de l’intubation trachéale. L’objectif secondaire était la mesure de l’incidence de survenue d’une hypoxémie sévère, définie comme une saturation en oxygène inférieure à 80 %.
Deux fois moins d’épisodes d’hypoxémie grave sous ventilation au masque
Parmi les 401 patients recrutés, le taux médian de saturation en oxygène le plus bas a été de 96 % (intervalle interquartile de 87 à 99) dans le groupe ventilation par masque à poches et de 93 % (intervalle interquartile de 81 à 99) dans le groupe sans ventilation (p = 0,01). Au total, 21 patients (10,9 %) du groupe ventilation par masque à poche ont présenté une hypoxémie grave, comparativement à 45 patients (22,8 %) du groupe sans ventilation (risque relatif de 0,48 ; intervalle de confiance à 95 %, de 0,30 à 0,77). L’inhalation constatée par l’opérateur est survenue chez 2,5 % des patients du groupe ventilation par masque à poches, versus 4,0 % dans le groupe sans ventilation (p = 0,41). L’incidence d’apparition d’une nouvelle opacité sur la radiographie pulmonaire dans les 48 heures suivant l’intubation trachéale a été respectivement de 16,4 % et 14,8 %, (p = 0,73).
Retour vers le bon vieux temps ?
En dépit d’un défaut de standardisation des stratégies de pré-oxygénation (principale lacune de cette étude) chez les adultes en état critique subissant une intubation trachéale, ceux recevant une ventilation par masque à poche ont présenté des saturations en oxygène plus élevées (très faible différence toutefois), mais surtout une incidence d’hypoxémie grave deux fois plus faible que ceux ne recevant aucune ventilation. Les taux de survenue de décès et d’accidents graves ont été identiques dans les deux groupes, peut être en raison de l’effectif relativement réduit des patients étudiés, mais sans surcroît d’accidents d’inhalation.
Sous réserve de la sempiternelle rengaine « A confirmer par des essais portant sur une plus grand nombre de patients », voici de quoi nous amener à modifier nos pratiques quotidiennes de réanimation ou plutôt à revenir à ce qu’elles étaient... En effet, il y a quelques décades, l’intubation en service de réanimation se pratiquait comme au bloc opératoire, les médecins réanimateurs de cette lointaine époque étant avant tout des médecins anesthésistes !
Dr Bernard-Alex Gaüzère
Référence
Casey JD et coll. : Bag-Mask Ventilation during Tracheal Intubation of Critically Ill Adults. N Engl J Med. 2019 Feb 28 ; 380 (9) : 811-821.
source : jim.fr
Mieux vaut un anesthésiste pour intuber un enfant dans un hôpital général
Publié le 15/09/2019
source:jim.fr
Des nouveau-nés ou des enfants peuvent se retrouver en détresse vitale dans un hôpital général sans Unité de Soins Intensifs Néonatale ou Pédiatrique [USIN / USIP]. Habituellement, ils sont alors pris en charge par le pédiatre, quelquefois aidé par l’urgentiste, un anesthésiste ou un réanimateur. Si une Intubation Trachéale [IT] est indiquée par une obstruction par exemple laryngée ou pour une ventilation mécanique, qui, du pédiatre ou de l’anesthésiste, est le plus apte à réaliser cet acte ?
Dans une étude transversale, 52 pédiatres diplômés et 52 anesthésistes diplômés, travaillant dans des hôpitaux généraux des Pays-Bas, ont été interrogés sur l’IT pédiatrique, et ils ont simulé des IT par laryngoscopie directe sur les mannequins d’un nouveau-né et d’un enfant de 6 ans.
Les actes ont été filmés avec 2 caméras, l’une fixée sur la tête de l’opérateur, l’autre, avec un éclairage, fixée sur la lame du laryngoscope à la place de l’ampoule ; les vidéos ont été analysées par un néonatologiste, un réanimateur pédiatrique et un anesthésiste pédiatrique.
Durant l’année écoulée, près d’un pédiatre sur 2 et près d’un anesthésiste sur 2 avaient intubé au moins un nouveau-né (NS), aucun pédiatre n’avait intubé d’enfant alors que presque tous les anesthésistes avaient intubé au moins un enfant (p < 0,001), et que 75 % d’entre eux en avaient intubé plus de 10.
Les pédiatres sont globalement moins performants !
Dans les simulations d’IT les pédiatres ont été globalement moins performants que les anesthésistes. Sur le mannequin de nouveau-né leur taux de réussite (extrémité de la sonde trachéale au-delà des cordes vocales) a approché celui des anesthésistes (90 % versus 100 % ; p = 0,06), mais il leur a fallu plus de tentatives et de temps pour réussir (p < 0,001 pour les deux comparaisons), et ils ont eu plus de problèmes techniques, comme par ex. une lame enfoncée entre les cordes vocales (p < 0,001). Sur le mannequin d’enfant, leur taux de réussite a été nettement inférieur à celui des anesthésistes (58 % vs 96 % ; p < 0 001), et là aussi il leur a fallu plus de tentatives et de temps pour réussir (p < 0,001 pour les deux comparaisons) et ils ont eu plus de problèmes techniques (p < 0,001).
Les anesthésistes ont obtenu de meilleures notes finales (de 0 à 10) de la part des experts que les pédiatres pour les IT de nouveau-nés (médiane : 7,6 vs 5,8 ; p <0,001) ainsi que pour les IT d’enfants (médiane : 7,3 vs 3,5 ; p < 0,001).
Tous les anesthésistes ou presque ont été estimés aptes à intuber des nouveau-nés (100 %) et des enfants (94 %) vs 65 % et 15 % des pédiatres, respectivement (p < 0,001 pour les deux comparaisons). Le sentiment des intéressés diverge un peu de l’opinion des experts : concernant les IT néonatales, 29 % des pédiatres surestiment leur compétence alors que 33 % des anesthésistes la sous-estiment.
Les deux points discutables de l’étude, la fiabilité des données déclaratives et la relative facilité des IT simulées, ne modifient pas les résultats : dans les hôpitaux généraux dépourvus d’USIN / USIP, les anesthésistes sont les plus performants pour intuber les nouveau-nés et les enfants.
On peut en inférer que les IT qu’ils réalisent entraînent moins de complications.
Ces conclusions ne sont pas surprenantes. Pour avoir 90 % de chances de réussir une IT, il faut en avoir fait une cinquantaine et continuer à en faire régulièrement. C’est le cas des anesthésistes mais pas celui des pédiatres, qui ne sont pas systématiquement formés à l’IT pendant leur résidanat et ont rarement l’occasion d’intuber dans un hôpital général.
Pour les auteurs, dans les hôpitaux généraux, la responsabilité des IT urgentes de nouveau-nés ou d’enfants doit être confiée de préférence aux anesthésistes, et, si besoin est, les rôles respectifs du pédiatre et de l’anesthésiste doivent être clarifiés par un accord professionnel.
Le mérite de cette étude est d’étayer une opinion rarement formulée d’une façon aussi explicite.
Dr Jean-Marc Retbi
Référence
Van Sambeeck SJ et coll. : Endotracheal intubation skills of pediatricians versus anesthetists in neonates and children. Eur J Pediatr., 2019 ; 178 : 1219-1227
Difficile de prévoir les difficultés d’intubation trachéale dans les USIN !
Publié le 09/09/2019
En période néonatale les intubations trachéales [IT] difficiles peuvent provoquer des évènements indésirables plus ou moins graves, allant de l’intubation œsophagienne à l’arrêt cardiaque. De plus, chez les grands prématurés, elles augmentent les risques d’hémorragie intra-ventriculaire et de troubles neuro-développementaux à l’âge de 2 ans. L’étude NEAR4NEOS précise leur incidence, leurs effets immédiats et leur prédictibilité dans les Unités de Soins Intensifs Néonatales [USIN].
Les données de l’étude ont été enregistrées prospectivement mais leur analyse est rétrospective.
Quatorze pour cent des IT réalisées en 30 mois dans dix USIN, hors échanges standards de sonde (276/2 099), ont donné lieu à au moins 2 tentatives infructueuses sous laryngoscopie directe ou vidéo-laryngoscopie au cours de la même séance.
Ces IT « difficiles » concernent pour moitié des très grands prématurés (≤ 28 sem.) et elles ont été entreprises pour moitié entre 1 et 10 jours de vie.
Des nouveau-nés plus légers et moins matures…mais pas seulement
Par comparaison avec les IT « faciles » elles ont provoqué beaucoup plus d’effets indésirables (44 % versus 14 % ; p <0,001) et de désaturations profondes, définies par une baisse de plus de 20 points de la SpO2 (75 % vs 42 % ; p < 0,001). Un patient difficile à intuber a presque 5 fois plus de « chances » de présenter un évènement indésirable grave autre qu’une désaturation profonde (Odds Ratio : 4,9 ; Intervalle de Confiance de 95 % : 3,2-7,7), à savoir une intubation œsophagienne prolongée, une inhalation de vomi, une hypotension artérielle, un laryngospame, une hyperthermie maligne, un pneumothorax ou un arrêt cardiaque.
Les 276 nouveau-nés difficiles à intuber se singularisent sur plusieurs points :
– Ils sont plus légers et moins matures que les nouveau-nés qui ont été faciles à intuber, avec de plus grands pourcentages de poids < 1 500 g et termes < 32 sem. à l’intubation. Ils sont aussi plus souvent infectés (10 % de sepsis vs 6 %, p = 0,02).
– Deux indications d’intubation sont plus fréquentes chez eux : l’administration de surfactant (23 % vs 17 %, p = 0,02) et l’obstruction des voies aériennes supérieures (8 % vs 5 %, p = 0,03).
– L’opérateur est un néonatologiste plus ancien qu’un résident dans 55 % des cas, le plus souvent un fellow (49 % vs 27 % dans les IT faciles ; p < 0,001).
– La vidéo-laryngoscopie et une prémédication (sédation–analgésie et/ou curarisation) sont moins utilisées que dans les IT faciles. La différence est nette pour la curarisation (23 % vs 50 % ; p <0,001).
Choisir la personne qui va procéder à l’intubation
Pouvait-on prédire les difficultés d’IT de certains nouveau-nés en se fondant sur des critères utilisés chez l’adulte ? Un antécédent connu d’IT difficile, une obstruction des voies aériennes supérieures ou encore des particularités anatomiques et fonctionnelles (micrognathie, ouverture incomplète de la bouche, extension limitée du cou, brièveté de la distance thyro-mentale) sont significativement plus fréquents dans les IT difficiles que dans les IT faciles (p de 0,03 à < 0,001). Cependant, la sensibilité, la valeur prédictive positive et l’aire sous la courbe ROC de ces critères sont faibles.
Au total, il paraît difficile de prévoir avec précision quelles IT vont être difficiles chez les nouveau-nés hospitalisés dans une USIN, en particulier les très grands prématurés. Les auteurs pensent qu’il faut tenir compte tout à la fois de l’âge gestationnel et du poids actuels, de l’indication de l’intubation et des tests au chevet du patient pour choisir la personne qui va procéder à l’intubation. Il est démontré que la vidéo-laryngoscopie et une prémédication augmentent le taux de réussite d’une première tentative d’intubation.
Il serait intéressant d’avoir aussi des données sur les IT difficiles en salle de naissance.
Dr Jean-Marc Retbi
soource : jim.fr
Référence
Sawyer T et coll. : Incidence, impact and indicators of difficult intubations in the neonatal intensive care unit : a report from the National Emergency Airway Registry for Neonates. Arch Dis Child Fetal Neonatal Ed 2019 ; 104 : F461-F466.
Test de fuite avant extubation : ne vous dégonflez pas !
Publié le 02/09/2021
Procédure de base dans les unités de soins critique (USC), l’intubation endotrachéale peut être associée à de graves complications telles que l’œdème laryngé, source d’obstruction des voies aériennes supérieures après l’extubation. Selon une récente méta-analyse portant sur 4 493 patients dans 28 études d’observation, chez environ 9 % de tous les patients un œdème laryngé se développe post-extubation et 3 % des patients doivent être réintubés en raison de l’obstruction des voies aériennes supérieures. Or, la réintubation est associée à une morbidité et une mortalité significatives.
Il est impossible d’identifier les patients présentant un œdème laryngé avant l’extubation car la sonde endotrachéale empêche la visualisation directe des voies aériennes supérieures, d’où le recours au test de fuite du ballonnet de la sonde d’intubation ou cuff leak test (CLT) qui consiste à dégonfler le ballonnet de la sonde endotrachéale, et soit à ausculter pour détecter la présence d’air autour de la sonde, soit à mesurer quantitativement le volume de la fuite d’air. La présence d’une fuite d’air autour de la sonde suggère que les voies respiratoires sont perméables (c’est-à-dire que le CLT a réussi).
Cependant, une petite fuite d’air ou l’absence de fuite d’air (c’est-à-dire que le CLT a échoué) peut suggérer un œdème laryngé qui peut conduire à une obstruction des voies respiratoires post-extubation.
Toutefois, les preuves de la précision diagnostique de ce test sont limitées et les directives concernant son utilisation chez les patients qui ne présentent pas de facteurs de risque d’œdème laryngé sont contradictoires, avec le risque que le CLT prolonge inutilement la ventilation mécanique avec comme conséquences, une pneumonie acquise sous ventilation mécanique et un séjour prolongé en USC.
L’objectif principal de cette étude était de décrire les opinions, les attitudes et les pratiques des médecins intensivistes concernant l’utilisation du CLT.
Moins de tests de fuite par les anesthésistes de formation
Un questionnaire de 13 items a été testé par des pilotes et soumis à des tests de sensibilité clinique. Le questionnaire a été distribué électroniquement par MetaClinician®. Des statistiques descriptives et une analyse de régression multivariable ont été réalisées pour examiner les associations entre les données démographiques des participants et les réponses à l’enquête.
Au total 1 184 médecins « intensivistes » en exercice dans 17 pays d’Amérique du Nord et du Sud, d’Europe, d’Océanie et d’Asie ont participé à l’étude. La majorité (59 %) des répondants ont déclaré qu’ils ne pratiquaient que rarement ou jamais la CLT avant d’extuber les patients ne présentant pas de risque élevé d’œdème laryngé, ce qui est en corrélation avec le fait que 54 % des répondants ont déclaré qu’ils pensaient qu’une CLT ratée ne permettait pas de prévoir une réintubation. Les médecins réanimateurs du Moyen-Orient étaient 2,4 fois plus susceptibles de demander un CLT que ceux d’Amérique du Nord. Les intensivistes ayant une formation initiale en médecine ou en médecine d’urgence étaient plus susceptibles de demander une CLT avant l’extubation que ceux ayant une formation initiale en anesthésiologie.
Une forte variabilité des pratiques à travers le monde
Cette vaste enquête internationale, montre une forte variabilité dans la pratique du CLT avant l’extubation des patients considérés comme ne présentant pas un risque élevé d’œdème laryngé, selon le pays et la spécialité de base. Il est bien possible que ceux qui n’utilisent jamais le CLT passent à côté d’un test parfois utile qui peut réduire le risque d’échec de l’extubation. D’un autre côté, ceux qui utilisent régulièrement le test peuvent retarder l’extubation ou administrer des corticostéroïdes inutilement, sur la base de résultats peut-être trompeurs.
La plus grande limite de l’étude est qu’il est impossible de déterminer combien de personnes ont reçu le questionnaire, car celui-ci a été distribuée par le biais de listes de courriels et donc qu’il n’est pas possible de déterminer le taux de réponse, ce qui introduit un biais de sélection. Tous les pays ou régions n’étaient pas représentés, ce qui peut entraîner un biais d’échantillonnage. Enfin, comme cette enquête n’était pas axée sur les patients présentant un risque élevé d’œdème laryngé et que, de plus, il n’a pas été fourni aux personnes interrogées une définition de ce qu’est un « risque élevé », ces résultats doivent être considérés dans le contexte de la prise en charge des patients présentant une faible probabilité pré-test d’obstruction des voies aériennes en post-extubation.
Dr Bernard-Alex Gaüzère
Référence
Lewis K et coll. : The cuff leak test in critically ill patients : An international survey of intensivists. Acta Anaesthesiol Scand., 2021 ; 65 : 1087–1094. doi.org/10.1111/aas.13838
Source : jim.fr
Ventiler un nouveau-né de très petit poids via une sonde trachéale de 2 mm, ce n’est pas impossible !
Publié le 25/02/2022
En principe, les nouveau-nés de très petit poids de naissance sont intubés comme tous les enfants de moins de 2,5 kg avec une sonde trachéale [ST] de 2,5 mm de calibre intérieur. Une ST de plus petit calibre augmenterait trop les résistances au passage du gaz, ce qui gênerait la ventilation mécanique et favoriserait la formation de bouchons dans la sonde. Une étude de cohorte rétrospective rapporte une expérience d’utilisation de ST de 2,0 mm chez des nouveau-nés pesant moins de 750 g.
A l’Université de l’Iowa (USA) les prématurés sont pris en charge activement à partir de 22 semaines d’âge gestationnel, sauf avis contraire des parents à 22-23 sem. En-dessous d’un poids de 750 g ils peuvent être intubés avec une ST de 2,5 mm ou de 2,0 mm, au choix de l’opérateur. Ils reçoivent du surfactant et sont ventilés avec une technique peu répandue en néonatologie, la jet-ventilation à haute fréquence [JVHF]. Les aspirations trachéales sont effectuées avec un cathéter 5 Fr (1,6 mm).
Des enfants de moins de 750 gSur les 149 enfants de <750 g réanimés et admis dans l’Unité de soins intensifs néonatale de début 2012 à fin 2017, 147 ont été intubés. La première intubation a été faite avec une ST de 2,5 mm chez 78 enfants, une ST de 2,0 mm chez 69 enfants, 8 fois après l’essai d’une sonde de 2,5 mm. Elle a été réussie après une à trois tentatives dans 95 % des cas avec une ST de 2,5 mm et 93 % des cas avec une ST de 2 mm. Les ST de 2,0 mm ont été remplacées par des ST de 2,5 mm dans 55 % des cas (38/69), à un âge médian de 27 jours.
Les enfants intubés avec une ST de 2,0 mm sont plus immatures que ceux intubés avec une ST de 2,5 mm (âge gestationnel médian : 23 vs 24 sem. ; poids de naissance médian : 545 vs 648 g), mais ils ont un taux de survie à l’hospitalisation néonatale presque aussi élevé qu’eux (77 % vs 87 % ; p > 0,05).
Du fait de leur plus grande immaturité, ils ont été intubés plus fréquemment en salle de naissance (96 % vs 68 %). Ils ont été ventilés plus de temps (61 j vs 45 j) et extubés définitivement plus tard (69 j vs 50 j). Les différences entre les deux groupes d’enfants ne sont plus significatives après ajustement par l’âge gestationnel à la naissance.
Pas plus de problèmes de fonctionnement avec les ST de 2 mm
Malgré leur petit calibre les ST de 2,0 mm n’ont pas posé plus de problèmes de fonctionnement (bouchons, etc.) que les ST de 2,5 mm.
Aucune coudure n’a été signalée. Cependant, d’une façon inexpliquée, les extubations accidentelles ont été plus fréquentes.
La JVHF via une ST de 2,0 mm a procuré une ventilation et une oxygénation aussi efficaces que via une ST de 2,5 mm moyennant une pression maximum et une fréquence de ventilation un peu plus élevées pendant la première semaine de vie afin de vaincre les résistances générées par la sonde.
Un diagnostic de dysplasie broncho-pulmonaire a été posé chez 100 % des survivants au terme corrigé de 36 sem. L’incidence du grade 3 de cette affection, nécessitant la poursuite de la ventilation mécanique, est basse et identique dans les deux groupes d’enfants (12-13 %). Après ajustement par l’âge gestationnel à la naissance, il n’y a pas d’association significative entre la taille de la ST et les grades de l’affection.
En conclusion, des prématurés à la limite de la viabilité ont été ventilés efficacement via une ST de 2,0 mm de calibre. On ne connaît pas leur devenir au-delà de l’hospitalisation néonatale. Cependant, sous réserve qu’ils soient extrapolables à d’autres techniques de ventilation que la jet-ventilation, les résultats de cette étude impliquent la disponibilité de sondes trachéales de 2,0 mm dans les salles de naissance et les unités de soins intensifs néonatales.
Dr Jean-Marc Retbi
RÉFÉRENCE
Berger JN et coll. : Survival and short-term respiratory outcomes of <750> 2 % de la valeur de départ) ni bradycardie (définie par une FC < 100/min) vs 31,5 % (40/127) sans HDCN ni FiO2 > 21 %. La différence de risque ajustée est de 17,6 % (IC 95% : 6,0 à 29,2). Il faut traiter 6 nouveau-nés pour que l’un d’entre eux en tire bénéfice. Un âge gestationnel ≤ 28 sem., une prémédication n’ont pas d’influence ; en revanche, le gain semble plus important quand l’opérateurs a moins de 20 intubations à son actif.
La 1ère tentative d’IT n’a pas eu une durée significativement plus longue avec HDCN que sans HDCN (50,5 s et 46 s, respectivement, ce qui est supérieur au délai conseillé de 30 s). Par comparaison avec les IT sans HDCN, les hypoxies ont été moins fréquentes au cours des IT sous HDCN, et leur durée a été plus brève. A l’inverse, il n’y a pas eu plus d’hyperoxies (SaO2 > 97 %) sous HDCN.
En conclusion, la mise en place d’un HDCN au cours d’une IT par voie orale chez le nouveau-né augmente les chances de réussite de l’intubation dès la 1ère tentative, sans hypoxie ni bradycardie. Cependant, il est difficile de faire la part dans cet effet bénéfique de ce qui est attribuable à la PPC naso-pharyngée créée par le HDCN et à la supplémentation en oxygène, puisque les IT du groupe contrôle ont été effectuées en air.
Pour les IT par voie nasale, les plus pratiquées en France, une tubulure (« raccord de Beaufils ») entre la sonde trachéale et le circuit du respirateur en fonctionnement cyclique est un dispositif simple et efficace, adopté depuis plus d’un demi-siècle (2).
Dr Jean-Marc Retbi
Références
– 1. Hodgson KA et coll. : Nasal high-flow therapy during neonatal endotracheal intubation. N Engl J Med 2022 ; 386 : 1627-1637
– 2. Beaufils F : Intubation naso-trachéale sous oxygénation continue. Presse Med 1971 ; 79 : 1599-1600
Source : jim.fr
Le positionnement du patient représente 90 % de la bataille de la gestion des voies respiratoires. « Comment se passe votre combat ? »
12 septembre 2022 James M. Gayes, MD
Article original sur le site apsf.org
Sommaire :
L’algorithme ASA Difficult Airway 2022 passe en revue les avis d’experts et les nouveaux dispositifs d’intubation. Cependant, comme dans les lignes directrices de 2012, peu de choses sont mentionnées sur la valeur du positionnement tête/cou du patient dans la gestion des voies respiratoires difficiles. L’élévation de la tête/du cou/du haut du torse améliore la ventilation spontanée et contrôlée et les vues de la laryngoscopie, ce qui améliore l’entretien des voies respiratoires. Le positionnement pré-planifié du patient en conjonction avec un dispositif d’intubation peut améliorer la gestion des voies respiratoires et le succès de l’intubation.
Positionnement du patient anesthésique
Il y a dix ans, dans une lettre adressée au rédacteur en chef de la lettre d’information de l’American Society of Anesthesiologists, j’ai demandé pourquoi la position de la tête n’était pas mentionnée comme une stratégie pré-planifiée dans les directives 2012 de l’ASA sur les voies aériennes difficiles ?1,2 J’ai en outre noté que la pré- la connaissance de la position de la tête est essentielle et ne doit pas être considérée comme banale ou négligée dans l’ombre des nouveaux dispositifs d’intubation. En réponse, le comité de l’ASA sur les normes et les paramètres de pratique pour la gestion des voies respiratoires difficiles a répondu qu’il considérait mes commentaires comme précieux et importants et qu’ils seraient enregistrés par leurs analystes, et soigneusement examinés et pris en compte lors du prochain processus de mise à jour. Une avance rapide vers les lignes directrices de 2022, et ma question initiale concernant le manque d’importance et de valeur accordées au positionnement de la tête et du cou du patient restent pertinentes.3
Placer le patient chirurgical obèse en position de laryngoscopie surélevée (HELP) améliore la ventilation spontanée et contrôlée. Il favorise également l’alignement de l’axe des voies respiratoires, ce qui se traduit par de meilleures vues de laryngoscopie qui contribuent à l’intubation de premier passage.4-6 L’élévation du haut du corps augmente les dimensions des voies respiratoires supérieures en modifiant la direction de la gravité sur les tissus mous des voies respiratoires supérieures et diminue la poussée diaphragmatique vers le haut par l’adiposité abdominale en position couchée.5-7 L’élévation de la tête pendant l’intubation trachéale d’urgence réduit également l’incidence des complications liées aux voies respiratoires.4
Une récente mise à jour de 2022 de l’Anesthesia Patient Safety Foundation a mis l’accent sur la nature sensible au facteur temps de l’hypoxémie.8 La position tête surélevée permet d’obtenir des tensions d’oxygène nettement plus élevées, permettant une augmentation cliniquement significative de la durée de sécurité de la désaturation. Ce temps accru de tension d’oxygène plus élevée évite les effets délétères de l’hypoxie et offre une marge de sécurité lors de l’intubation. Le potentiel de gestion difficile des voies respiratoires n’est pas toujours évident et ne peut pas toujours être prédit à l’avance.9 Pour être préparé de manière optimale à la gestion des voies respiratoires, les appareils respiratoires doivent se trouver à proximité immédiate du clinicien étant donné que les difficultés des voies respiratoires doivent être gérées en quelques secondes avant des résultats indésirables ne se produisent. Un plan pré-pensé de positionnement du patient avant la laryngoscopie devient ainsi un « outil » immédiatement disponible pour le clinicien.
Les nouveaux dispositifs d’intubation ne modifient pas la position du patient. Toute position de la tête, du cou et de la partie supérieure du torse que le clinicien juge bénéfique pour la gestion des voies respiratoires doit être considérée comme synergique avec les dispositifs d’intubation, améliorant leur efficacité. Certains anesthésistes estiment que le fait d’avoir un vidéo-laryngoscope diminue l’utilité du pré positionnement du patient obèse. Il s’agit d’une idée fausse car un positionnement favorable facilitera toutes les méthodes de gestion des voies respiratoires (ventilation au masque, laryngoscopie directe, vidéo-laryngoscopie, masque laryngé, etc.). ne doit pas être considéré comme un scénario soit/ou. Les « outils » des voies respiratoires et le positionnement du patient fonctionnent conjointement pour favoriser une intubation de premier passage réussie.
Les directives 2022 mentionnent brièvement l’optimisation du positionnement dans une note de bas de page.3 La valeur de la position de la tête et du cou devrait être une norme reconnue dans la gestion des voies respiratoires difficiles et avoir la même importance que les dispositifs d’intubation. Même avec le meilleur équipement et la meilleure technologie, des stratégies simples, telles que l’optimisation du positionnement tête/cou, peuvent conduire à des résultats à haut rendement. Cela signifie utiliser tous les « outils » de notre « boîte à outils » pour maximiser la qualité et la sécurité des patients.
D’après mon expérience clinique, le positionnement du patient représente 90 % de la bataille pour fournir une approche pré-planifiée de la gestion des voies respiratoires. James M. Gayes, MD Département d’anesthésiologie Hôpital Abbott Northwestern Minneapolis, Minnesota James M. Gayes, MD est le fondateur d’OPAD Airway Inc., une start-up de dispositifs médicaux. Le Dr Gayes est co-inventeur des brevets couvrant un dispositif gonflable d’ajustement du patient et détient des actions dans l’entreprise mais ne reçoit aucune rémunération financière personnelle ou professionnelle. L’entreprise n’a pas de produit commercial.
– References
1. Gayes, JM : Proper Head Position : Let’s not forget who brought us to the dance. American Society of Anesthesiologists Newsletter. 77:11, 60-61, November 2013.
2. Updated by the Committee on Standards and Practice Parameters, Jeffrey L. Apfelbaum, Carin A. Hagberg, Robert A. Caplan, Casey D. Blitt, Richard T. Connis, David G. Nickinovich, Carin A. Hagberg, The previous update was developed by the American Society of Anesthesiologists Task Force on Difficult Airway Management, Robert A. Caplan, Jonathan L. Benumof, Frederic A. Berry, Casey D. Blitt, Robert H. Bode, Frederick W. Cheney, Richard T. Connis, Orin F. Guidry, David G. Nickinovich, Andranik Ovassapian ; Practice Guidelines for Management of the Difficult Airway : An Updated Report by the American Society of Anesthesiologists Task Force on Management of the Difficult Airway. Anesthesiology 2013 ; 118:251–270.
3. Jeffrey L. Apfelbaum, Carin A. Hagberg, Richard T. Connis, Basem B. Abdelmalak, Madhulika Agarkar, Richard P. Dutton, John E. Fiadjoe, Robert Greif, P. Allan Klock, David Mercier, Sheila N. Myatra, Ellen P. O’Sullivan, William H. Rosenblatt, Massimiliano Sorbello, Avery Tung ; 2022 American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology 2022.
4. Khandelwal N, Khorsand S, Mitchell SH, Joffe AM. Head-elevated patient positioning decreases complications of emergent tracheal intubation in the ward and intensive care unit. Anesth Analg. 2016 ;122(4):1101-7. PMID : 26866753.
5. Levitan RM, Mechem CC, Ochroch EA, Hollander, JE. Head elevated laryngoscopy position : improving laryngeal exposure during laryngoscopy by increasing head elevation. Ann Emerg Med. 2003 ; 41:322-30.
6. Brodsky JB, Lemmens HJ, Brock-Utne JG, Vierra M, Saidman LJ. Morbid obesity and tracheal intubation. Anesth Analg. 2002 ;94(3):732-6. PMID : 11867407.
7. Dixon BJ, Dixon JB, Carden JR, Burn AJ, Schachter LM, Playfair JM, Laurie CP. Preoxygenation is more effective in the 25 degrees head-up position than in the supine position in severely obese patients : a randomized controlled study. Anesthesiology 2005 ; 102:1110-5. PMID : 15915022.
8. Fiadjoe JE, Mercier D. Anesthesia Patient Safety Foundation update : 2022 American Society of Anesthesiologists practice guidelines for management of the difficult airway. APSF Newsletter. 2022 ; 37:47–53. 2022.
9. Nørskov AK. Preoperative airway assessment – experience gained from a multicenter cluster randomized trial and the Danish Anesthesia Database. Dan Med J. 2016 May ;63(5) : B5241. PMID : 27127020.
10. Kim EH, Lee JH, Song Effect of head position on laryngeal visualization with the McGrath MAC video laryngoscope in pediatric patients : A randomized controlled trial. Eur J Anaesthesiol 2016 Jul ;33(7):528-34. PMID : 26986776.
11. Pournajafian A, Pokhtabnk MA, Ghodrathy M. Success rate of airway devices insertion : laryngeal mask airway versus supraglottic gel device. Anesthesiology and Pain Medicine, 29 Mar 2015, 5(2) : Corpus ID : 9999503.
12. Ramachandran KS, Mathis MR, Tremper KK, Shanks AM, Kheterpal S. Predictors and Clinical Outcomes from Failed Laryngeal Mask Airway Unique™ : A Study of 15,795 PatientsPerioperative Medicine. June 2012 Volume 116, Issue 6, June 2012. Anesthesiology 2012 ; 116:1217–1226.
Vidéo vs Laryngoscopie directe pour l’intubation aux Urgences et en soins critiques : avantage à la vidéo-laryngoscopie
Publié le 14/08/2023
Chaque année aux États-Unis, plus de 1,5 million d’adultes en état critique nécessitent une intubation trachéale dans un cadre autre que celui d’un bloc opératoire. L’échec de l’intubation lors de la première tentative survient dans 20 à 30 % des cas aux urgences ou en unité de soins critiques (USC) et est associé à un risque accru de complications mettant en jeu le pronostic vital. Deux types de laryngoscopes sont couramment utilisés pour réaliser l’intubation trachéale : le « bon vieux » laryngoscope direct et le « fringant » vidéo-laryngoscope.
Ce dernier comprend les mêmes éléments que le laryngoscope direct, mais il est également équipé d’une caméra placée dans la moitié distale de la lame qui transmet les images à un écran. Avec l’aide de l’écran vidéo pour visualiser les cordes vocales (laryngoscopie indirecte), un clinicien peut guider une sonde endotrachéale à travers les cordes vocales sans ligne de visée directe depuis la bouche.
Bien qu’environ 80 % des intubations réalisées dans les services d’urgence et les USC du monde entier soient effectuées à l’aide d’un laryngoscope, l’utilisation des vidéo-laryngoscopes a augmenté au fil du temps. Plusieurs études monocentriques et une étude multicentrique de taille modérée ont été menées afin de comparer les résultats des deux techniques avec des résultats mitigés. De plus, il n’est pas certain que les résultats des études sur la vidéo-laryngoscopie au bloc opératoire s’appliquent aux Urgences et en USC.
Afin de déterminer l’effet de l’utilisation d’un vidéo-laryngoscope par rapport à un laryngoscope direct sur l’incidence d’une intubation trachéale réussie lors de la première tentative chez des adultes aux urgences et en USC, les auteurs ont mené l’essai Direct versus Video Laryngoscope (randomisé multicentrique mené dans 17 services d’Urgences et USC), en émettant l’hypothèse que l’utilisation d’un vidéo-laryngoscope entraînerait une incidence plus élevée d’intubations réussies lors de la première tentative.
Les adultes en état critique ont été répartis de façon aléatoire entre le groupe vidéo-laryngoscope et le groupe laryngoscopie directe. Le résultat principal était la réussite de l’intubation à la première tentative. Le résultat secondaire était la survenue de complications graves pendant l’intubation définies comme une hypoxémie sévère, une hypotension sévère, une utilisation nouvelle ou accrue de vasopresseurs, un arrêt cardiaque ou un décès.
Essai interrompu pour cause d’efficacité
Parmi les 1 417 patients inclus dans l’analyse finale (91,5 % d’entre eux ont subi une intubation effectuée par un résident en médecine d’urgence ou en USC), une intubation réussie à la première tentative a été obtenue chez 600 des 705 patients (85,1 %) du groupe vidéo-laryngoscopie et chez 504 des 712 patients (70,8 %) du groupe laryngoscopie directe (différence de risque absolu, 14,3 points de pourcentage ; IC à 95 %, 9,9 à 18,7 ; p < 0,001).
Au total, 151 patients (21,4 %) du groupe vidéo-laryngoscopie et 149 patients (20,9 %) du groupe laryngoscopie directe ont présenté une complication grave pendant l’intubation (différence de risque absolu, 0,5 point de pourcentage ; IC à 95 %, -3,9 à 4,9). Les résultats en matière de sécurité, y compris l’intubation œsophagienne, les lésions dentaires et l’aspiration, étaient similaires dans les deux groupes.
Parmi les adultes en état critiques soumis à une intubation trachéale dans un service d’Urgences ou en USC, l’utilisation du vidéo-laryngoscope a entraîné une incidence plus élevée d’intubation réussie lors de la première tentative que l’utilisation du laryngoscope traditionnel.
Des limites qui ne permettent pas de généraliser les conclusions
Comme les opérateurs ont choisi la marque du vidéo-laryngoscope et la forme de la lame, ces résultats ne peuvent pas être utilisés pour déterminer les caractéristiques techniques, qui permettraient d’obtenir les meilleurs résultats. De plus, cette étude ne permet pas de déterminer la meilleure technique d’intubation trachéale au bloc opératoire. Notons également que 97 % des opérateurs avaient effectué au préalable moins de 250 intubations trachéales, les résultats obtenus dans cette étude peuvent ne pas s’appliquer à des opérateurs plus expérimentés. Enfin, patients, cliniciens et personnel de l’essai étaient au courant de l’affectation des groupes à l’essai.
Dr Bernard-Alex Gaüzère
Référence
Prekker ME, et coll. DEVICE Investigators and the Pragmatic Critical Care Research Group. Video versus Direct Laryngoscopy for Tracheal Intubation of Critically Ill Adults. N Engl J Med. 2023 Aug 3 ;389(5):418-429. doi : 10.1056/NEJMoa2301601. PMID : 37326325.
Source jim.fr
Un désastre évitable en matière de gestion des voies respiratoires
Felipe Urdaneta, MD, FASA
APSF newsletter Volume 38, n° 3 • octobre 2023
Intubation œsophagienne
Il y a eu une croissance et des progrès considérables dans la gestion des voies respiratoires au cours des quatre dernières décennies, malgré une augmentation du nombre de groupes à haut risque tels que les patients de taille et de poids extrêmes, souffrant de traumatismes et d’apnées obstructives du sommeil, pour n’en nommer que quelques-uns. 1 L’introduction, le perfectionnement et l’adoption généralisée des directives de gestion des voies respiratoires, associées à des avancées technologiques telles que l’introduction et l’utilisation généralisée de nouvelles voies respiratoires supraglottiques, de laryngoscopes indirects (vidéo-laryngoscopes), les progrès des méthodes invasives d’urgence des voies respiratoires, les méthodes avancées d’oxygénation péri-intubation. des méthodes telles que la ventilation non invasive à pression positive et l’oxygénation nasale à haut débit ont révolutionné la façon dont nous abordons les voies respiratoires dans les contextes électifs et d’urgence. 2Les procédures de gestion des voies respiratoires sont nécessaires chez les patients de tous les groupes démographiques et sont effectuées par des prestataires de soins de santé ayant une expérience et une formation différentes. Même si les tendances semblent prometteuses, d’importants événements indésirables surviennent encore et nous ne devons pas baisser la garde.
Une récente ligne directrice consensuelle internationale met en lumière un ancien événement indésirable lié à la gestion des voies respiratoires. 3 Les membres du Projet pour la gestion universelle des voies respiratoires (PUMA) ont élaboré des lignes directrices de gestion pour prévenir l’intubation œsophagienne non reconnue ou non détectée. Ces nouvelles lignes directrices ont été approuvées par sept sociétés de gestion des voies respiratoires du monde entier. 3Certains lecteurs pourraient être surpris. De telles lignes directrices sont-elles nécessaires au 21ème siècle ? Il y a de fortes chances que chaque praticien ait été confronté, lors d’une laryngoscopie et d’une intubation, à un cas dans lequel la sonde endotrachéale (ETT) se retrouve accidentellement dans l’œsophage. Si cela se produit et que cela est immédiatement reconnu, les ETT égarés ne causeront que peu de dommages. Le vrai problème survient lorsque l’ETT est égaré, que la reconnaissance est retardée ou qu’il est complètement manqué. Cela peut entraîner des lésions cérébrales hypoxiques graves et irréversibles, voire la mort. 4-6
Le taux exact d’intubation œsophagienne non reconnue est inconnu. Des incidences allant jusqu’à 4 à 26 % de toutes les intubations ont été signalées dans des groupes à haut risque tels que les traumatismes, les états à faible débit et les nouveau-nés. 5,7,8 Même si on estime que davantage de cas surviennent en dehors de la salle d’opération et lorsque la procédure est réalisée par du personnel non anesthésiste, les professionnels de l’anesthésie ne sont pas à l’abri d’intubations œsophagiennes non reconnues. L’incidence de l’intubation œsophagienne non reconnue dans l’analyse des réclamations clôturées (ACC) de l’ASA dépend de l’époque signalée. Dans les années 1980, elle était responsable de 6 % de toutes les réclamations fermées pour faute professionnelle en anesthésie. 9Dans les années 1990, l’ASA exigeait que l’adéquation de la ventilation soit continuellement évaluée par la détection du dioxyde de carbone expiré, à moins qu’elle ne soit invalidée par la nature du patient, de la procédure ou de l’équipement. 4 En conséquence, l’incidence a chuté de façon spectaculaire et a conduit certains à considérer l’intubation œsophagienne non reconnue comme « virtuellement éteinte » ; lors de la dernière révision du CCA de 2019, aucun cas n’a été signalé. 10 Dans la base de données du National Audit Project IV (NAP4) de 2011, il y avait neuf cas d’intubation œsophagienne non reconnue ; il s’agissait du deuxième événement indésirable le plus courant entraînant le décès ou l’invalidité. 11En conséquence, la Difficult Airway Society et le Royal College of Anesthetists de Grande-Bretagne ont mené avec succès une campagne visant à rendre obligatoire la capnographie à chaque fois que des procédures respiratoires ont lieu. 12 Malheureusement, d’autres cas se sont produits par la suite, qui ne pouvaient être attribués à l’absence de détection du CO 2 expiré . 13 La publication de ces nouvelles lignes directrices, un éditorial qui les accompagne et plusieurs lettres à l’éditeur suggèrent que l’intubation œsophagienne non reconnue reste une préoccupation importante pour tous les professionnels de la santé impliqués dans la gestion des voies respiratoires et qu’elle est sous-estimée. 14-17
Comme le suggèrent ces nouvelles lignes directrices, nous devons suivre des protocoles stricts pour réduire complètement l’incidence de l’intubation œsophagienne. Utiliser la vidéolaryngoscopie comme appareil de premier choix semble prudent et étayé par la littérature. 16 Cependant, cela n’est actuellement pas universellement possible et reste un objectif ambitieux en raison du coût perçu et des ressources limitées, même dans les pays riches. Assurer le placement correct du tube trachéal après chaque intubation et une surveillance continue du CO 2 expiréchez les patients sous ventilation mécanique doit toujours être effectuée. Tous les cas d’intubation œsophagienne ne se produisent pas pendant l’intubation ; Les sondes endotrachéales pourraient être délogées des voies respiratoires. Ceci est particulièrement fréquent dans la population pédiatrique ou lorsque la tête ou le corps du patient bouge complètement, par exemple lors des manœuvres de réanimation. Un indice élevé de suspicion d’intubation œsophagienne doit être présent s’il est impossible de ventiler un patient avec un ventilateur mécanique. Cela devient évident après l’administration d’agents neuromusculaires. Il existe de nombreux rapports anecdotiques de patients avec des ETT mal placés qui peuvent respirer tant que leur fonction diaphragmatique est préservée ; une fois que cela cesse, après la relaxation musculaire, une profonde détérioration et désaturation se produira.
L’intubation œsophagienne peut se produire même entre les mains de professionnels de la santé expérimentés. Ce n’est pas seulement un problème pour les prestataires inexpérimentés ou moins qualifiés. Il n’est pas toujours possible de prévenir les intubations œsophagiennes. L’objectif devrait être d’établir des priorités et de travailler sur des mesures permettant de faciliter la détection de la mise en place d’une sonde trachéale. Ces nouvelles lignes directrices nous rappellent qu’il ne faut pas se montrer complaisants et passifs dans la promotion de mesures visant à réduire les préjudices indus aux patients.
En conclusion, ces lignes directrices récemment publiées sur la prévention de l’intubation œsophagienne non reconnue apportent une vision moderne d’un problème ancien, un événement indésirable de faible fréquence et à fort impact. Malgré les nombreuses avancées et réussites technologiques, il reste encore beaucoup à apprendre. Aucun patient ne devrait subir de préjudice suite à une intubation œsophagienne non reconnue, et nous devons tous respecter les principes fondamentaux pour réduire cet événement indésirable.
Felipe Urdaneta, MD, FASA, est professeur clinicien d’anesthésiologie à l’Université de Floride, Gainesville, FL.
Felipe Urdanata, MD, FASA, fait partie du conseil consultatif de Vyaire et consultant pour Medtronic. Il fait également partie du bureau des conférenciers de Vyaire et Medtronic.
LES RÉFÉRENCES
- Schroeder RA, Pollard R, Dhakal I et al. Tendances temporelles de l’intubation trachéale difficile et échouée dans une pratique d’anesthésie communautaire régionale. Anesthésiologie. 2018 ; 128 : 502-510. PMID : 29189209
- Apfelbaum JL, Hagberg CA, Connis RT et al. Lignes directrices de pratique 2022 de l’American Society of Anesthesiologists pour la prise en charge des voies respiratoires difficiles. Anesthésiologie. 2022 ; 136 : 31-81. PMID : 34762729
- Chrimes N, Higgs A, Hagberg CA et al. Prévenir l’intubation œsophagienne non reconnue : une ligne directrice consensuelle du Projet pour la gestion universelle des voies respiratoires et des sociétés internationales des voies respiratoires. Anesthésie. 2022 ;77 : 1395-1415. PMID : 35977431
- Honardar MR, Posner KL, Domino KB. Détection retardée de l’intubation œsophagienne dans les réclamations pour faute professionnelle en anesthésie : bref rapport d’une série de cas. Anesth Analg. 2017 ; 125 : 1948-1951. PMID : 28207593
- Rost F, Donaubauer B, Kirsten H et al. Mauvais placement du tube trachéal après intubation d’urgence chez des patients pédiatriques traumatisés : une étude rétrospective et exploratoire. Enfants . 2022 ;9:289. PMID : 35205009
- Wollner E, Nourian MM, Booth W et al. Impact de la capnographie sur la sécurité des patients dans les contextes à revenus élevés et faibles : un examen de la portée. Brit J Anaesth. 2020 ; 125 : e88–e103. PMID : 32416994
- Jemmett ME, Kendal KM, Fourre MW, Burton JH. Mauvais placement non reconnu de sondes endotrachéales dans un contexte de services médicaux d’urgence mixtes urbains et ruraux. Acad Emerg Med. 2003 ; 10 : 961-965. PMID : 12957980
- Timmermann A, Russo SG, Eich C et al. Les intubations œsophagiennes et endobronchiques hors hôpital réalisées par les médecins urgentistes. Anesth Analg . 2007 ;104 :619-623. PMID : 17312220
- Caplan RA, Posner KL, Ward RJ, Cheney FW. Événements respiratoires indésirables en anesthésie : une analyse des réclamations clôturées. Anesthésiologie. 1990 ; 72 : 828-833. PMID : 2339799
- Joffe AM, Aziz MF, Posner KL et al. Prise en charge de l’intubation trachéale difficile : une analyse des réclamations clôturées. Anesthésiologie. 2019 ; 131 : 818-829. PMID : 31584884
- Cook TM, Woodall N, Frerk C. Complications majeures de la gestion des voies respiratoires au Royaume-Uni : résultats du quatrième projet d’audit national du Royal College of Anesthetists et de la Difficult Airway Society. Partie 1 : anesthésie. F. J Anaesth . Mai 2011 ; 106 : 617-631. PMID : 21447488
- Russotto V, Cook TM. Utilisation de la capnographie en soins intensifs : pourquoi les cliniciens ne mettent-ils pas en œuvre cette mesure de sécurité ? F. J Anaesth. 2021 ; 127 : 661-664. PMID : 34503831
- CookTM, Harrop-Griffiths AW, Whitaker DK et al. La campagne « Pas de trace = mauvais endroit ». Brit J Anaesth. 2019 ; 122 : e68-e69. PMID : 30857613
- Baker PA, O’Sullivan EP, Aziz MF. Intubation œsophagienne méconnue : il est temps d’agir. Brit J Anaesth. 2022 ; 129 : 836-840. PMID : 36192220
- Jooste R, Roberts F, Mndolo S et al. Global Capnography Project (GCAP) : mise en œuvre de la capnographie au Malawi – un projet international d’amélioration de la qualité de l’anesthésie. Anesthésie . 2019 ; 74 : 158-166. PMID : 30255496
- Rogers AM, Hansel J, Cook TM. Vidéolaryngoscopie, intubation œsophagienne et incertitude : leçons de Cochrane. Anesthésie. 2022 ;77 : 1448-1450. PMID : 35897123
- Sakles JC, Ross C, Kovacs G. Prévenir l’intubation œsophagienne non reconnue aux urgences. J Am Coll Emerg Médecins Ouverts . 2023 ;4:e12951. PMID : 37128296
DEVICE : vidéolaryngoscopie vs laryngoscopie directe
L’essai DEVICE est sorti dans le New England Journal of Medicine le 3 août 2023. C’est un essai qui compare la vidéolaryngoscopie à la laryngoscopie directe sur des patients intubés aux urgences ou en soins intensifs. Au bout de 1420 inclusions de patients, l’essai a été arrêté en raison d’un avantage certain de la vidéolaryngoscopie avec une réussite au premier passage qui présentait une différence absolue de 14,3 %.
La réussite au premier passage va au bénéfice de la vidéolaryngoscopie. Le hic, est que les urgentistes intubent peu dans une année. S’ils n’apprennent qu’avec ce matériel, le jour où celui-ci sera cassé (écran fragile), le retour au MacIntosh risque d’être compliqué. Il en va de même pour les veines, KTC ou pose d’artère radiale sous écho. Les internes ne savent pas ventiler à la main, ni piquer, intuber correctement sans toutes ces aides. Alors on peut comprendre que le McGRATH™ et similaires puissent apporter un réel confort et aide à l’intubation, mais il apparaît souhaitable d’être à l’aise sans ce matériel alternatif, afin d’être vraiment opérationnel en permanence, sans craindre une éventuelle panne d’un "device" pour éviter que le patient ne dévisse...
AB
Vidéo-laryngoscope : vers une utilisation toujours plus large ?
Desforges Paul | 28 Mars 2024
jim.fr
Le risque d’inhalation, complication redoutée à toutes les phases de l’anesthésie, augmente avec la répétition des tentatives d’intubation. La vidéo-laryngoscopie est performante pour un succès à la 1ère tentative lors de l’induction en séquence rapide.
L’avènement des vidéo-laryngoscopes à la fin des années 2010 a considérablement modifié les algorithmes d’accès aux voies aériennes supérieures. Cet outil est désormais recommandé par les sociétés savantes dans la prise en charge des intubations en cas de facteurs prédictifs d’intubation difficile (1). Afin de réduire le risque d’inhalation du contenu gastrique lors de l’intubation, de nombreuses équipes s’intéressent à leur utilisation en première intention dans les situations les plus à risque. En réanimation, une étude publiée en 2023 a démontré le bénéfice de l’utilisation de ce dispositif sur le nombre de succès à la première tentative d’intubation (2).
Un essai randomisé auprès de 1 000 patients
Les auteurs d’une étude publiée en février 2024 dans le journal Anesthesia se sont intéressés à la place du vidéo-laryngoscope (Macgraph®) lors d’une induction en séquence rapide au bloc opératoire (3). En concordance avec l’ensemble des études publiées sur la gestion des voies aériennes supérieures, le critère de jugement principal était le succès de l’intubation à la première tentative. Cette réussite était définie par l’insertion unique d’une lame de laryngoscopie/vidéo-laryngoscopie en durée de procédure inférieure à 120 secondes avec un contrôle par courbe de capnographie.
Les critères de jugements secondaires analysés dans cette étude étaient la durée d’obtention d’une visualisation glottique, la durée du placement de la sonde d’intubation, le nombre de tentatives, les scores de difficulté d’intubation (grades de Cormack et Lehane et score POGO [Percentage Of Glottic Opening]), l’expérience des opérateurs et l’incidence des complications.
Pour mener à bien cette étude, les auteurs ont réalisé un essai contrôlé randomisé multicentrique dans 4 hôpitaux allemands. Les patients étaient inclus s’ils devaient subir une chirurgie programmée ou urgente et s’ils présentaient des critères imposant une induction en séquence rapide. A noter que les patients présentant des critères d’intubation difficile prévisible n’étaient pas inclus. Les participants ont été randomisés en un groupe intubation avec vidéo-laryngoscope (n = 534) et un groupe intubation avec matériel standard (n = 513).
Avantage au vidéo-laryngoscope
Les résultats de cette étude retrouvent une nette supériorité en faveur de l’utilisation du vidéo-laryngoscope avec un taux de succès à la première tentative de 94 % versus 71,6 % dans le groupe laryngoscopie standard (odds ratio 1,31 ; IC à 95 % 1,23-1,39 ; p < 0,001).
Les résultats concernant les critères de jugements secondaires retrouvent une différence statistiquement significative en faveur du vidéo-laryngoscope avec des durées de visualisation glottique (10 versus 14 secondes), de placement de la sonde (20 versus 27 secondes) et d’instauration de la ventilation mécanique (37 versus 42 secondes) plus courtes, une meilleure visualisation glottique, moins de complications immédiates à type de désaturation, traumatisme dentaire ou lésion des tissus mous (3 % dans le groupe vidéo-laryngoscopie versus 12 % dans le groupe standard, p < 0,001) et moins de complications retardées comme la toux et l’enrouement (12 % versus 27 % dans le groupe standard, p < 0,001).
Autre résultat intéressant, l’utilisation du vidéo-laryngoscope semble profiter à tous (expérimentés ou non) et plus particulièrement aux moins expérimentés. Il est important de noter que l’utilisation du vidéo-laryngoscope dans cette étude était systématiquement associée à un mandrin rigide disposé à l’intérieur de la sonde d’intubation. Ce point nécessite une attention particulière car dans la pratique clinique quotidienne, le recours au mandrin rigide est rare.
Les résultats de cette étude au bloc opératoire corroborent ceux retrouvés dans les services de soins intensifs. Le vidéo-laryngoscope est un outil indispensable dans l’arsenal des médecins anesthésistes-réanimateurs et son utilisation doit probablement être discutée en première intention en cas d’induction en séquence rapide.
References
Langeron O, Bourgain J-L, Francon D, et al. Intubation difficile et extubation en anesthésie chez l’adulte. Anesthésie & Réanimation 2017 ;3:552–71. https://doi.org/10.1016/j.anrea.2017.09.003.
Prekker ME, Driver BE, Trent SA, et al. Video versus Direct Laryngoscopy for Tracheal Intubation of Critically Ill Adults. N Engl J Med 2023 ;389:418–29. https://doi.org/10.1056/NEJMoa2301601.
Kriege M, Lang P, Lang C, et al. A comparison of the McGrath videolaryngoscope with direct laryngoscopy for rapid sequence intubation in the operating theatre : a multicentre randomised controlled trial. Anaesthesia. 2024 Feb 12. doi : 10.1111/anae.16250.
On peut toujours se poser la question de l’utilisation du Mc Grath (et pas Graph)... de première intention, voire en permanence comme aux USA. Couplé à un mandrin rigide en l’occurrence ici, voire régulièrement avec le secours d’un Eschmann (et pas Eichman comme je vois souvent chez les MAR ou les IADE, le criminel de guerre n’a rien à voir là dedans). Je me pose toujours la question des internes qui déjà ne savent pas ventiler, puisqu’à l’induction ils mettent le respirateur en mode VC ou VCAF quand ils ont un peu regardé l’avantage de ce mode, mais aucunement ils ne ventilent à la main, sur valve APL et donc ne savent pas "sentir" le patient s’assouplir, se curariser, sans avoir un oeil sur le tof et sur la capnie. Alors si le Mc Grath est tombé, écran cassé, batterie à plat, il va falloir revenir aux fondamentaux. Et c’est là où il y aura des difficultés.
AB