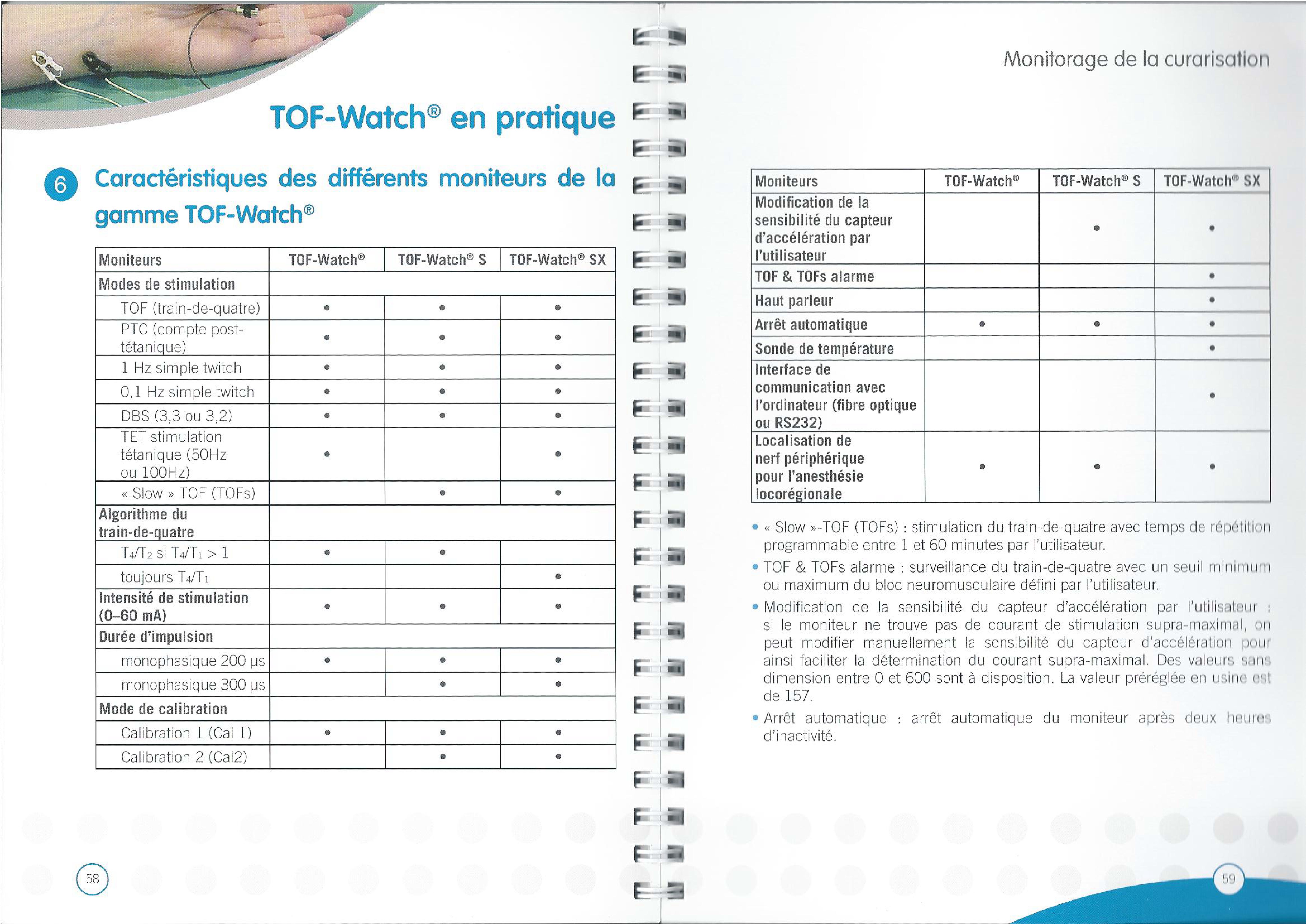
Aucun conflit d’intérêt dans la présentation des dispositifs
Un article de 1942 par Griffith HR, Johnson GE. The use of curare in general anesthesia. Anesthesiology. 1942 ;3:418–420. doi : 10.1097/00000542-194207000-00006. a déclenché l’utilisation de routine des curares.
Cliquez sur l’image pour l’agrandir
— -
— -
— -
— -
LA BONNE GESTION DES CURARES ET DES MOYENS DE SURVEILLANCE.
Article actualisé 25 juin 2022

La celocurine augmente de 0,5 à 1mEq/litre de bicarbonates
L’esméron® à 1,2 mg/kg permet une intubation en 1 minute en cas de contre-indication à la célocurine®.
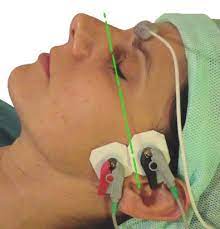
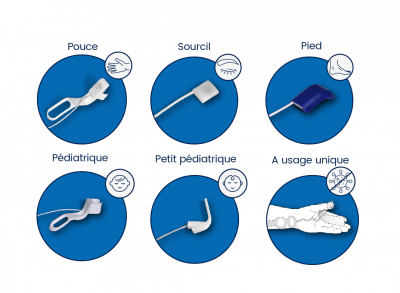
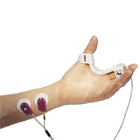
– On utilise le muscle sourcilier pour intuber
– Le muscle adducteur du pouce pour extuber. (muscle sensible aux curares)
Le sourcilier donne une réponse qui optimise la décurarisation alors que l’adducteur donne une réponse plus basse qui montre une curarisation résiduelle
Le sourcilier est analogue aux muscles laryngés, abdominaux (reste toujours un peu curarisé, récupère plus vite)
- Avantage :
– site unique &
– ↓ délais d’intubation - Inconvénient : changement de site.
L’adducteur du pouce est analogue aux muscles pharyngés, au diaphragme aux muscles périphériques (curarisation totale mais récupère moins vite).
Il faut calibrer le TOF watch pour rendre plus valide la mesure à l’adducteur du pouce.
– Petit mémento IADE
On peut dire que
- Le sourcilier c’est ce que voit le chirurgien
- L’adducteur donne le bon reflet et la bonne sécurité
- Le meilleur TOF reste le chirurgien.
Pour autant, changer de site de contrôle de la curarisation en cours d’anesthésie n’a pas de sens. Il est sans doute bon de garder le site de l’adducteur du pouce comme le site de référence, d’autant que des cas de brûlures "seraient" décrites au sourcilier (références bibliographiques ?)
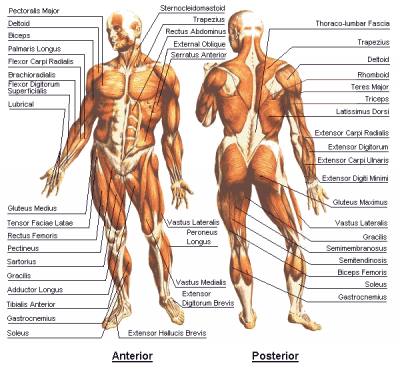
- Le positionnement du capteur du TOF
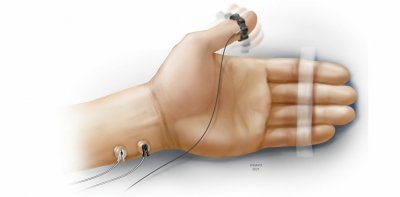
– L’électrode blanche ou rouge : la plus près du buste ( Blanche-Buste, ou Rouge- plus proche de la Racine du membre : proximale
– L’électrode noire la plus éloignée du buste : distale.
Le PTC : post tetanic count
– simple twich (1Hz) pendant 5 secondes (fréquence élevée (50 à 100 Hz)
– se fait à l’adducteur ou au sourciiler (des cas de brûlures ont été rapportés avec une stimulation répétée). Acte douloureux ++ qui doit se faire sous AG. Permet de voir la curarisation profonde.
- * entre 0 & 5 bloc très profond
- * entre 5 & 10 bloc moyen
- * > 10 bloc allégé (1 réponse au TOF)
Entre 2 PTC il faut 6 minutes de délai.
Si on a une réponse au TOF, ne pas faire de PTC car les muscles sont saturés. Le PTC permet d’être en adéquation avec le chirurgien. Et garder à l’esprit que le meilleur TOF reste le chirurgien malgré tout.
— -
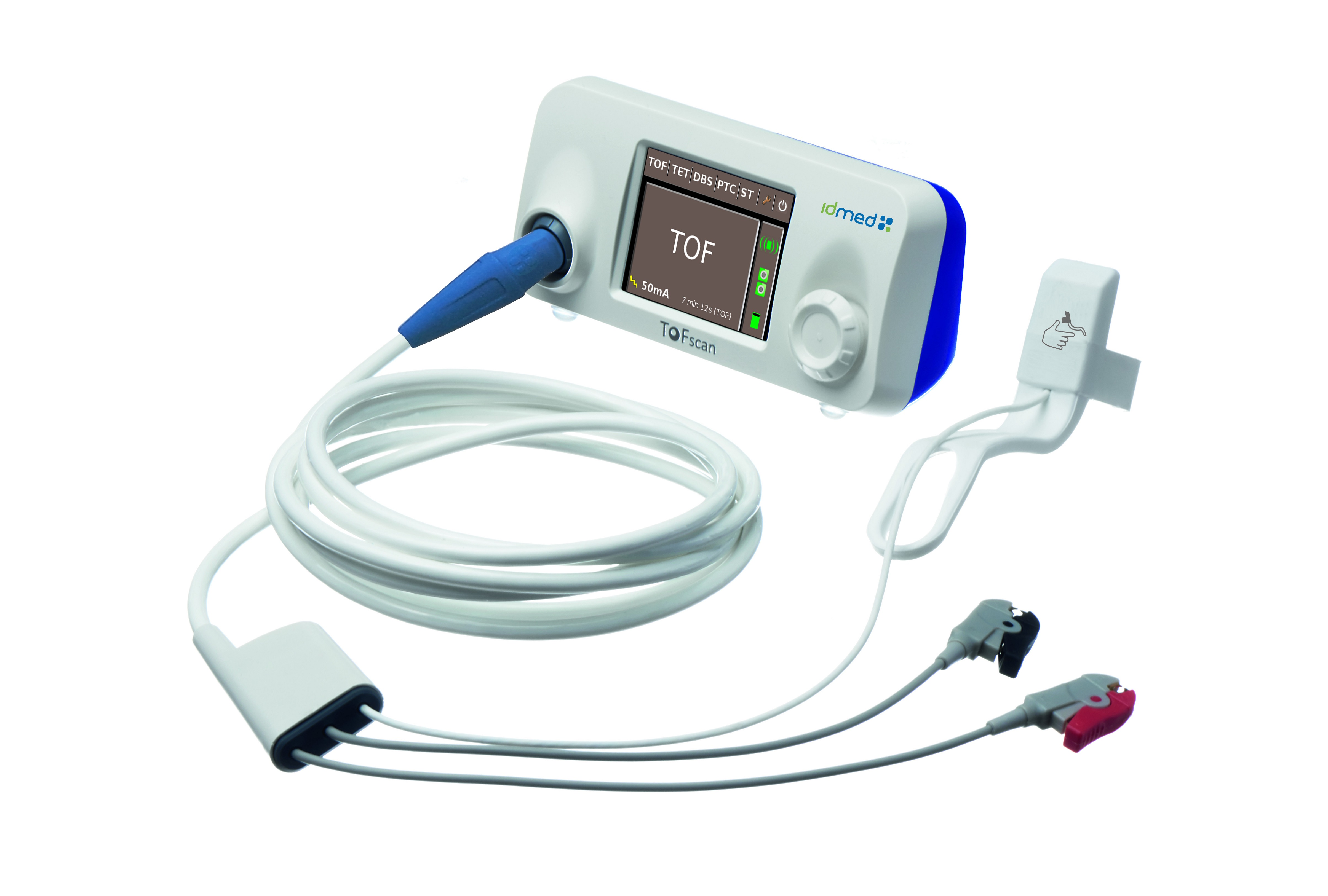
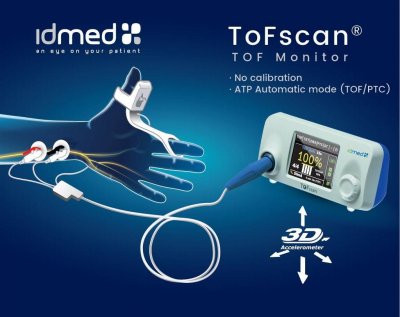
Une mise à jour des Tofscan a été faite. Les câbles n’étant pas compatibles entre l’ancienne et la nouvelle version. (On est à peine surpris...) Pour vérifier la version de votre Tofscan, document ci-contre.
- Monitorer l’orbiculaire
- Monitorer l’abducteur du pouce
- IDMED - ToFscan - Moniteur de curarisation
— -
STATION DE CURARISATION SANS FIL
Le WiTOF est la première station de curarisation sans fil.

– Pilotage en temps réel de la curarisation
Véritable station de la curarisation, le WiTOF dispose d’une interface graphique qui aide l’utilisateur à un pilotage précis de la profondeur de curarisation. Elle permet de visualiser et aide à anticiper la décurarisation et à mener à bien l’antagonisation. La mise en place d’alertes donne la possibilité de prévenir à tout instant l’utilisateur sur le niveau réel de curarisation du patient.
– Transmission sans fil sécurisée
Les capteurs sans fil du WiTOF simplifient l’accessibilité patient et permettent un positionnement éloigné du moniteur en bloc opératoire. IDMED a doté le WiTOF d’un ensemble d’algorithmes et protocoles garantissant une communication sans fil à la fois robuste et sécurisée. L’accessibilité à la main ou au pied du patient n’est plus un choix par défaut mais une décision du praticien.

– Utilisation intuitive
Ses capteurs intègrent un pré-positionnement idéal des électrodes permettant une maitrise de la distance inter-électrode et ainsi une stimulation électrique adaptée. Ils contrôlent en continu l’impédance du patient et s’illuminent de flashs colorés afin de valider instantanément la qualité des stimulations.

A l’aide du WiTOF, l’utilisateur solutionne les problèmes de connectivité moniteur-patient et maîtrise la profondeur de curarisation.
— -
A lire l’article sur les inventions de notre quotidien professionnel et la découverte des curares.
— -
Décurarisation
Extubation : on extube quand T4/T1 supérieur ou égal 90% (intuber est une compétence, extuber est un art).
Le rapport T4/T1
– 0,2 : ventilation minute adéquate
– 0,3 : seuil de détection visuelle au TOF
– 0,4 : head lift test
– 0,6 : seuil de détection au DBS
– 0,7 : traction canule buccale
– 0,9 : seuil d’extubation
– 1 : décurarisation adéquate
DBS : Si la 2e réponse = à la 1ere, on peut dire que le patient a au moins un T4/T1 à 60 %
- Prostigmine : Quand il y a quatre réponses au TOF. 40 mcg/kg. L’ajout d’atropine dépend du pouls du patient, de son traitement, des éventuelles contre-indications. Mais les effets indésirables de la néostigmine doivent être couverts par l’ajout de l’atropine. Il n’y a pas d’interaction entre néostigmine et atropine, et aucune étude ne relève une prévalence dans la manière de délivrer l’antagonisme, à savoir atropine 10 à 20 mcg/kg PUIS néostigmine 40 mcg/kg dès l’apparition d’une tachycardie, ou atropine et néostigmine en même temps, voire dans la même seringue.
- Bridion® : Sugammadex
– bloc modéré : TOF > ou = 2 réponses 2mg/kg
– bloc profond : PTC entre 0 & 5 ou TOF < à 2 réponses:4 mg/kg
– réversion immédiate (ventilation impossible) 16 mg/kg
Ne fonctionne que sur les stéroïdes : rocuronium (esmeron®) et vécuronium (norcuron®).
A noter que le vécuronium n’est plus commercialisé en France depuis le 18 février 2010, après une mise sur le marché du 25 avril 1983, et a été retiré du marché français le 11 avril 2018.
Une fois antagonisé, il faut vérifier la validité par un tof > ou = à 90%. Il convient d’attendre environ 1 minute pour objectiver la validité de l’antagonisation.
Si au bout de 3 minutes, le TOF reste dans les limites inférieures, il est recommandé de faire une injection supplémentaire de sugammadex. Le volume circulant des molécules étant top faible pour avoir une action efficace.
Gardez à l’esprit qu’une fois antagonisé, il faut :
- Changer de molécule en cas d’urgence de moins de 5 minutes.
- Doubler la dose de rocuronium si vous disposez de plus de 5 minutes entre l’antagonisation et la recurarisation pour reprise chirurgicale. Attention, le temps de curarisation peut être raccourcie jusqu’à 15 minutes.
- Si vous disposez de 4 heures et plus, la dose sera standard, si la fonction rénale est normale.
- Attendre 24 heures avant de pouvoir recurariser si la fonction rénale est modérée à légère.
- En cas d’insuffisance rénale sévère ou dialysé, le sugammadex est contre-indiqué.
NB : Une antagonisation au bridion nécessite 24 heures de délais d’après le laboratoire NV organon.
Un bon "truc" à savoir en cas d’allergie à l’esméron (rocuronium). Utilisez du sugammadex (bridion) 16 mg/kg. Reversion immédiate et molécules "coupables" emprisonnées. Le traitement symptomatique s’impose si besoin, mais les effets peuvent en être diminués grâce à cette action.
– Toujours sur l’allergie, le sugammadex peut potentiellement donner des allergies, comme n’importe quelle molécule. En tapant les mots clés " sugammedex allergy, case report" sur pubmed, on trouve à l’heure de ces lignes, 120 articles, cependant, tous ne parlent pas de l’allergie au sugammadex, mais également de l’allergie au rocuronium tamponnée par le sugammadex. Il convient donc de lire, de trier et surtout de relativiser en regardant le ratio sugammadex/allergie par rapport aux quantités de sugammadex délivrée dans les blocs du monde entier. (Pour le moins ceux des pays riches, vu le coût du sugammadex).
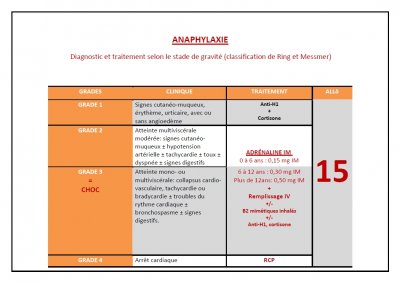
Échelle de gravité clinique Ring et Messmer en cas d’allergie.
Le praticien en anesthésie réanimation
Volume 18, numéro 3
pages 158-163 (juin 2014)
Doi : 10.1016/j.pratan.2014.03.011
Progrès dans le monitorage neuromusculaire quantitatif
J. Ross Renew, MD, FASA, FASE
Volume 4, No. 3 • Octobre 2021 Source : www.apsf.org
Summary :
Le monitorage neuromusculaire quantitatif est le seul moyen fiable de confirmer une récupération adéquate après un bloc musculaire et d’éviter une faiblesse résiduelle postopératoire. Les anesthésistes doivent se familiariser avec les nouvelles technologies de monitorage afin de réduire les complications associées à une gestion insuffisante du bloc neuromusculaire.
Appel à la surveillance
Lorsque les patients deviennent hypertensifs au bloc opératoire, l’anesthésiste administre immédiatement le traitement nécessaire. Qu’il s’agisse de fluides intraveineux ou de médicaments vasoactifs, les cliniciens ont été formés à intervenir avec précision et à éviter une détérioration clinique. Comment les anesthésistes savent-ils que leur intervention a réussi ? Présument-ils que le bolus de phényléphrine était suffisant parce qu’ils connaissent la pharmacodynamique de ce médicament et qu’ils s’attendent à ce que tous les patients réagissent de manière prévisible ? Est-ce qu’ils palpent l’artère carotide à la suite d’un bolus de fluides intraveineux pour s’assurer qu’ils ont rétabli le volume intravasculaire et obtenu une stabilité hémodynamique ? Bien sûr que non. En fait, les anesthésistes font tout leur possible pour s’assurer qu’ils disposent d’appareils précis, tels qu’un brassard de tensiomètre de la bonne taille, voire un cathéter intra-artériel qui fournit des mesures quantitatives en temps réel de la tension artérielle. Ces professionnels s’attendent à ce que leur intervention ait l’effet souhaité, mais une vigilance innée les force à vérifier et à ne pas se fier à la pharmacodynamique prédictive ou à des évaluations subjectives, telles que la palpation du pouls.
Ce modèle de pratique doit être élargi à la gestion du bloc neuromusculaire. L’administration d’un antagoniste du bloc neuromusculaire, tel que le sugammadex ou la néostigmine, une attente de plusieurs minutes, suivie de l’extubation de la trachée d’un patient sans confirmer une récupération suffisante est une méthode semblable à l’administration de phényléphrine sans vérifier à nouveau la tension artérielle et confirmer que l’intervention a réussi. De même, la palpation de la réponse du pouce à une stimulation du train-de-quatre au moyen d’un neurostimulateur périphérique (NSP) et la détermination subjective d’une récupération suffisante constituent une pratique comparable à la palpation de l’artère carotide pendant l’administration du produit. Les anesthésistes s’appuient sur des technologies de pointe pour maintenir l’homéostase des patients et ne doivent pas exclure la gestion du bloc neuromusculaire de leur pratique.
La réticence parmi la communauté des anesthésistes à adopter un monitorage quantitatif (ou objectif) est un phénomène étrange qui a provoqué des publications bien spécifiques. Un sondage international de plus de 2500 anesthésistes a révélé de graves lacunes de connaissances à propos des principes fondamentaux de la gestion du bloc neuromusculaire. En effet, les personnes interrogées ont répondu correctement seulement à 57 % des questions. Encore plus inquiétant peut-être est le fait que 92 % des personnes qui ont répondu au sondage et qui ont donné de mauvaises réponses étaient malheureusement confiantes par rapport à celles-ci.1 On constate également une opinion croissante que le sugammadex élimine le besoin d’un monitorage quantitatif. Bien que cet antagoniste permette sans aucun doute une accélération de l’antagonisme du bloc neuromusculaire, à des degrés de bloc plus profonds, l’administration du sugammadex sans monitorage peut avoir pour conséquence une faiblesse résiduelle au moment de l’extubation chez 9,4 % des patients.2 Ces lacunes et cette confiance mal placée constituent indubitablement des obstacles, mais l’absence d’une formation uniforme a également été citée comme barrière au monitorage.3 Enfin, on constate historiquement une insuffisance de moniteurs neuromusculaires quantitatifs fiables et faciles d’emploi que les cliniciens intéressés pourraient utiliser.4
L’absence de monitorage quantitatif systématique est un problème qui persiste dans le monde entier, néanmoins une dynamique continue de s’instaurer, avec un intérêt grandissant pour ce sujet parmi les anesthésistes. Les panels d’experts réclament le monitorage systématique,5 alors que les associations d’anesthésistes ont mis en place des recommandations pour l’utilisation d’un monitorage quantitatif à chaque administration de curares.6-8 Le secteur a répondu avec de nouveaux moniteurs et des innovations qui devraient permettre l’amélioration de la sécurité des patients. Cet article passera en revue quelques-unes des technologies de pointe dont disposent actuellement les cliniciens souhaitant utiliser le monitorage neuromusculaire quantitatif.
Modalités de monitorage
L’utilisation d’un neurostimulateur périphérique (NSP) est qualitatif et même des anesthésistes expérimentés ne sont pas en mesure de détecter de manière fiable l’épuisement (fade) lorsque le rapport du train-de-quatre est supérieur à 0,4.9 En outre, les protocoles fondés sur les preuves qui intègrent l’administration ciblée de curares, l’antagonisme systématique du bloc neuromusculaire et « l’utilisation optimale » d’un neurostimulateur périphérique peuvent encore laisser 35 % des patients avec une faiblesse résiduelle.10 Le rôle limité du NSP doit être relégué à un dispositif utilisé uniquement si des moniteurs quantitatifs ne sont pas disponibles ou à un dispositif qui apporte des données qualitatives en attendant que les anesthésistes adoptent les moniteurs quantitatifs.5
Les moniteurs quantitatifs sont généralement classés en fonction des méthodes par lesquelles ils obtiennent des mesures objectives (aussi appelées leurs modalités de monitorage). Cependant, ces appareils peuvent aussi être classés selon qu’il s’agisse de moniteurs portatifs et indépendants ou de moniteurs intégrés à un dispositif de surveillance de l’anesthésie. Les moniteurs portatifs offrent la souplesse d’obtenir des mesures objectives en dehors du bloc opératoire. La faiblesse résiduelle postopératoire n’est certainement pas une menace spécifique à la sécurité des patients dans le cadre d’une intervention chirurgicale et les moniteurs portatifs permettent un diagnostic dans la salle de réveil ou dans le service de soins intensifs. Les moniteurs incorporés au dispositif de surveillance de l’anesthésie comportent des modules intégrés qui permettent une transmission transparente des mesures objectives au dossier médical électronique. La compréhension des besoins de votre pratique s’avèrera précieuse dans le choix d’une modalité de monitorage et la décision d’opter pour un moniteur portatif ou intégré.
La mécanomyographie
Avant sa commercialisation, chaque nouvel appareil est comparé à la mécanomyographie (MMG). Ce modèle d’excellence historique se caractérise par une installation fastidieuse, nécessitant un calibrage minutieux, car il permet d’obtenir des mesures objectives en mesurant la force de la contraction isométrique après la neurostimulation. Lors de l’interprétation des publications évaluées par les pairs sur les nouvelles technologies de monitorage quantitatif, le plus haut niveau de preuve résulte actuellement d’une comparaison directe avec la MMG.
L’accéléromyographie
L’accéléromyographie (AMG) est l’une des formes de monitorage quantitatif les plus étudiées et les plus utilisées.4 Fondée sur la deuxième loi du mouvement de Newton (force = masse × accélération), l’AMG mesure de manière objective la réponse à la neurostimulation à l’aide d’un transducteur fixé sur le muscle concerné. Traditionnellement, les électrodes d’un électrocardiogramme (ECG) standard sont placées sur le nerf ulnaire et l’accélération du muscle adducteur du pouce est mesurée après la neurostimulation (Figure 1). Cette configuration ressemble fortement à l’utilisation d’un neurostimulateur périphérique sur la main, hormis le transducteur supplémentaire fixé au pouce. L’AMG est aussi utilisée sur le pied (muscle court fléchisseur de l’hallux) et sur le visage (orbiculaire de l’oeil/muscle corrugateur du sourcil). Bien que l’installation de l’AMG puisse être intuitive, cette modalité de monitorage comprend des mises en garde importantes. Le phénomène de « l’épuisement inversé » où le train-de-quatre de référence, sans paralysie, supérieur à 1,0 a été bien décrit dans le cadre du monitorage par AMG.11 Bien que les mécanismes exacts demeurent flous, l’épuisement inversé peut avoir des implications significatives quand il s’agit de savoir si un patient a atteint une récupération neuromusculaire adéquate avant d’extuber la trachée. La normalisation est un procédé qui place tous les rapports du train-de-quatre (TOFR) dans le contexte du train-de-quatre de référence (TOFR actuel/TOFR de référence) et peut tenir compte des TOFR de référence supérieurs à 1,0. Plutôt que de définir une récupération adéquate de la fonction neuromusculaire indiquée par un TOFR >0,9, une récupération adéquate est réellement obtenue lorsque le TOFR normalisé est supérieur à 0,9 en mesurant par AMG.
Cliquez sur l’image pour agrandir
Figure 1 : L’accéléromyographie
En outre, la normalisation diminue le biais par rapport à la MMG. L’utilisation d’un dispositif de précharge, qui stabilise le mouvement du pouce, et la réalisation du calibrage avant l’administration de curare, qui peut aussi renforcer la précision du monitorage par AMG, sont toutes les deux obligatoires pour réaliser des recherches dans ce domaine.12 Cependant, ces étapes supplémentaires ne sont pas impératives dans le cadre de soins cliniques. En revanche, la normalisation systématique est fortement conseillée pour éviter de surestimer le degré de récupération neuromusculaire à la fin de l’opération.
La mise en garde la plus importante à prendre en compte pour le monitorage par AMG est le fait que le muscle concerné (généralement le pouce) doit pouvoir effectuer librement des mouvements après la neurostimulation. La position du patient avec les bras placés le long du corps pendant une intervention chirurgicale peut avoir une incidence significative sur la capacité du clinicien à obtenir des mesures fiables avec l’AMG. D’autre part, le monitorage par AMG sur des patients éveillés peut s’avérer difficile en raison des artéfacts produits par les mouvements spontanés au site de monitorage.
Bien qu’il soit impératif que les cliniciens connaissent certaines nuances importantes avant la mise en œuvre du monitorage par AMG, les progrès récents réalisés dans le domaine de la modalité ont rendu l’AMG plus accessible. Des transducteurs tridimensionnels sont désormais intégrés aux appareils d’AMG les plus récents, permettant une meilleure quantification du mouvement complexe du pouce après neurostimulation. En outre, l’intégration de dispositifs de précharge dans les nouveaux appareils améliore la précision sans devoir obtenir et installer des équipements supplémentaires.13 D’autre part, des configurations sans fil des moniteurs AMG, qui utilisent la technologie Bluetooth pour transmettre les mesures quantitatives relevées au point de monitorage à un écran intégré à la machine d’anesthésie (communication personnelle), ont été développées. Les moniteurs AMG existent en version portative ou sous forme de modules pouvant être intégrés à la machine d’anesthésie.
La kinémyographie
La kinémyographie (KMG) est une modalité de monitorage qui se rapproche de l’AMG. Pendant un monitorage par KMG, un capteur piézoélectrique est placé dans le creux entre le pouce et l’index (Figure 2). Après la stimulation du nerf ulnaire, le muscle adducteur du pouce se contracte et le capteur piézoélectrique se plie. Le degré de sa courbe est alors traduit en mesures objectives. Le capteur agit aussi comme dispositif de précharge et la KMG n’est pas soumise au phénomène d’épuisement inversé comme l’AMG. Des rapports antérieurs ont démontré de larges limites d’agrément entre la MMG et la KMG.14 Tout comme l’AMG, la KMG dépend aussi de la possibilité pour le pouce d’effectuer librement des mouvements et le positionnement du patient avec les bras serrés le long du corps peut empêcher cette utilisation. Les mouvements du patient pendant l’émergence peuvent aussi avoir une incidence sur le monitorage par KMG, ainsi que le repositionnement du capteur pendant la période peropératoire. Actuellement, le seul appareil fondé sur la KMG qui soit disponible est un module intégré à la machine d’anesthésie.
Cliquez sur l’image pour agrandir
Figure 2 : La kinémyographie
L’électromyographie
L’électromyographie (EMG) a été considérée par de nombreux experts comme la nouvelle règle d’or, en raison de son grand degré d’agrément avec la MMG15-17 et le fait que l’EMG procure des mesures quantitatives fiables lorsque les bras sont confinés pendant le positionnement chirurgical. L’EMG mesure les potentiels d’action globaux du muscle (PAM) dans l’unité neuromusculaire plutôt que le mouvement ou un quelconque substitut du mouvement. L’amplitude des PAS est directement proportionnelle au nombre de fibres musculaires activées (et donc à la force de contraction). L’EMG est sujette aux interférences créées par l’électrocautérisation et l’amplitude des PAM peut augmenter de 2 à 3 % pour chaque baisse de 1°C de la température cutanée.18
Les moniteurs EMG existent en version portative, manuelle ou intégrée à la machine d’anesthésie. La plupart des fabricants utilisent des électrodes propriétaires pour stimuler et mesurer les PAM qui sont placés sur la main. Parce que le monitorage par EMG n’est pas interrompu lorsque les bras du patient sont positionnés le long de son corps l’utilisation d’un site de mesure alternatif est moins importante bien que le monitorage au pied ait été décrit comme une option si aucune des deux mains n’est disponible.19 Pour un monitorage à la main, trois groupes musculaires ont été utilisés pour mesurer les MPA après la stimulation du nerf ulnaire. Comme pour l’AMG et la KMG, des électrodes de détection peuvent être placées sur le muscle adducteur du pouce (Figure 3). Le premier interosseux dorsal, situé dans l’espace entre le pouce et l’index, peut également être monitoré. Enfin, le muscle adducteur du petit doigt (auriculaire) est innervé par le nerf ulnaire et est un point de monitorage adapté à l’EMG. Bien qu’il s’agisse de la modalité de monitorage la plus ancienne, l’EMG suscite de plus en plus d’intérêt, comme le démontre la commercialisation de plusieurs nouveaux moniteurs à base d’EMG.
Cliquez sur l’image pour agrandir
Figure 3 : L’électromyographie
Toutes les figures sont des originaux produits par l’auteur.
Monitorage par brassard
Un développement récent a permis d’intégrer le monitorage objectif au brassard d’un tensiomètre.20 Aussi appelé la technique du brassard modifié, le monitorage par brassard semble s’inspirer de la compressomyographie, une modalité de monitorage désormais abandonnée qui avait donné des premiers résultats prometteurs.21 Dans le monitorage par brassard, celui-ci est gonflé à environ 60 mmHg, puis des électrodes à l’intérieur du brassard assurent la neurostimulation. Des changements de pression sont détectés, suivis d’une contraction musculaire et ces changements de pression sont utilisés pour fournir aux cliniciens des données objectives sur le degré de bloc neuromusculaire. Les premières études ont montré que le monitorage du haut du bras peut présenter des propriétés neuromusculaires différentes des muscles distaux de la main et que le monitorage par brassard ne remplace pas nécessairement le monitorage par EMG ou AMG à la main.22 Bien que la technologie du monitorage par brassard puisse sembler intéressante, car elle permet de surveiller deux paramètres importants (la tension artérielle et le degré de bloc neuromusculaire), il faut procéder à d’autres recherches pour définir sa répétabilité et sa reproductibilité dans le cadre de divers scénarios cliniques.
La mise en œuvre du monitorage dans votre pratique clinique
Des obstacles se dressent sur l’implémentation de ces changements importants de pratique, en particulier lorsque de nombreux anesthésistes feignent de connaitre le problème persistant de la curarisation résiduelle postopératoire. La décision de changer votre pratique et d’y intégrer le monitorage peut être intimidante, car elle demande de sortir de votre zone de confort, de donner plus de votre temps et d’apprendre une nouvelle technique. Le fait qu’un tel changement puisse avoir un impact sur le flux de travail et l’efficacité pourra susciter des inquiétudes. Heureusement, il a été démontré que l’utilisation des moniteurs quantitatifs ajoute seulement 19 secondes d’effort au début d’un cas.23 Une fois que la décision a été prise de mettre en œuvre le monitorage, la décision sur la modalité peut aussi sembler insurmontable. Indubitablement, la compréhension de la culture de votre pratique est essentielle, comme le décrit Todd et al., lorsque ce groupe a mis en place le monitorage par EMG dans l’ensemble du service, après avoir observé qu’un nombre inacceptable de patients souffrait de détresse respiratoire en salle de réveil.24
La familiarisation avec les technologies de monitorage émergentes sera certainement un avantage pour améliorer la probabilité de la réussite de la mise en œuvre et du changement de pratique. Le moniteur ou la modalité spécifique est seulement une partie du changement, car la décision de changer de pratique est beaucoup plus importante et est très souvent beaucoup plus difficile. Ce changement impliquera sans aucun doute un supplément de travail, cependant nous devons à nos patients de leur faire bénéficier de soins d’avant-garde.
J. Ross Renew, MD, FASA, FASE est actuellement professeur assistant dans le Service d’anesthésie et médecine périopératoire de la Mayo Clinic de Jacksonville, Floride.
Il a reçu un financement pour ses recherches, notamment de Merck & Co, dont l’intégralité a été transmise à Mayo Clinic.
- Documents de référence
- Naguib M, Brull SJ, Hunter JM, et al. Anesthesiologists’ overconfidence in their perceived knowledge of neuromuscular monitoring and its relevance to all aspects of medical practice : an international survey. Anesth Analg. 2019 ;128:1118–1126.
- Kotake Y, Ochiai R, Suzuki T, et al. Reversal with sugammadex in the absence of monitoring did not preclude residual neuromuscular block. Anesth Analg. 2013 ;117:345–351.
- Thomsen JLD, Marty AP, Wakatsuki S, et al. Barriers and aids to routine neuromuscular monitoring and consistent reversal practice—a qualitative study. Acta Anaesthesiol Scand. 2020 ;64:1089–1099.
- Soderstrom CM, Eskildsen KZ, Gatke MR, Staehr-Rye AK. Objective neuromuscular monitoring of neuromuscular blockade in Denmark : an online-based survey of current practice. Acta Anaesthesiol Scand. 2017 ;61:619–626.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018 ;127:71–80.
- Lucas DN, Russell R, Bamber JH, Elton CD. Recommendations for standards of monitoring during anaesthesia and recovery 2021. Anaesthesia. 2021 Jun 18. doi : 10.1111/anae.15528.
- Dobson G, Chow L, Filteau L, et al. Guidelines to the practice of anesthesia—revised edition 2020. Can J Anaesth. 2019 ;64:75–91.
- Indications of neuromuscular blockade in anaesthesia. Short text. Ann Fr Anesth Reanim. 2000 ;19 2:352s–355s.
- Viby-Mogensen J, Jensen NH, Engbaek J, et al. Tactile and visual evaluation of the response to train-of-four nerve stimulation. Anesthesiology. 1985 ;63:440–443.
- Thilen SR, Ng IC, Cain KC, Treggiari MM, Bhananker SM. Management of rocuronium neuromuscular block using a protocol for qualitative monitoring and reversal with neostigmine. Br J Anaesth. 2018 ;121:367–377.
- Claudius C, Skovgaard LT, Viby-Mogensen J. Is the performance of acceleromyography improved with preload and normalization ? A comparison with mechanomyography. Anesthesiology. 2009 ;110:1261–70.
- Fuchs-Buder T, Claudius C, Skovgaard LT, et al. Good clinical research practice in pharmacodynamic studies of neuromuscular blocking agents II : the Stockholm revision. Acta Anaesthesiol Scand. 2007 ;51:789–808.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during Recovery of Neuromuscular Function. Anesthesiology. 2018 ;129:880–888.
- Motamed C, Kirov K, Combes X, Duvaldestin P. Comparison between the Datex-Ohmeda M-NMT module and a force-displacement transducer for monitoring neuromuscular blockade. Eur J Anaesthesiol. 2003 ;20:467–469.
- Engbaek J, Ostergaard D, Viby-Mogensen J, Skovgaard LT. Clinical recovery and train-of-four ratio measured mechanically and electromyographically following atracurium. Anesthesiology. 1989 ;71:391–395.
- Kopman AF. The relationship of evoked electromyographic and mechanical responses following atracurium in humans. Anesthesiology. 1985 ;63:208–211.
- Harper NJ, Bradshaw EG, Healy TE. Evoked electromyographic and mechanical responses of the adductor pollicis compared during the onset of neuromuscular blockade by atracurium or alcuronium, and during antagonism by neostigmine. Br J Anaesth. 1986 ;58:1278–1284.
- Engbaek J. Monitoring of neuromuscular transmission by electromyography during anaesthesia. A comparison with mechanomyography in cat and man. Dan Med Bull. 1996 ;43:301–316.
- Kern SE, Johnson JO, Orr JA, Westenskow DR. Clinical analysis of the flexor hallucis brevis as an alternative site for monitoring neuromuscular block from mivacurium. J Clin Anesth. 1997 ;9:383–387.
- Veiga Ruiz G, Garcia Cayuela J, Orozco Montes J, et al. Monitoring intraoperative neuromuscular blockade and blood pressure with one device (TOF-Cuff) : a comparative study with mechanomyography and invasive blood pressure. Rev Esp Anestesiol Reanim. 2017 ;64:560–567.
- Dahaba AA, Bornemann H, Holst B, Wilfinger G, Metzler H. Comparison of a new neuromuscular transmission monitor compressomyograph with mechanomyograph. Br J Anaesth. 2008 ;100:344–350.
- Krijtenburg P, Honing G, Martini C, et al. Comparison of the TOF-Cuff® monitor with electromyography and acceleromyography during recovery from neuromuscular block. Br J Anaesth. 2019 ;122:e22–e24.
- Renew JR, Hex K, Johnson P, et al. Ease of application of various neuromuscular devices for routine monitoring. Anesth Analg. 2021 ;132:1421–1428.
- Todd MM, Hindman BJ, King BJ. The implementation of quantitative electromyographic neuromuscular monitoring in an academic anesthesia department. Anesth Analg. 2014 ;119:323–331.
Allergie et curares : évolution de l’épidémiologie (podcast )
Paul Michel Mertes a, ⁎, b, 1 , Nadine Petitpain c, Jean-Marc Malinovsky d, Pierre Gillet e
-* a Service d’anesthésie-réanimation chirurgicale, Nouvel Hôpital Civil, hôpitaux universitaires de Strasbourg, 1, place de l’Hôpital, BP 426, 67091 Strasbourg cedex, France
- b Inserm U1116, groupe Choc, hôpital Central, 29, avenue du Maréchal-de-Lattre-de-Tassigny, 54035 Nancy cedex, France
- c Centre régional de pharmacovigilance de Lorraine, CHU de Nancy, 29, avenue du Maréchal-de-Lattre-de-Tassigny, 54035 Nancy cedex, France
- d Service d’anesthésie-réanimation, pôle URAD, hôpital Maison-Blanche, CHU de Reims, 45, rue Cognacq-Jay, 51092 Reims cedex, France
- e Laboratoire de pharmacologie clinique et toxicologie, CHU de Nancy, 29, avenue du Maréchal-de-Lattre-de-Tassigny, 54035 Nancy cedex, France
⁎Auteur correspondant.
Résumé
L’incidence des réactions anaphylactiques à un curare est croissante. Sa fréquence varie selon les pays. En France, l’incidence de ces réactions est évaluée à 184,0 [139,3–229,7]/million d’anesthésies, avec une mortalité évaluée à 4,4 %. Les substances les plus fréquemment en cause sont la succinylcholine et le rocuronium. Des facteurs environnementaux semblent responsables de l’apparition d’une sensibilisation en l’absence d’une exposition préalable. La pholcodine présente dans certains sirops antitussifs pourrait être impliquée dans cette sensibilisation. Une étude cas-témoins (ALPHO) débute en France en 2014. Elle a pour objectif de rechercher un lien entre exposition à la pholcodine et survenue d’un choc anaphylactique à un curare. Tous les anesthésistes sont invités à y participer en déclarant leurs cas à l’aide d’un numéro vert (0 800 871 943).
Le texte complet de cet article est disponible en PDF.
Mots clés : Anaphylaxie, Curare, Succinylcholine, Rocuronium, Sugammadex, Épidémiologie
source : em-select.com
A lire sur le couple sugammadex-rocuronium (pubmed en anglais) et à lire en bas de page de cet article, les derniers cas rapportés sur le "couple" rocuronium-sugammadex, qui pourrait être responsable de quelques cas d’allergies.
Et l’autorisation tardive (le 15 décembre 2015) de la FDA américaine pour l’utilisation du sugammadex, alors qu’en France il est en vente depuis le 25 juillet 2008.
Le générique du sugammmadex a permis de passer d’un prix de 75 euros le flacon de 2 m 100 mg/ml à 4.91 euros (à comparer au 0.47 euro pour la néostigmine...). Il est dès lors plus aisé pour les structures de s’en procurer.
Lire l’article sur l’allergie (latex, curares, antibiotiques, iode et autre) ainsi que des données sur le choc anaphylactique.
— -
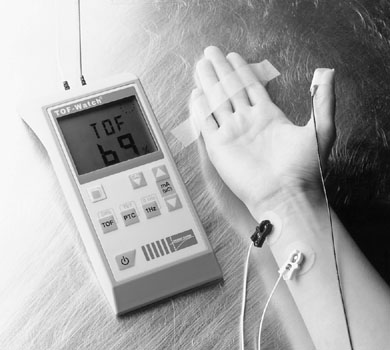
– Je mets à la disposition de tous, le livret du monitorage de la curarisation, des laboratoires Schering Plough, qui est un mode d’emploi. Je précise qu’aucune mention interdisant tout procédés de copie et de diffusion n’est mentionnée dans le présent guide. Ceci est donc un scanne de la brochure dans son intégralité. La réduction n’étant pas probante, je laisse la taille initiale du document. Pour que chacun sache se servir du TOF watch’s.
- Edit : Document laissé pour mémoire. Le TOF watch’s étant largement remplacé par le Tofscan, dont vous avez le mode d’emploi au début de cet article.

– Pour approfondir sa connaissance sur le Sugammadex (Bridion*)
– Rapid sequence induction and intubation with rocuronium–sugammadex compared with succinylcholine : a randomized trial Comparaison entre Suxaméthonium et rocuronium-sugammadex pour une récupération d’une ventilation spontanée efficace en cas d’intubation difficile en séquence rapide. (Le temps médian entre l’intubation trachéale et la ventilation spontanée était de 406 secondes avec la succinylcholine et de 216 secondes avec le rocuronium – sugammadex (p = 0,002). Le temps médian entre l’intubation trachéale et 90% de récupération de la première réponse en train de quatre (T1 90%) était de 518 secondes avec la succinylcholine et de 168 secondes avec du rocuronium – sugammadex (P <0,0001). Les conditions d’intubation et le délai avant intubation trachéale n’étaient pas significativement différents).
– Le Graal anesthésique des curares ? Le gantacurium et le calabadion
et la traduction pour les réfractaires à la langue de nos voisins d’outre-Manche.
Novel drug development for neuromuscular blockade
– L’article de la SOFIA eurékiade où l’histoire du curare est rapportée en détail.
– L’histoire des curares
174 pages. Culture, érudition, histoire. Pour les passionnés et tous les autres !
– Le site du Collège National de Pharmacologie Médicale et sa fiche sur les curares
– Une alerte sur la pholcodine et ses effets avec certains curares
Alerte relayée par une étude ALPHO
Faut-il contre-indiquer les curares chez un patient allergique à la pholcodine ?
Author C.Mouton-Faivre
https://doi.org/10.1016/j.reval.2016.01.050Résumé
Les réactions d’hypersensibilité immédiate aux curares lors de la première anesthésie générale posent la difficile question de savoir comment les patients se sont sensibilisés aux curares sans contact préparant. En 1983, Baldo et Fisher en Australie ont imaginé que cette sensibilisation se ferait par le biais de l’exposition aux ammoniums quaternaires renfermés dans les produits ménagers par exemple. Cette hypothèse n’a jamais été infirmée ou confirmée. Vingt ans plus tard, une autre hypothèse a été proposée par les Norvégiens Florvaag et al. : cette sensibilisation se ferait-elle à cause de l’exposition à la pholcodine renfermée dans les sirops antitussifs ? L’analyse attentive des données de cette abondante littérature norvégienne, qui ne prend jamais en compte les données cliniques assorties au résultat des tests cutanés, ne permet pas de conclure que la pholcodine joue un rôle dans le déclenchement de l’allergie aux curares.
source:sciencedirect.com
– La réponse de l’ANSM sur le sujet, après un premier article de 2009...et un communiqué de 2011.
publié le 01/09/2022
Risque d’allergie grave aux curares en cas d’utilisation des sirops contre la toux contenant de la pholcodine
D’après une nouvelle étude, la prise d’un médicament à base de pholcodine, utilisé contre la toux, expose à un risque important de faire une allergie grave aux curares, indiqués lors d’une anesthésie générale, même si l’anesthésie a lieu plusieurs semaines après la prise du médicament.
Compte tenu du caractère non indispensable de ces sirops et de l’existence d’alternatives thérapeutiques, nous estimons que leur rapport bénéfice / risque est défavorable.
En conséquence, nous envisageons de suspendre les autorisations de mise sur le marché (AMM) en France des sirops contre la toux à base de pholcodine.
– Liste des médicaments concernés
- Dimétane sans sucre 133 mg/100 ml, sirop (Biocodex)
- Biocalyptol 6,55 mg/5 ml sans sucre, sirop édulcoré à la saccharine sodique et au maltitol liquide (Zambon)
- Biocalyptol, sirop (Zambon)
- Pholcodine Biogaran 6,55 mg/5 ml, sirop (Biogaran)
Les sirops à base de pholcodine sont utilisés pour calmer les toux sèches et les toux d’irritation chez les adultes et les enfants de plus de 30 mois et de plus de 15 kg.
En France, ils ne peuvent être délivrés que sur ordonnance depuis 2011.De nouvelles données confirment le risque de réaction allergique grave avec les curares après traitement par la pholcodine.
En raison de ces nouvelles données, compte tenu du caractère non indispensable de ces sirops et de l’existence d’alternatives thérapeutiques, nous estimons que leur rapport bénéfice / risque est défavorable. En conséquence, nous envisageons de suspendre leurs AMM et d’effectuer un rappel de l’ensemble de ces sirops début septembre.
Information pour les patients
- Si vous utilisez ou avez déjà utilisé un sirop contre la toux contenant de la pholcodine, il n’y a pas de surveillance particulière recommandée à l’heure actuelle. Si toutefois vous êtes amené à subir une anesthésie générale, le médecin anesthésiste pourra vous demander si vous avez déjà consommé ce type de sirop. Pensez à l’en informer directement s’il ne vous interroge pas lui-même sur ce point. Nous vous invitons également à inscrire dans Mon espace santé (« Profil médical », puis « Traitements ») que vous avez pris un médicament à base de pholcodine.
- D’autres médicaments sont disponibles contre la toux sèche et / ou d’irritation. Consultez votre médecin ou votre pharmacien, il pourra vous conseiller une alternative tenant compte de votre historique médical.
Information pour les professionnels de santé
– Médecins anesthésistes-réanimateursDemandez à vos patients s’ils ont déjà consommé ce type de sirop.
– Médecins et pharmaciens
Expliquez le risque de réaction croisée aux curares en cas d’anesthésie générale aux patients qui auraient déjà utilisé ces sirops. Assurez-vous qu’ils ont compris l’importance de signaler l’utilisation, même ancienne, de ce type de sirop.
Nos actions antérieures pour sécuriser l’utilisation des sirops contenant de la pholcodine
En 2011, nous avons demandé une évaluation européenne de la balance bénéfice / risque des médicaments à base de pholcodine dans le cadre d’une procédure d’arbitrage (article 31 de la directive 2001/83/CE) à la suite d’une augmentation du nombre de cas de réactions anaphylactiques en France et de la publication de données issues de la littérature (principalement Norvège et Suède) suggérant un lien entre consommation de pholcodine et allergie croisée aux curares. Dans l’attente des résultats de cette évaluation européenne, nous avons rendu la prescription médicale obligatoire pour les médicaments à base de pholcodine et avons largement communiqué sur ce risque potentiel de réaction allergique croisée.Sur la base des données disponibles, le comité des médicaments à usage humain (CHMP) a conclu en décembre 2011 au maintien sur le marché des médicaments contenant de la pholcodine, en raison du faible niveau de preuve du risque étudié.
A la suite de cette évaluation européenne et à la demande de la Commission européenne, une étude de sécurité a été mise en place en France, avec notamment pour objectif de recueillir davantage de données et d’étudier l’association entre la prise antérieure de pholcodine et la survenue d’une réaction anaphylactique en cas d’exposition aux curares.
En avril 2020, dans le contexte de l’épidémie de Covid-19, ce risque nous avait amenés à recommander de ne pas utiliser les sirops à base de pholcodine pour le traitement symptomatique de la toux.
En janvier 2022, le comité de pharmacovigilance de l’EMA (PRAC) a recommandé de mettre à jour les résumés des caractéristiques du produit et les notices des médicaments à base de pholcodine pour inclure un avertissement sur le risque de surconsommation et de réaction croisée avec les curares, sur la base notamment de nouvelles données de la littérature.
Selon notre analyse les résultats préliminaires de l’étude de sécurité demandée en 2011 confirment une association significative entre la prise de ces médicaments et le risque de réaction anaphylactique aux curares. Ces résultats nous conduisent à envisager la suspension des AMM des médicaments contenant de la pholcodine.
– Des précautions à prendre pour la conservation du Suxaméthonium. Les précautions s’appliquent aux SMUR. Mais on doit extrapoler au bloc opératoire.
A ce sujet, la conservation au froid du suxaméthonium est remise en cause :
Froid et suxaméthonium : une recommandation non fondée
P. Dewachter1*, F. Adnet2 et C. Mouton-Faivre3 lors d’une publication dans les Annales Française Med. Urgence (2016) 6:147–148
Cold Storage and Suxamethonium : An Unfounded Recommendation
- 1 Service d’anesthésie-réanimation chirurgicale, groupe hospitalier de Paris-Seine-Saint-Denis, Assistance Publique-Hôpitaux de Paris, & INSERM UMR S970, Sorbonne Paris Cité, France
- 2 Service des urgences, hôpital Avicenne, Assistance Publique-Hôpitaux de Paris & Inserm U942, Université Paris 13, F-93000 Bobigny, France
- 3 Centre hospitalier universitaire de Nancy, hôpital de Brabois, service de dermatologie et consultation d’allergo-anesthésie & université de Lorraine, France
Reçu : 8 Octobre 2015
Accepté : 21 Décembre 2015Cet article ne possède pas de résumé.
© SFMU et Lavoisier SAS 2016
— -
Sur le même sujet.
Peut-on conserver la célocurine® à température ambiante ?
Annales Françaises d’Anesthésie et de Réanimation
Volume 33, Supplement 2, September 2014, Page A255
Annales Françaises d’Anesthésie et de Réanimation
R385Author links open overlay panel
F.Amrani1 V.Veiillard1 A.Astier1 M.Paul1 B.Plaud2
https://doi.org/10.1016/j.annfar.2014.07.431Source : sciencedirect.com
- Introduction
La célocurine® (succinylcholine) est le curare recommandé pour l’intubation en situation d’urgence. Bien que le RCP mentionne une conservation à 4 °C, la célocurine® a été longtemps stockée à température ambiante dans les chariots d’anesthésie et les UMH du SMUR. Suite à la déclaration d’évènements indésirables graves, l’ANSM a rappelé, en 2012, l’obligation de conserver la célocurine® à 4 °C sans qu’il ne soit, pour autant, établi une relation entre sa dégradation potentielle et les réactions anaphylactoides. L’objectif de ce travail était de réaliser une étude de stabilité de la célocurine® dans son conditionnement d’origine, afin de déterminer selon Arrhenius les temps nécessaires pour dégrader 5 et 10 % (T95 % et T90 %) du produit à différentes températures.
- Matériel et méthodes
La succinylcholine était dosée en chromatographie liquide haute performance (HPLC), selon la méthode USP (United States Pharmacopeia) modifiée. Cette méthode a été validée selon les normes ICH (International Conference of Harmonisation) et qui peut être qualifiée de méthode « stability indicating ». Les conditions de chromatographie étaient les suivantes : phase normale, chlorure de tétraméthylammonium/méthanol (20 : 80 v/v), débit (0,75 mL/min), volume d’injection : 40 μL, détection en barrette de diodes. Deux lots d’ampoules de célocurine® ont été placées dans des etudes aux températures suivantes : 60 °C, 80 °C et 100 °C respectivement. Les temps de prélèvements ont été adaptés aux profils de dégradation. Pour chaque temps de prélèvement, une ampoule par lot a été prélevée et chaque prélèvement a été injecté trois fois. Ont été calculés les constantes de dégradation (k), T90 %, T95 %, l’énergie d’activation selon l’équation d’Arrhenius (ln(k) = ln(A)-Ea/RT) où Ea : énergie d’activation en cal/mole, R : constante des gaz parfaits, A : facteur préexponentiel d’Arrhenius, k : constante de vitesse et T : température.
- Résultats
La cinétique de dégradation de la célocurine® suit un modèle d’ordre 1, avec une énergie d’activation Ea = 21,16Kcal/mol, les constantes de dégradation à 60, 80 et 100 °C sont k60 °C = 0,00158 (s = 0,0048 %), k80 °C = 0,00758 (s = 0,0068 %), k100 °C = 0,0493 (s = 0,0036 %) (h-1) respectivement. Les T90 % s’échelonnent entre 66 et 205 j et les T95 % entre 31 et 117 j pour des températures comprises entre 20° et 30 °C. L’analyse des produits de dégradation finaux a permis de mettre en évidence une augmentation progressive de l’acide succinique, par HPLC et de la choline par une méthode de chromatographie sur couche mince (CCM).
- Discussion
Ces résultats montrent que la Célocurine® est relativement stable (2 à 6 mois) pour une température de conservation comprise entre 20° à 30 °C. Même sur la base du T95 %, la stabilité observée (1 mois à 30 °C) est compatible avec le turnover habituel les chariots d’anesthésie et dans les UMH. L’étude de stabilité sur les deux génériques disponibles sur le marché est en cours, et permettra de voir si le changement de formulation a des conséquences sur la recrudescence des événements graves déclarés à l’ANSM.
– À lire :
Podcast interuniversitaires
Vidéo conférence à suivre
— -
Communiqué de la SFAR concernant la modification du RCP de la célocurine
Mis en ligne le 8 Février 2018
Les enquêtes épidémiologiques récentes ont mis en évidence une incidence importante d’accidents anaphylactiques liés à l’emploi des curares et plus spécifiquement de la célocurine. Le taux est approximativement de 1 pour 3000 ampoules vendues comparable à celui du rocuronium tandis qu’il est de 1 pour 30.000 pour l’atracurium. Dans ces conditions, l’ANSM a décidé de revoir le RCP de la celocurine en contre indiquant son usage dans l’indication de prolonger la curarisation lors des interventions de courte durée ce qui n’était pas une pratique recommandée. Les indications de la célocurine restent donc l’intubation à estomac plein (séquence rapide), l’intubation difficile selon les recommandations de la SFAR et la sismothérapie pour éviter les effets secondaires des convulsions provoquées.
En accord avec l’ANSM, la SFAR communique sur la restriction des indications du suxaméthonium qui a fait l’objet d’une lettre aux professionnels de santé en décembre 2017 :
Suite à une augmentation des signalements décrivant des réactions anaphylactiques avec le suxaméthonium, une enquête de pharmacovigilance a été ouverte en mars 2012.
Les données recueillies sur la période 2000-2012 ont ainsi fait état de 680 cas confirmés de réactions anaphylactiques avec ce médicament.
En conséquence, l’ANSM a mis en place en 2014 un comité scientifique spécialisé temporaire (CSST), composé notamment d’anesthésistes-réanimateurs, d’urgentistes, de pharmacovigilants, d’allergologues et de toxicologues.
Les experts ont conclu qu’une restriction des indications des spécialités à base de suxaméthonium était justifiée. Ainsi, compte-tenu, d’une part du fait que l’utilisation du suxaméthonium pour assurer le relâchement musculaire lors des actes chirurgicaux programmés de courte durée ne correspond plus aux standards actuels, et, d’autre-part, du risque de réaction anaphylactique lié à l’utilisation des curares en général et plus particulièrement au suxaméthonium, les spécialités à base de suxaméthonium ne sont plus indiquées dans les « actes brefs en chirurgie programmée ».
En raison de son utilité en cas d’intubation difficile, le suxaméthonium reste indiqué chez l’adulte et l’enfant pour faciliter l’intubation endotrachéale. Le suxaméthonium est indiqué dans l’induction en séquence rapide justifiée par un risque d’inhalation du contenu gastrique. Il est également indiqué chez l’adulte lors des traitements par électroconvulsivothérapie, pour obtenir une curarisation très brève.
Publié le 27 février 2018
Prevention du risque allergique peranesthésique. Recommandations formalisées d’experts. Texte court. AFAR2011 ;30:212-22.
— -
Documents à lire
— -
Indications des antagonistes en anesthésie (néostigmine, flumazénil, naloxone)
Conférences d’actualisation 2000, p. 247-257.
© 2000 Éditions scientifiques et médicales Elsevier SAS, et SFAR
Indications des antagonistes
en anesthésie
(néostigmine, flumazénil, naloxone)
C. Meistelman, M. Brémaud
Service d’anesthésie-réanimation, hôpital de Brabois, rue du Morvan, 54511 Vandœuvre, France
POINTS ESSENTIELS
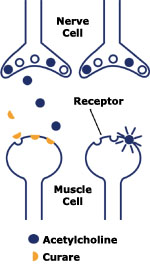
· Les anticholinestérasiques n’entrent pas en compétition avec les récepteurs cholinergiques de la jonction neuromusculaire, mais agissent en inhibant l’acétylcholinestérase et en produisant une augmentation de la quantité d’acétylcholine disponible au sein de la jonction neuromusculaire.
· La vitesse et la qualité de l’antagonisation de la curarisation dépendent essentiellement du moment de l’antagonisation, du curare en cause et de la posologie.
· L’utilisation des anticholinestérasiques est fortement recommandée si la décurarisation complète ne peut être affirmée. La posologie de néostigmine est de 40 à 50 g · kg -1 toujours en association avec l’atropine (15-20 g · kg -1).
· Les indications de la naloxone au décours d’une anesthésie sont rares et représentées presque exclusivement par la dépression respiratoire liée à un surdosage en morphiniques.
· La titration doit être systématique et la surveillance après l’antagonisation prolongée, en raison de la courte durée d’action de la naloxone par rapport à celle des agonistes.
· La naloxone expose, lors de l’antagonisation, à des accidents rares mais graves à type de troubles du rythme ou d’œdème aigu pulmonaire y compris chez des patients sans aucun antécédent cardiovasculaire.
· Le flumazénil n’entraîne qu’une disparition transitoire des effets cliniques des benzodiazépines, y compris lors de l’utilisation de midazolam.
· La posologie initiale de flumazénil est de 0,1 à 0,2 mg, renouvelé toutes les 1 à 2 minutes jusqu’à obtention de l’effet clinique désiré. L’administration prolongée peut être nécessaire avec les benzodiazépines de durée d’action longue.
· La surveillance clinique, après utilisation de flumazénil, doit être prolongée en salle de surveillance postinterventionnelle, même en cas de disparition de la sédation. L’utilisation de flumazénil ne raccourcit pas la durée de séjour des patients en ambulatoire.
La dépression respiratoire reste une des principales causes de morbidité et de mortalité liées à l’anesthésie. En 1983, une enquête sur la mortalité anesthésique en Angleterre notait que 11 des 32 décès liés à l’anesthésie étaient dus en partie au moins à une dépression respiratoire postopératoire [1]. L’enquête française de 1986 sur les complications liées à l’anesthésie montrait que la moitié des 65 décès était également liée à la survenue d’une dépression respiratoire postopératoire [2]. D’autres études ont confirmé ultérieurement ces observations. De nouvelle molécules sont apparues dans les différentes classes pharmacologiques (curares, morphiniques, benzodiazépines) entraînant moins d’accumulation que leurs prédécesseurs. Malgré cela, il n’existe pas d’agents anesthésiques dont la disparition des effets soit suffisamment rapide et prédictible pour mettre à l’abri d’une dépression respiratoire ou d’une sédation prolongée dans la période postopératoire. Un risque de surdosage n’est pas impossible en anesthésie, de même qu’une modification impromptue de la durée prévue de l’acte chirurgical. La pharmacologie et les règles d’utilisation respectives des différents antagonistes doivent être connus de tout anesthésiste, leur utilisation devant permettre une augmentation de la sécurité en anesthésie.
ANTICHOLINESTÉRASIQUES
Les anticholinestérasiques ne sont pas de véritables antagonistes des curares dans le sens où ils n’entrent pas en compétition avec les curares au niveau des récepteurs spécifiques de la jonction neuromusculaire. Ils agissent de manière indirecte en inhibant l’acétylcholinestérase, d’où l’augmentation de la concentration de l’acétylcholine au niveau de la fente synaptique et le déplacement secondaire des molécules de curare fixées au niveau des récepteurs spécifiques par la loi d’action de masse.
- Pharmacologie
La néostigmine, la pyridostigmine et l’édrophonium agissent en inhibant l’acétylcholinestérase présente au niveau de la fente synaptique. La néostigmine et la pyridostigmine entraînent la carbamylation de l’acétylcholinestérase, contrairement à l’édrophonium qui se lie de façon compétitive et réversible [3] [4]. La demi-vie de l’acétylcholinestérase transformée par la néostigmine ou la pyridostigmine est de 15 à 30 minutes. L’édrophonium, au contraire, se fixe sur l’acétylcholinestérase par attraction électrostatique, ce qui n’entraîne pas de modifications de sa structure. L’inhibition de l’acétylcholinestérase entraîne une augmentation des quantités et du temps de présence de l’acétylcholine au niveau de la fente synaptique, d’où une augmentation des potentiels de plaque [4]. Les anticholinestérasiques peuvent aussi agir au niveau présynaptique ou directement sur certains canaux ioniques, mais ces actions semblent ne pas avoir de conséquences cliniques. Ils possèdent un effet plafond, à partir d’une certaine dose, l’augmentation de dose n’entraîne pas d’antagonisation plus importante du bloc neuromusculaire. L’édrophonium, contrairement à la néostigmine et à la pyridostigmine, se fixe sélectivement à l’acétylcholinestérase et n’inhibe pas la butyrilcholinestérase impliquée dans la dégradation de la succinylcholine et du mivacurium [5].
Les caractéristiques pharmacocinétiques des trois anticholinestérasiques diffèrent peu avec un volume de distribution très supérieur à celui du compartiment hydrique extracellullaire compris entre 0,7 et 1,4 L · kg -1 et une demi-vie d’élimination comprise entre 70 et 120 min. Ils sont éliminés par le rein avec une sécrétion tubulaire active. En cas d’insuffisance rénale, leur clairance est diminuée d’où l’allongement de la demi-vie d’élimination [6] [7].
C’est l’édrophonium qui a la durée d’installation la plus rapide (1 à 2 minutes) alors que la néostigmine a un effet maximal en 7 à 11 minutes et la pyridostigmine en 15 à 20 minutes. Leur durée d’action est comprise entre 1 et 2 heures. Leur durée d’action explique pourquoi il n’existe pas de risque de recurarisation si les anticholinestérasiques sont administrés après que la décurarisation ait débutée. La néostigmine est environ six fois plus puissante que la pyridostigmine et 15 fois plus puissante que l’édrophonium [8] [9].
Les anticholinestérasiques ont des effets vagaux marqués. Une bradycardie, une bradyarythmie voire des extrasystoles ventriculaires peuvent apparaître en cas d’utilisation isolée, d’où le principe de l’administration systématique d’un agent antimuscarinique tel l’atropine ou le glycopyrrolate lors de leur utilisation [10]. Le glycopyrrolate a comme avantage par rapport à l’atropine d’avoir un délai d’action plus long (2-3 minutes) d’où une tachycardie de moindre intensité, mais il n’est malheureusement pas disponible en France. Les anticholinestérasiques entraînent une salivation, ils ont peu d’effets sur le péristaltisme. Il n’a jamais pu être démontré que la néostigmine augmentait la fréquence des fistules digestives après anastomose. De même, certaines études récentes ont clairement montré qu’elle n’augmentait pas la fréquence des nausées et vomissements postopératoires [11] [12]. L’augmentation de résistance des voies aériennes liée aux anticholinestérasiques reste très limitée, en raison de l’administration concomitante d’atropine ou de glycopyrrolate [13]. Les anticholinestérasiques n’agissent pas sur les récepteurs nicotiniques présents dans le système nerveux central, car ils ne traversent pas la barrière hémato-encéphalique.
- Facteurs affectant la décurarisation
Quel que soit l’agent considéré, plusieurs facteurs peuvent affecter la rapidité et la qualité de l’antagonisation de la curarisation. Un des facteurs les plus importants est l’intensité du bloc neuromusculaire lors de l’antagonisation [14] [15]. Plus le bloc est intense au moment choisi pour l’antagonisation, plus la récupération sera lente. Ainsi l’administration de néostigmine en tout début de décurarisation spontanée plutôt qu’après récupération d’au moins 10 % de la force musculaire, soit environ deux réponses au train de quatre, n’entraîne pas de raccourcissement du temps nécessaire à une décurarisation complète. De plus, en cas de bloc profond, la néostigmine est plus efficace que l’édrophonium [8]. Ce fait s’expliquerait par une liaison de plus faible affinité entre l’édrophonium et l’acétylcholinestérase.
L’augmentation de la dose d’anticholinestérasiques pour accélérer la décurarisation est peu efficace à partir d’un certain niveau, en raison d’un effet plafond. Une dose de néostigmine supérieure à 60 g · kg -1 peut même être à l’origine d’une antagonisation de moindre qualité [14].
La rapidité de l’antagonisation dépend également du curare employé. La vitesse de décurarisation est en effet la résultante de l’action de l’anticholinestérasique et de la décurarisation spontanée dépendante du curare. Quel que soit l’antagoniste utilisé, la décurarisation sera plus rapide lors d’un bloc lié à un curare de durée d’action intermédiaire (atracurium, cisatracurium, rocuronium, vécuronium) que lors d’un bloc dû au pancuronium.
La décurarisation est plus rapide chez l’enfant ou le nourrisson que chez l’adulte et les doses de néostigmine nécessaires sont inférieures à celles employées chez l’adulte [16]. Il n’y a que peu de différence de la vitesse de décurarisation chez le vieillard par rapport à l’adulte en cas d’antagonisation. Les agents halogénés ainsi que certains médicaments (lidocaïne, vérapamil) peuvent potentialiser la curarisation, mais il n’y a pas d’étude ayant pu montrer qu’ils pouvaient perturber la décurarisation après administration d’anticholinestérasiques.
- Indications
Les indications de la décurarisation sont très larges. Il a été clairement montré que la fréquence de curarisation résiduelle en salle de surveillance postinterventionnelle (SSPI) pouvait toucher plus de 40 % des patients, même après utilisation de curares de durée d’action intermédiaire [17]. La curarisation résiduelle peut contribuer à l’apparition d’une dépression respiratoire postopératoire. De plus une décurarisation incomplète expose à des troubles de la déglutition [18] ou à des anomalies de la réponse ventilatoire à l’hypoxie [19]. Un rapport T4/T1 inférieur à 70 % en SSPI expose à une augmentation de fréquence des complications pulmonaires postopératoires [20]. L’antagonisation doit être d’autant plus large que les signes cliniques sont trompeurs. Ainsi, un volume courant ou une ventilation minute ne sont en aucun cas des garants de l’absence de curarisation résiduelle, car les muscles impliqués dans la déglutition et la perméabilité des voies aériennes supérieures sont très sensibles aux effets des curares non dépolarisants et peuvent être encore partiellement curarisés. L’insuffisance des tests cliniques justifie l’emploi quasi systématique du monitorage instrumental en SSPI [10] [21]. L’estimation visuelle ou tactile d’une fatigue à l’adducteur du pouce après train de quatre peut être trompeuse, car il n’est pas possible, même pour un observateur entraîné, de détecter cette fatigue dès que le rapport T4/T1 atteint 40 %. Le double burst stimulation (DBS) est plus sensible car il permet de détecter une fatigue musculaire jusqu’à l’équivalent d’un rapport T4/T1 à 60 %. Le test de référence reste la mesure du rapport T4/T1 qui doit atteindre 90 % pour que le patient soit considéré comme complètement décurarisé.
L’antagonisation de la curarisation est recommandée si la décurarisation complète ne peut être affirmée. La posologie recommandée de néostigmine (Prostigmine®) chez l’adulte est de 40 à 50 g · kg -1. L’administration de 15 à 20 g · kg -1 de néostigmine doit être systématiquement associée à celle d’atropine. Ni l’édrophonium, ni le glycopyrrolate ne sont disponibles en France. La néostigmine ne doit être administrée qu’après le début de la décurarisation spontanée. Avec les curares de durée d’action intermédiaire, l’antagonisation peut avoir lieu dès la réapparition de la deuxième réponse au train de quatre ou en cas de reprise ventilatoire. Avec le pancuronium, la néostigmine ne sera administrée qu’après réapparition de la quatrième réponse au train de quatre. Chez l’enfant la posologie recommandée est de 30 à 40 g · kg -1. L’insuffisance rénale n’est pas une contre-indication à l’utilisation de néostigmine en raison de l’allongement de sa demi-vie d’élimination et donc de la durée d’action prolongée [22].
L’utilisation des anticholinestérasiques est contre-indiqué en cas de curarisation profonde, d’insuffisance cardiaque sévère ou d’angor instable en raison de tachycardie liée à l’atropine. La prudence est recommandée en cas d’asthme sévère ainsi que chez les patients traités par certains inhibiteurs calciques du type vérapamil. Dans ces situations c’est la surveillance prolongée du patient qui reste l’élément le plus important.
ANTAGONISTES DES MORPHINOMIMÉTIQUES
- Bases pharmacologiques
La naloxone reste l’antagoniste de référence. Très liposoluble, elle possède une forte affinité pour les récepteurs , plus faible pour les récepteurs et . Cette différence d’affinité selon les récepteurs explique pourquoi les doses de naloxone nécessaires pour antagoniser les effets agonistes sont dépendantes du type d’effet. Les doses seront plus élevées avec les agonistes-antagonistes qu’avec les agonistes purs. Son administration supprime les effets pharmacologiques usuels des morphinomimétiques, c’est-à-dire : l’analgésie, la dépression respiratoire, le prurit, le myosis ou les effets cardiovasculaires. Il faut noter que la naloxone est dépourvue d’effets cardiovasculaires propres. La stimulation observée lors des états de choc est liée à l’inhibition des bêta-endorphines circulantes produites par les endotoxines [23]. L’administration de naloxone au décours de celle d’un morphinomimétique entraîne un phénomène de rebond. En cas de stimulation nociceptive, la naloxone sera responsable d’un état d’hyperalgésie plus intense que celui qui existait avant l’administration d’agoniste [24]. La naloxone peut également avoir un effet antagoniste en dehors de toute administration de morphinomimétique dans certaines situations responsables de la production d’endorphines (acupuncture, stimulation électrique à basse fréquence).
La naloxone a un effet maximal en deux minutes après administration intraveineuse. Sa durée d’action est brève, de l’ordre de 45 minutes chez l’adulte lors de l’administration d’un bolus de 0,4 mg. La durée d’action est proche de deux heures après administration de 0,4 mg par voie intramusculaire. Cette brève durée d’action s’explique par une demi-vie d’élimination courte de l’ordre de 60 minutes. En raison d’une forte diffusion tissulaire, les concentrations cérébrales peuvent être 10 à 15 fois plus importantes que celles de la morphine.
La naltrexone et le nalmefène sont également des antagonistes opioïdes de type compétitif [25]. Leur structure est proche de celle de la naloxone. Leurs propriétés pharmacologiques sont comparables à celle de la naloxone, mais leur durée d’action est prolongée en raison d’une clairance plasmatique plus faible d’où une demi-vie d’élimination proche de huit heures. De plus la naltrexone est bien absorbée par voie orale, car l’effet de premier passage hépatique est beaucoup plus faible qu’avec la naloxone. Son aptitude à déplacer des ligands endogènes est 2 à 6 fois plus élevée que celle de la naloxone.
- Effets antagonistes
De faibles doses de naloxone (0,1 à 0,4 mg) administrées par voie intraveineuse ou intramusculaire sont suffisantes pour antagoniser les effets des morphinomimétiques utilisés lors de l’anesthésie. L’antagonisation entraîne une diminution de l’analgésie, une levée de la dépression respiratoire, une inhibition des effets bradycardisants et une disparition du myosis. Malheureusement, l’antagonisation entraîne souvent un réveil brutal avec douleurs, phénomènes d’agitation, tachycardie voire hypertension artérielle. Les effets hémodynamiques sont liés à l’augmentation des résistances artérielles systémiques et du débit cardiaque. Il en résulte une augmentation de la consommation d’oxygène myocardique. Ces effets hémodynamiques semblent plus marqués en cas d’hypercapnie ou d’hypoxie lors de l’administration de naloxone [26]. Il a été décrit, y compris chez des patients sans antécédents, des cas de fibrillation ventriculaire ou d’œdème aigu du poumon après administration de naloxone même à faible dose (0,1 mg) [27] [28]. La libération de catécholamines suite à la levée brutale de l’analgésie a été mise en cause. Elle serait responsable d’une vasoconstriction veineuse pulmonaire, voire d’une augmentation de la perméabilité vasculaire pulmonaire. En cas d’hypothermie, la consommation d’oxygène et la ventilation minute peuvent être multipliées par deux à trois d’où la prudence en cas d’antagonisation chez l’insuffisant cardiaque ou coronarien [29].
Certains auteurs ont proposé la prise en charge du sevrage des toxicomanes par l’administration de fortes doses d’antagonistes des récepteurs [30]. Après induction d’une anesthésie générale, les patients reçoivent de fortes doses de naloxone toutes les 15 minutes, la dose totale étant d’environ 12 mg. Le relais est ensuite pris par une perfusion de 0,8 mg · h -1 de naloxone pendant 24 heures puis par l’administration de naltrexone per os [31]. Cette technique est connue sous le nom de ultrarapid opioid detoxification. Elle entraîne une multiplication par 30 des concentrations plasmatiques d’adrénaline et par trois de noradrénaline ainsi que des modifications cardiovasculaires majeures liées à la sécrétion d’adrénaline [32]. Cette méthode, proposée aux États-Unis pour raccourcir la durée du syndrome de sevrage et d’hospitalisation, semble discutable, d’autant qu’il n’y a jamais eu d’études comparatives et randomisées par rapport aux protocoles de référence. Des morts subites ont été décrites au cours de cette technique et les résultats ne semblent pas supérieures à ceux obtenus avec les techniques conventionnelles de sevrage [33].
- Indications
La principale indication de la naloxone (Narcan®) reste l’antagonisation de la dépression respiratoire postopératoire induite par les morphiniques. Les risques liés à la disparition brutale de l’analgésie et à l’hypertension artérielle imposent de titrer la dose de naloxone. L’ampoule de 0,4 mg doit être diluée dans une seringue de 10 mL chez l’adulte et administrée par titration. Une dose de 0,5 à 1 g · kg -1 administrée toutes les 2 à 3 minutes est suffisante pour faire réapparaître une ventilation spontanée efficace (fréquence respiratoire supérieure à 12 par minute et FECO2 inférieure à 7 %). L’hypercapnie ou l’hypoxie doivent être traitées par une oxygénation et une ventilation assistée adéquate avant d’administrer la naloxone, afin d’éviter les effets délétères cardiovasculaires. En cas de curarisation résiduelle participant à la dépression respiratoire postopératoire, la décurarisation par les anticholinestérasiques doit précéder l’administration de naloxone. Il existe un risque de « remorphinisation », en particulier une réapparition de la dépression respiratoire, en raison de la courte demi-vie d’élimination et de la faible durée d’action de la naloxone par rapport à celle des morphiniques utilisée en anesthésie. Ce risque est plus important avec des morphinomimétiques de durée d’action prolongée comme le fentanyl ou en cas d’accumulation liée à une administration prolongée. Il est donc indispensable, après administration de la dose initiale, de prendre le relais par une autre dose identique à celle utilisée en titration, mais administrée par voie intramusculaire ou par perfusion intraveineuse à la dose moyenne de 0,2 mg · h -1. La surveillance en SSPI devra être prolongée.
La naloxone est contre-indiquée chez l’insuffisant cardiaque, coronarien ou le patient hypertendu, en raison de ses effets cardiovasculaires.
La naloxone peut être utilisé en cas d’effets secondaires liés à l’administration de morphiniques par voie intrathécale ou péridurale. En cas de dépression respiratoire ou de prurit, la dose intraveineuse recommandée est de 0,2 mg, éventuellement répétée jusqu’à disparition des signes, le relais doit ensuite être pris par une perfusion à la dose de 0,2 mg · h -1 pendant 6 à 12 heures. La posologie en cas de rétention urinaire est de 0,4 mg intraveineux. La levée des effets secondaires s’accompagne d’une diminution ou d’une disparition de l’analgésie [34].
Une autre indication de la naloxone est l’antagonisation de la morphine en cas de surdosage lors d’une analgésie contrôlée par le patient (ACP). Cette indication reste rare car les surdosages en morphine sont peu fréquents en cas de respect des règles d’utilisation de l’ACP et d’une titration initiale. La naloxone est indiquée en cas de fréquence respiratoire inférieure à 10 où d’échelle de sédation supérieure à 2. La surveillance après l’administration de naloxone doit être prolongée en raison de la durée d’action de la morphine. Le prurit ou la rétention d’urines peuvent être combattus par de faibles doses de naloxone (40 g).
La naloxone est indiquée en salle de travail chez le nouveau-né en cas de dépression respiratoire liée à l’administration de morphiniques lors du travail. La posologie est de 10 g · kg -1 en intraveineux ou intramusculaire, le relais sera pris par l’administration de 10 g · kg -1 intramusculaire. Il devra s’accompagner d’une surveillance prolongée en milieu spécialisé.
Certains auteurs ont proposé d’utiliser la naltrexone à la dose de 6 à 9 mg pour diminuer le prurit induit par les morphiniques administrés par voie péridurale. Cette indication semble discutable car l’analgésie peut disparaître lors de l’antagonisation du prurit. De plus les effets secondaires de la naltrexone (nausées, vomissements, céphalées) semblent limiter son utilisation. La naltrexone (Nalorex®, Revia®) est également utilisée pour le sevrage des toxicomanes ou des patients alcooliques. Plusieurs observations semblent démontrer la nécessiter d’augmenter les doses peropératoires de morphiniques en cas de prise chronique [35].
Le nalméfène aurait pour principal intérêt une durée d’action plus longue qui mettrait à l’abri de la réapparition de la dépression respiratoire observée avec la naloxone, mais il n’est pas commercialisé en France. Certains auteurs ont proposé son utilisation en cas de dépression respiratoire induite par les morphiniques administrés par voie rachidienne. Il a été également proposé pour lutter contre les nausées ou le prurit au cours de l’ACP avec de la morphine [36].
Au total, la plus grande prudence s’impose lors de l’utilisation de naloxone en raison du risque de survenue d’accidents cardiovasculaires rares mais graves, y compris chez des patients sans antécédents. Sa place est d’autant plus limitée en anesthésie que les morphiniques dont on dispose actuellement (sufentanil, rémifentanil) s’accumulent moins que leur prédécesseurs. La surveillance en SSPI devra être prolongée en raison du risque de réapparition d’une dépression respiratoire.
FLUMAZÉNIL
- Pharmacologie
Le flumazénil (Anexate®) est une imidazo-benzodiazépine qui antagonise les effets des benzodiazépines en se liant de façon spécifique et réversible aux récepteurs des benzodiazépines. Contrairement aux agonistes, sa fixation n’entraîne pas de modification allostérique du récepteur, son activité intrinsèque est faible. Son effet agoniste propre semble faible, voire absent. Il antagonise l’ensemble des effets des benzodiazépines sur la sédation, l’amnésie et les fonctions cognitives. Bien que discuté par certains, le flumazénil antagonise également les effets dépresseurs respiratoires des benzodiazépines [37]. Contrairement à ce qui se passe lors de l’utilisation de naloxone après les morphiniques, le flumazénil antagonise partiellement ou totalement les effets des benzodiazépines en fonction des doses administrées. Ainsi, à petites doses, il antagonise l’éventuelle dépression respiratoire induite par les benzodiazépines, alors qu’avec des doses plus fortes, il supprime les autres effets dont la somnolence et l’amnésie. Le flumazénil n’a pas d’effet hémodynamique propre, il ne modifie pas la fonction ventriculaire ou la consommation myocardique d’oxygène. Il n’y a pas, lors de l’antagonisation des benzodiazépines par le flumazénil, d’effets hémodynamiques délétères comme lors de l’antagonisation des morphiniques par la naloxone par sécrétion de catécholamines. Le flumazénil peut être à l’origine de crises convulsives en antagonisant l’effet anticonvulsivant des benzodiazépines, cette situation se rencontre chez des patients épileptiques traités par les benzodiazépines ou en cas d’intoxication médicamenteuse par une association benzodiazépine-antidépresseur tricyclique ou la prise d’inhibiteurs de la monoamine oxydase, de lithium ou de cocaïne [38]. La survenue de convulsions semble être indépendante de la dose administrée (0,2 à 10 mg). Des nausées, vomissements ou des tremblements ont été rapportés après utilisation de flumazénil ainsi que des phénomènes d’agitation chez l’enfant [39].
Le flumazénil est métabolisé dans le foie en métabolites inactifs. Sa biodisponibilité per os est faible en raison d’un effet de premier passage hépatique important. Sa demi-vie d’élimination est courte de l’ordre d’une heure, elle est inférieure à celle des autres benzodiazépines utilisées en anesthésie y compris le midazolam (1,7-2,6 heures). Il diffuse facilement et rapidement à travers la barrière hématoencéphalique [40]. Ses propriétés pharmacocinétiques expliquent la rapidité d’action mais aussi la durée d’action courte du flumazénil. Le pic d’effet, concernant en particulier le réveil, est observé 1 à 3 minutes après son administration chez l’adulte. L’orientation temporo-spatiale est obtenue 4 à 5 minutes après son administration [41]. Son action dépend de la loi d’action de masse et sa durée d’action est dépendante de la dose administrée, mais aussi de l’agoniste et de la dose utilisée. Certaines études ont pu démontrer que l’antagonisation de la dépression respiratoire, induite par le midazolam, pouvait aller de 3 à 30 minutes. Il a été montré que la levée de la sédation liée au midazolam survenait dans les cinq minutes qui suivent l’administration d’une dose moyenne de 0,8 mg de flumazénil, mais que la durée d’action était inférieure à deux heures [42].
- Indications
Les indications du flumazénil en anesthésie restent très limitées. Il est parfois utilisé pour antagoniser les effets sédatifs résiduels des benzodiazépines administrées lors d’une anesthésie générale ou d’une sédation. En cas d’anesthésie générale, la somnolence postopératoire est plus liée à l’accumulation des agents anesthésiques ou de l’association agents anesthésiques-morphiniques. La courte durée d’action du flumazénil peut être à l’origine de réendormissements avec leurs conséquences si le patient n’est pas surveillé correctement en SSPI. Seul le midazolam semble pouvoir être antagonisé par le flumazénil, le flunitrazépam ou le diazépam ayant des durées d’action et des demi-vies d’élimination beaucoup trop importantes par rapport à celles du flumazénil. Si l’administration de flumazénil permet de réveiller le patient, elle ne permet pas de raccourcir la durée de séjour en SSPI.
Certains auteurs ont proposé son utilisation en anesthésie ambulatoire en particulier au décours des endoscopies digestives. Cette technique est surtout employée par les équipes réalisant elles-mêmes la sédation au cours de ces endoscopies. Il a été démontré que l’antagonisation, si elle permettait une levée transitoire de la sédation, ne mettait pas à l’abri du réendormissement ultérieur des patients. Des cas ont été publiés avec réendormissement dans les 30 minutes suivant l’antagonisation d’une sédation induite par le midazolam [43].
L’utilisation de flumazénil a été suggérée chez des patients ayant eu une anesthésie locorégionale avec sédation de complément par du midazolam. Cette indication est rare si le midazolam a été titré pendant l’anesthésie locorégionale. De plus la durée de séjour en SSPI ne doit pas être raccourcie pour des raisons déjà exposées. Il a également été proposé pour l’épreuve de réveil peropératoire lors de la chirurgie de la scoliose [44]. Cette indication peut sembler discutable car d’autres agents anesthésiques (propofol, sévoflurane, desflurane) s’accumulant peu dans l’organisme peuvent être facilement employés lors de ce type de chirurgie.
La posologie recommandée de flumazénil est de 0,1 à 0,2 mg répété toutes les 1 à 2 minutes jusqu’à l’antagonisation de la sédation. La dose à utiliser est dépendante de l’importance de la sédation et de la durée d’action de la benzodiazépine en cause. De toute façon la surveillance doit être prolongée avec administration de bolus supplémentaires voire utilisation d’une perfusion continue (0,1 à 0,8 mg · h -1) en cas de réapparition de la sédation. La titration se fait presque exclusivement sur des signes cliniques.
Nous ne reviendrons pas sur l’utilisation de flumazénil en dehors de l’anesthésie, en médecine préhospitalière ou aux urgences dans un but diagnostique devant un coma ou en cas d’intoxication médicamenteuse volontaire aux benzodiazépines.
Le flumazénil présente de rares contre-indications. Il ne doit pas être employé au décours d’une anesthésie à la kétamine, en raison du risque d’apparition d’une agitation. Il est contre-indiqué chez les patients traités de façon chronique par les benzodiazépines en raison d’un risque d’apparition d’un syndrome de sevrage.
CONCLUSION
Seul le recours à l’antagonisation de la curarisation en fin d’intervention doit être d’indications larges. L’utilisation de la néostigmine doit être guidée par les informations tirées du monitorage de la curarisation. En revanche, les indications d’utilisation de la naloxone ou du flumazénil sont rares en raison de la courte durée de l’antagonisation pour ces deux molécules et du risque d’accidents rares, mais graves lors de l’administration de naloxone.
RÉFÉRENCES
1 Lunn JN, Hunter AR, Scott DB. Anaesthesia-related surgical mortality. Anaesthesia 1983 ; 38 : 1090-6.
2 Tiret L, Desmonts JM, Hatton F, Vourc’h G. Complications associated with anaesthesia - a prospective survey in France. Can Anaesth Soc J 1986 ; 33 : 336-44.
3 Fiekers JF. Interactions of edrophonium, physostigmine and methanesulfonyl fluoride with the snake end-plate acetylcholine receptor-channel complex. J Pharmacol Exp Ther 1985 ; 234 : 539-49.
4 Fiekers JF. Concentration-dependent effects of neostigmine on the endplate acetylcholine receptor channel complex. J Neurosci 1985 ; 5 : 502-14.
5 Hart PS, Wright PM, Brown R, Lau M, Sharma ML, Miller RD, et al. Edrophonium increases mivacurium concentrations during constant mivacurium infusion, and large doses minimally antagonize paralysis. Anesthesiology 1995 ; 82 : 912-8.
6 Cronnelly R, Stanski DR, Miller RD, Sheiner LB, Sohn YJ. Renal function and the pharmacokinetics of neostigmine in anesthetized man. Anesthesiology 1979 ; 51 : 222-6.
7 Morris RB, Cronnelly R, Miller RD, Stanski DR, Fahey MR. Pharmacokinetics of edrophonium in anephric and renal transplant patients. Br J Anaesth 1981 ; 53 : 1311-4.
8 Donati F, Smith CE, Bevan DR. Dose-response relationships for edrophonium and neostigmine as antagonists of moderate and profound atracurium blockade. Anesth Analg 1989 ; 68 : 13-9.
9 Donati F, McCarroll SM, Antzaka C, McCready D, Bevan DR. Dose-response curves for edrophonium, neostigmine, and pyridostigmine after pancuronium and d-tubocurarine. Anesthesiology 1987 ; 66 : 471-6.
10 Bevan DR, Donati F, Kopman AF. Reversal of neuromuscular blockade. Anesthesiology 1992 ; 77 : 785-805.
11 Hovorka J, Korttila K, Nelskyla K, Soikkeli A, Sarvela J, Paatero H, et al. Reversal of neuromuscular blockade with neostigmine has no effect on the incidence or severity of postoperative nausea and vomiting. Anesth Analg 1997 ; 85 : 1359-61.
12 Boeke AJ, de Lange JJ, van Druenen B, Langemeijer JJ. Effect of antagonizing residual neuromuscular block by neostigmine and atropine on postoperative vomiting. Br J Anaesth 1994 ; 72 : 654-6.
13 Bourgain JL, Debaene B, Meistelman C, Donati F. Respiratory mechanics in anaesthetised patients after neostigmine-atropine. A comparison between patients with and without chronic obstructive pulmonary disease. Acta Anaesthesiol Scand 1993 ; 37 : 365-9.
14 Baurain MJ, Dernovoi BS, d’Hollander AA, Hennart DA, Cantraine FR. Conditions to optimise the reversal action of neostigmine upon a vecuronium-induced neuromuscular block. Acta Anaesthesiol Scand 1996 ; 40 : 574-8.
15 Meistelman C, Debaene B, d’Hollander A, Donati F, Saint-Maurice C. Importance of the level of paralysis recovery for a rapid antagonism of vecuronium with neostigmine in children during halothane anesthesia. Anesthesiology 1988 ; 69 : 97-9.
16 Debaene B, Meistelman C, d’Hollander A. Recovery from vecuronium neuromuscular blockade following neostigmine administration in infants, children, and adults during halothane anesthesia. Anesthesiology 1989 ; 71 : 840-4.
17 Baillard C, Gehan G, Reboul-Marty J, Larmignat P, Samama CM, Cupa M. Residual curarization in the recovery room after vecuronium. Br J Anaesth 2000 ; 84 : 394-5.
18 Eriksson LI, Sundman E, Olsson R, Nilsson L, Witt H, Ekberg O, et al. Functional assessment of the pharynx at rest and during swallowing in partially paralyzed humans : simultaneous videomanometry and mechanomyography of awake human volunteers. Anesthesiology 1997 ; 87 : 1035-43.
19 Eriksson LI, Sato M, Severinghaus JW. Effect of a vecuronium-induced partial neuromuscular block on hypoxic ventilatory response. Anesthesiology 1993 ; 78 : 693-9.
20 Berg H, Viby-Mogensen J, Roed J, Mortensen CR, Engbaek J, Skovgaard LT, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand 1997 ; 41 : 1095-103.
21 Baurain MJ, Hennart DA, Godschalx A, Huybrechts I, Nasrallah G, d’Hollander AA, et al. Visual evaluation of residual curarization in anesthetized patients using one hundred-hertz, five-second tetanic stimulation at the adductor pollicis muscle. Anesth Analg 1998 ; 87 : 185-9.
22 Bevan DR, Archer D, Donati F, Ferguson A, Higgs BD. Antagonism of pancuronium in renal failure : no recurarization. Br J Anaesth 1982 ; 54 : 63-8.
23 Sandor P, de Jong W, Wiegant V, de Wied D. Central opioid mechanisms and cardiovascular control in hemorrhagic hypotension. Am J Physiol 1987 ; 253 : H507-11
24 Devillers JP, Boisserie F, Laulin JP, Larcher A, Simonnet G. Simultaneous activation of spinal antiopioid system (neuropeptide FF) and pain facilitatory circuitry by stimulation of opioid receptors in rats. Brain Res 1995 ; 700 : 173-81.
25 Glass PS, Jhaveri RM, Smith LR. Comparison of potency and duration of action of nalmefene and naloxone. Anesth Analg 1994 ; 78 : 536-41.
26 Mills CA, Flacke JW, Miller JD, Davis LJ, Bloor BC, Flacke WE. Cardiovascular effects of fentanyl reversal by naloxone at varying arterial carbon dioxide tensions in dogs. Anesth Analg 1988 ; 67 : 730-6.
27 Partridge BL, Ward CF. Pulmonary edema following low-dose naloxone administration. Anesthesiology 1986 ; 65 : 709-10.
28 Prough DS, Johnston WE. Some questions concerning the effects of hydralazine on cardiopulmonary function in canine low-pressure pulmonary edema. Anesthesiology 1984 ; 60 : 518-9.
29 Just B, Delva E, Camus Y, Lienhart A. Oxygen uptake during recovery following naloxone. Relationship with intraoperative heat loss. Anesthesiology 1992 ; 76 : 60-4.
30 Lorenzi P, Marsili M, Boncinelli S, Fabbri LP, Fontanari P, Zorn AM, et al. Searching for a general anaesthesia protocol for rapid detoxification from opioids. Eur J Anaesthesiol 1999 ; 16 : 719-27.
31 Gold CG, Cullen DJ, Gonzales S, Houtmeyers D, Dwyer MJ. Rapid opioid detoxification during general anesthesia : a review of 20 patients. Anesthesiology 1999 ; 91 : 1639-47.
32 Kienbaum P, Thurauf N, Michel MC, Scherbaum N, Gastpar M, Peters J. Profound increase in epinephrine concentration in plasma and cardiovascular stimulation after mu-opioid receptor blockade in opioid-addicted patients during barbiturate-induced anesthesia for acute detoxification. Anesthesiology 1998 ; 88 : 1154-61.
33 O’Connor PG, Kosten TR. Rapid and ultrarapid opioid detoxification techniques. JAMA 1998 ; 279 : 229-34.
34 Gueneron JP, Ecoffey C, Carli P, Benhamou D, Gross JB. Effect of naloxone infusion on analgesia and respiratory depression after epidural fentanyl. Anesth Analg 1988 ; 67 ; 35-8.
35 Tesson B, Bigot-Viale A, Vigue JP, Pierrot M, Granry JC. Interférences entre la naltrexone, un antagoniste des morphiniques, et les morphiniques administrés pendant une anesthésie générale. Ann Fr Anesth Réanim 1999 ; 18 : 230-2.
36 Joshi GP, Duffy L, Chehade J, Wesevich J, Gajraj N, Johnson ER. Effects of prophylactic nalmefene on the incidence of morphine-related side effects in patients receiving intravenous patient-controlled analgesia. Anesthesiology 1999 ; 90 : 1007-11.
37 Blouin RT, Conard PF, Perreault S, Gross JB. The effect of flumazenil on midazolam-induced depression of the ventilatory response to hypoxia during isohypercarbia. Anesthesiology 1993 ; 78 : 635-41.
38 Spivey WH. Flumazenil and seizures : analysis of 43 cases. Clin Ther 1992 ; 14 : 292-305.
39 Massanari M, Novitsky J, Reinstein LJ. Paradoxical reactions in children associated with midazolam use during endoscopy. Clin Pediatr (Phila.) 1997 ; 36 : 681-4.
40 Samson Y, Hantraye P, Baron JC, Soussaline F, Comar D, Maziere M. Kinetics and displacement of [11C]RO 15-1788, a benzodiazepine antagonist, studied in human brain in vivo by positron tomography. Eur J Pharmacol 1985 ; 110 : 247-51.
41 Sage DJ, Close A, Boas RA. Reversal of midazolam sedation with anexate. Br J Anaesth 1987 ; 59 : 459-64.
42 Philip BK, Simpson TH, Hauch MA, Mallampati SR. Flumazenil reverses sedation after midazolam-induced general anesthesia in ambulatory surgery patients. Anesth Analg 1990 ; 71 : 371-6.
43 Rodrigo MR, Chan L, Hui E. Flumazenil reversal of conscious sedation for minor oral surgery. Anaesth Intensive Care 1992 ; 20 : 174-6.
44 Koscielniak-Nielsen ZJ, Stens-Pedersen HL, Hesselbjerg L. Midazolam-flumazenil versus propofol anaesthesia for scoliosis surgery with wake-up tests. Acta Anaesthesiol Scand 1998 ; 42 : 111-6.
Pharmacologie des curares
Source EMC
-* Claude Meistelman : Professeur des Universités, praticien hospitalier
Chef du service d’anesthésie-réanimation chirurgicale des hôpitaux de Brabois, centre hospitalier universitaire de Nancy, rue du Morvan, 54500 Vandoeuvre France
- Bertrand Debaene : Médecin des centres anticancéreux, chef du service d’anesthésie
Institut Gustave Roussy, Villejuif France- François Donati : Professeur à l’université de Montréal, chef du département d’anesthésie
Montréal , Canada France– Résumé
Les curares bloquent la transmission neuromusculaire en se fixant sur les récepteurs cholinergiques postsynaptiques de la plaque motrice. Depuis l’apparition de la d-tubocurarine, de nombreuses molécules de synthèse sont apparues. Les curares non dépolarisants appartiennent à deux grandes catégories : les benzylisoquinolines dérivées de la d-tubocurarine et les curares stéroïdiens issus du pancuronium. Les effets secondaires des molécules apparues ces dernières années sont inférieurs à ceux de leurs prédécesseurs. En fonction de leur durée d’action clinique, on distingue : des curares ultracourts (moins de 8 minutes) : Org 9487, de courte durée d’action (8 à 20 minutes) : le mivacurium, de durée d’action intermédiaire (20 à 50 minutes) : atracurium, cisatracurium, vécuronium, rocuronium et des curares de longue durée d’action (plus de 50 minutes) : pancuronium. Le suxaméthonium reste le seul curare dépolarisant utilisé malgré ses effets secondaires car son profil pharmacodynamique reste inégalé. C’est le curare de choix en cas d’anesthésie du patient à l’estomac plein.
- Plan
- Introduction
- Curares non dépolarisants (+)
- Curares dépolarisants (+)
Introduction
Plus de quatre siècles se sont écoulés entre la découverte par Sir Walter Raleigh d’un poison dans lequel les Indiens d’Amérique du Sud trempaient leur flèche et l’utilisation, par Griffith et Johnson en 1942, d’intocostrin ou d-tubocurarine pour provoquer un relâchement musculaire lors d’une anesthésie générale. Dès 1943, Wintersteiner et Dutcher réussissaient à extraire des quantités suffisantes de d-tubocurarine à partir de chondodendron tomentosum pour débuter la commercialisation, ce qui a permis l’essor de l’anesthésie balancée. Depuis la d-tubocurarine, de nombreux curares sont apparus mais la majorité des molécules actuellement disponibles chez l’homme est obtenue par synthèse. La marge de sécurité des curares au cours de ces 50 dernières années s’est trouvée améliorée grâce à la synthèse de molécules présentant peu ou pas d’effets secondaires. L’emploi des curares reste limité à l’anesthésie-réanimation, la présence d’un matériel d’intubation et d’assistance ventilatoire étant indispensable avant toute administration.
Curares non dépolarisants
Propriétés générales
- Mode d’action
Les curares agissent essentiellement en se fixant sur les récepteurs cholinergiques nicotiniques de la jonction neuromusculaire.Récepteur cholinergique (fig 1)
Le récepteur nicotinique postsynaptique est constitué de cinq sous-unités protéiques arrangées en forme de rosette dont le centre devient perméable sous l’effet de l’agoniste approprié. Deux sous-unités α sont identiques mais séparées par une unité β, les deux autres sous-unités sont appelées δ et . Les récepteurs foetaux et extrajonctionnels possèdent une unité γ au lieu d’une unité . Chacune de ces sous-unités est une protéine dont les deux terminaisons se trouvent du côté extracellulaire de la membrane. Lorsque le récepteur est au repos, les domaines membranaires des cinq sous-unités se touchent de sorte que le récepteur ou canal est bouché. La partie extracellulaire a la forme d’un entonnoir et constitue à peu près la moitié du récepteur. Lorsque le récepteur est ouvert, la partie la plus étroite de l’entonnoir mesure 0,65 nm ce qui permet juste le passage des ions positifs comme le Na+ et le K+. Le poids moléculaire du récepteur est d’environ 250 kDa [151]. La densité des récepteurs cholinergiques au niveau de la plaque motrice est d’environ 10 000/μm2 au niveau des crêtes des replis. En revanche, la densité des récepteurs extrajonctionnels est faible (20/μm2) [198].La molécule d’acétylcholine a une affinité particulière pour les sous-unités α. Le récepteur ne devient activé que s’il y a deux molécules d’acétylcholine liées simultanément à chacune de ces deux sous-unités. Il en résulte un changement de conformation des protéines du récepteur qui va provoquer l’ouverture du centre de la rosette et le passage des ions. Le délai d’ouverture d’un canal est d’environ 10 μs pour une durée d’ouverture de 1 ms. Les ions Na+ sont en quantité beaucoup plus importante à l’extérieur, ils sont attirés vers l’intérieur de la cellule en raison d’une part du potentiel intracellulaire négatif, et d’autre part du gradient de concentration favorable. La sortie des ions K+ est freinée par le potentiel électrique négatif. L’entrée d’ions positifs entraîne une dépolarisation dont l’amplitude dépendra du nombre de récepteurs activés et donc du nombre de vésicules d’acétylcholine libérées lors de la stimulation nerveuse. Un quantum d’acétylcholine (10 000 molécules environ) active environ 1 700 récepteurs [24]. Sachant qu’il faut deux molécules d’acétylcholine par récepteur, 3 400 molécules environ vont être utilisées pour produire une dépolarisation de 0,5 à 1 mV, les autres molécules d’acétylcholine étant hydrolysées par l’acétylcholinestérase ou diffusant à l’extérieur de la fente synaptique [64]. Lors de l’arrivée d’un potentiel d’action dans la terminaison nerveuse, 200 quanta d’acétylcholine en moyenne sont libérés ce qui permet d’activer environ 340 000 récepteurs de la plaque motrice, ce qui est plus que suffisant pour produire un changement de potentiel au niveau de la plaque motrice appelé " potentiel de plaque " [120]. Ce potentiel a une amplitude d’au moins 40 à 50 mV au-dessus du potentiel de repos [24]. C’est ce potentiel de plaque qui donnera naissance à un potentiel d’action de la fibre musculaire. En plus des phénomènes de libération par quanta, l’acétylcholine extravésiculaire pourrait atteindre la plaque motrice par un processus de fuite [121].
- Canaux ioniques
Le potentiel de plaque va s’étendre à la zone périjonctionnelle qui se caractérise par un grand nombre de canaux sodiques qui peuvent être activés par un changement de potentiel électrique mais sont insensibles à l’acétylcholine. Contrairement au récepteur cholinergique, ils sont orientés vers l’intérieur de la cellule et ne laissent passer que les ions Na+. Le canal sodique en position de repos est fermé. La dépolarisation les active ce qui attire encore plus de Na+ vers l’intérieur de la cellule et provoque l’activation de plus de canaux. L’activation de ces canaux produit un potentiel d’action qui va se propager de proche en proche par activation d’autres canaux sodiques sur toute la longueur de la fibre musculaire. Le processus se termine par une inactivation des canaux sodiques 1 à 2 ms après leur activation et l’ouverture des canaux potassiques permettant une sortie rapide d’ions K+ et la repolarisation membranaire. Le potentiel d’action se propage vers les deux extrémités de la fibre musculaire, il provoque une ouverture des canaux calciques qui laissent entrer le calcium dans la fibre musculaire. Les canaux calciques sont situés sur la membrane cellulaire, sur les culs-de-sac de cette membrane ainsi que sur la membrane du réticulum endoplasmique.L’ouverture des canaux calciques provoque une arrivée soudaine de Ca++ intracellulaire qui inhibe l’action d’une protéine intracellulaire, la troponine, dont le rôle est d’empêcher l’interaction entre les filaments d’actine et de myosine. Les deux protéines vont alors pouvoir former des ponts entre elles, ce qui aura pour effet de raccourcir les filaments, de les solidifier et d’entraîner la contraction musculaire [60].
Effets postsynaptiques des curares non dépolarisants
Les curares non dépolarisants agissent de façon compétitive en se liant au même site d’action que l’acétylcholine au niveau des sous-unités α [184]. L’administration de curare entraîne une baisse progressive du potentiel de plaque motrice. À partir du moment où le potentiel de plaque ne peut plus atteindre le seuil, il n’apparaît plus de potentiel d’action ni de contraction musculaire. Pour chaque fibre musculaire, il s’agit d’une loi du tout ou rien. Il suffit qu’une seule des deux sous-unités α soit occupée par une molécule de curare pour que le récepteur soit bloqué. Cette interaction est appelée compétitive car l’action des curares non dépolarisants peut être contrecarrée par un excès d’acétylcholine. Dans ce cas, l’interaction entre l’acétylcholine et le récepteur nicotinique devient plus probable que celle entre le curare et le récepteur en raison de la concentration plus élevée d’acétylcholine. Les curares non dépolarisants pourraient aussi obstruer le récepteur cholinergique en position ouverte car ce sont des molécules contenant une ou deux charges positives et attirées vers l’intérieur de la plaque motrice mais trop grosses pour passer par le canal [24]. Cet effet est probablement négligeable aux concentrations usuelles car il y a en moyenne 140 000 à 1 400 000 fois plus d’ions Na+ que de molécules de curare non dépolarisant dans la fente synaptique.La présence de plus de récepteurs qu’il n’en faut pour atteindre le seuil pour la propagation d’un potentiel d’action est connue sous le nom de marge de sécurité. Un curare doit se lier à un grand nombre de récepteurs avant que n’apparaisse un bloc neuromusculaire (tableau I). Chez le chat, au moins 75 % des récepteurs, au niveau du muscle tibial postérieur, doivent être occupés par un curare non dépolarisant pour que la paralysie s’installe, le bloc complet n’étant obtenu que lorsque 92 % environ des récepteurs sont occupés [183]. Quoique les chiffres exacts puissent être différents selon les espèces et/ou les muscles étudiés [239], le principe demeure : la curarisation se produit à l’intérieur d’une fourchette de fréquence d’occupation des récepteurs relativement étroite [24].
- Effets présynaptiques des curares non dépolarisants
Il existe des récepteurs nicotiniques cholinergiques au niveau des terminaisons nerveuses présynaptiques. Le rôle de ces récepteurs serait de permettre un rétrocontrôle positif et la mobilisation des vésicules d’acétylcholine présynaptiques pour que sa libération soit maintenue lors des stimulations à haute fréquence [25]. L’acétylcholine augmenterait sa propre mobilisation par une activation des canaux calciques avec entrée de calcium qui se combinerait avec la calmoduline pour entraîner une inhibition de la synapsine I et un mouvement des vésicules vers les zones actives [25]. Plusieurs faits sont en faveur du rôle de ces récepteurs. L’application d’acétylcholine directement au niveau de la plaque motrice n’entraîne pas de diminution de potentiel de plaque lorsque la fréquence est élevée. De même, la quantité d’acétylcholine diminue peu lors d’une stimulation à haute fréquence alors que la présence d’un curare non dépolarisant accentue cette baisse [94]. Ces faits indiqueraient que l’épuisement en présence de faibles doses de curare non dépolarisant n’est pas un phénomène postsynaptique mais est lié au blocage de ces récepteurs présynaptiques.
- Effets sur le système nerveux autonome (tableau II)
Ces effets sont tous dose dépendants, additifs. Leur intensité n’est pas diminuée par le ralentissement de la vitesse d’injection.
- Effet ganglioplégique
Cet effet est lié au blocage des récepteurs nicotiniques postsynaptiques situés au niveau ganglionnaire. Il peut être mis en évidence, chez le chat, en mesurant la contraction de la membrane nictitante secondaire à une stimulation sympathique ainsi que l’inhibition de la bradycardie induite par une stimulation vagale. L’effet ganglioplégique a été observé essentiellement avec la d-tubocurarine, où il survient à des doses proches des doses curarisantes [110]. Il est quasiment inexistant avec les curares stéroïdiens, l’atracurium ou le mivacurium, car il faut des doses au moins 50 fois supérieures aux doses curarisantes.
- Effets sur les récepteurs muscariniques
L’inhibition des récepteurs muscariniques M2 situés au niveau du noeud sinusal peut être responsable d’une tachycardie. Cet effet est mis en évidence chez l’animal en mesurant l’intensité de la bradycardie secondaire à une stimulation vagale [110] ou à l’administration d’un agoniste muscarinique telle la méthacholine [23]. Les éventuelles propriétés vagolytiques d’un curare sont appréciées par le rapport DA50 vagolytique/DA50 curarisante. Le rapport DA50 vagolytique/DA50 curarisante est aux environs de 4 pour le pancuronium alors qu’il est de 25 pour l’atracurium [111] et 80 pour le vécuronium [221]. De tous les curares non dépolarisants, la gallamine est le plus vagolytique, le rapport étant égal à 0,6 [110]. Les effets vagolytiques de la gallamine apparaissent à des doses inférieures aux doses curarisantes. Le rapport DA50 vagolytique/DA50 curarisante est égal à 0,6 pour la d-tubocurarine mais il est la conséquence de l’effet ganglioplégique au niveau du système cholinergique. En effet ce rapport devient supérieur à 20 quand on utilise la méthacholine pour déterminer l’effet vagolytique [24]. Il n’a pas été mis en évidence d’effets des curares sur les récepteurs muscariniques de type M3 qui sont situés dans les vaisseaux et sont impliqués dans les phénomènes de vasodilation.Il existe également des récepteurs présynaptiques muscariniques de type M2 au niveau des terminaisons noradrénergiques. Ces récepteurs auraient pour rôle de diminuer la libération de noradrénaline. En bloquant ces récepteurs, le pancuronium et la gallamine augmenteraient la libération de noradrénaline ce qui majorerait la tachycardie liée à leurs propriétés vagolytiques [24, 232].
D’autres récepteurs muscariniques de type M2 sont présents au niveau des interneurones dopaminergiques de type SIF (small intensely fluorescent). Ces neurones sont activés par l’acétylcholine libérée par les collatérales des fibres cholinergiques préganglionnaires. La dopamine libérée par ces neurones entraîne une hyperpolarisation des neurones postganglionnaires adrénergiques, ce qui entraîne une inhibition de la transmission ganglionnaire [23, 24]. Le bloc de ces récepteurs muscariniques induit par la gallamine et le pancuronium entraîne une facilitation de la transmission ganglionnaire et de l’activité sympathique [91, 92].
- Effets sur la libération et le recaptage de la noradrénaline
Le pancuronium et le fazadinium bloquent le recaptage neuronal de la noradrénaline [57, 196] (type 1) au niveau du muscle cardiaque et des fibres lisses. Bien que cet effet apparaisse pour de fortes doses, c’est ce mécanisme qui expliquerait l’éventuelle augmentation de concentration plasmatique des catécholamines observée chez certains patients [173], tels ceux porteurs d’un phéochromocytome. Cet effet serait aussi à l’origine des interactions observées avec d’autres médicaments capables de bloquer le recaptage des catécholamines, tels les imipraminiques. Des tachycardies, voire l’apparition de troubles du rythme, ont été décrits chez des patients traités de façon chronique par de l’imipramine et ayant été anesthésiés avec une association halothane-pancuronium [78].L’atracurium peut inhiber le recaptage de type 1 et de type 2 (extraneuronal) mais à des concentrations très supérieures à celles entraînant un bloc neuromusculaire [24].
- Libération d’histamine
Histaminolibération non spécifiqueDe nombreux composés basiques chargés positivement peuvent entraîner une histaminolibération. Le mécanisme est lié à la fixation et à l’action directe du curare à la surface des mastocytes et des basophiles ce qui va entraîner une libération d’histamine, le calcium étant impliqué dans ce mécanisme. L’histaminolibération non spécifique est une exagération de l’effet pharmacologique. Elle n’est pas médiée par des anticorps et survient sans exposition antérieure au produit. Elle est favorisée par la vitesse d’injection du curare, la dose [200] ainsi que l’existence d’un terrain atopique [133]. La traduction clinique d’une histaminolibération non spécifique est habituellement moins sévère que lors d’une réaction immunologique car la libération d’histamine est moins massive [133]. La d-tubocurarine est fortement histaminolibératrice, celle-ci survenant pour des doses proches des doses curarisantes. Une dose de 500 à 600 μg/kg en 30 secondes multiplie par 4 à 6 les concentrations d’histamine plasmatique. Les autres benzylisoquinolines (atracurium, mivacurium) entraînent une histaminolibération pour des doses égales à trois fois la DA95. Le cisatracurium est le premier curare de ce groupe quasiment dénué d’effets histaminolibérateurs aux posologies usuelles. Les curares stéroïdiens n’entraînent pas d’histaminolibération. Les curares semblent induire une histaminolibération préférentiellement à partir des mastocytes cutanés plutôt qu’à partir des mastocytes pulmonaires comme ce peut être le cas avec le propofol [150]. Elle peut se traduire cliniquement par une éruption cutanée transitoire au niveau du visage et du cou, une tachycardie, voire une baisse transitoire de la pression artérielle pendant les 5 minutes suivant l’injection.
- Anaphylaxie
Les accidents allergiques peuvent survenir avec n’importe quel curare. Il s’agit de réactions d’hypersensibilité immédiate (type I) liées à la production d’IgE (immunoglobulines E) spécifiques qui se fixent sur les récepteurs spécifiques membranaires des mastocytes tissulaires et des basophiles circulants ainsi que sur des récepteurs spécifiques situés sur les plaquettes et les éosinophiles [133]. La partie allergénique des curares est l’ammonium quaternaire. Les patients peuvent avoir été sensibilisés par une exposition antérieure à un curare ou à des substances porteuses d’ions ammonium quaternaires (agents cosmétiques, désinfectants, etc). Ces mécanismes de sensibilisation expliquent la grande fréquence des réactivités croisées entre curares (70 %) ainsi que la possibilité d’accidents chez des patients n’ayant jamais été anesthésiés. L’administration de l’allergène entraîne sa réaction avec les IgE et l’accident anaphylactique par activation membranaire des basophiles et des mastocytes aboutissant à la libération massive de médiateurs préformés (histamine, tryptase, sérotonine) et reformés (prostaglandines, leucotriènes, facteur d’agrégation plaquettaire). En cas d’accident anaphylactique, les signes cliniques sont habituellement au complet et sont souvent plus graves qu’en cas d’accidents anaphylactoïdes [133]. Les curares n’entraînent pas d’activation de la voie du complément.
- Activité anticholinestérasique
En raison de leur parenté structurale avec l’acétylcholine, les curares peuvent se fixer sur les sites actifs des cholinestérases et entraîner une éventuelle inhibition de leur activité. L’inhibition de l’acétylcholinestérase d’origine globulaire survient pour des concentrations très supérieures à celles responsables du bloc neuromusculaire et n’a aucune traduction clinique. De même, l’inhibition de la butyrylcholinestérase plasmatique ne survient que pour des doses très élevées, exception faite du pancuronium [220]. L’inhibition de la butyrylcholinestérase par le pancuronium survient pour des concentrations 1 000 fois inférieures à celles observées avec les autres curares non dépolarisants [24]. Le rapport des concentrations inhibant l’activité des cholinestérases de 50 % (I50AChE/I50BuChE) est proche de 5 000 pour le pancuronium alors qu’il est compris entre 2 et 12 pour la majorité des autres curares non dépolarisants. L’inhibition de la butyrylcholinestérase par le pancuronium explique la longue durée d’action d’une faible dose de mivacurium (10 μg/kg) injectée en fin d’intervention, chez un patient préalablement curarisé par du pancuronium [80].
- Relation structure-activité
Les curares non dépolarisants sont tous porteurs d’au moins un groupe ammonium quaternaire, le plus souvent deux, qui permettent la fixation au niveau des mêmes sites que l’acétylcholine sur le récepteur cholinergique. Les deux ammoniums sont séparés par une structure lipophile de taille variable. Pendant longtemps, on a considéré que la distance entre les deux atomes d’azote devait être comprise entre 12 et 14 A [21]. Cette notion a moins d’importance avec les curares non dépolarisants qu’avec les curares dépolarisants, la distance étant de 10 à 11 A pour certains curares stéroïdiens. À l’opposé, certains dérivés des benzylisoquinolines ont une distance de 18 à 21 A entre les deux ammoniums. De même, l’existence de deux ammoniums quaternaires n’est pas indispensable, le second atome d’azote pouvant être sous forme tertiaire et non quaternaire aux pH physiologiques (d-tubocurarine, vécuronium). La gallamine est le seul curare porteur de trois ammoniums quaternaires [22]. Les curares non dépolarisants sont tous des molécules hydrosolubles diffusant mal en dehors du secteur hydrique extracellulaire en raison de leur ionisation aux pH physiologiques. Le passage de la barrière hématoencéphalique ou foetoplacentaire est donc faible.Deux grandes familles de curares non dépolarisants existent : les dérivés stéroïdiens et les benzylisoquinolines. La classe des curares stéroïdiens comprend le pancuronium, le pipécuronium, le vécuronium, le rocuronium et l’Org 9487. Ces agents ont en commun leur absence d’effets histaminolibérateurs. Certains peuvent avoir des propriétés vagolytiques (pancuronium). Ils sont tous éliminés par le rein, de plus le vécuronium et le rocuronium sont métabolisés dans le foie. Les benzylisoquinolines ont toutes une parenté structurale avec la d-tubocurarine. Il s’agit de la métocurine, de l’atracurium, du doxacurium, du mivacurium et du cisatracurium. Ces agents sont dépourvus d’effet vagolytique mais sont responsable d’une histaminolibération pharmacologique parfois aux doses thérapeutiques. Leur mode d’élimination varie selon les molécules, même s’ils sont tous excrétés par le rein. Le mivacurium est dégradé par les pseudocholinestérases plasmatiques, l’atracurium et le cisatracurium sont dégradés par la voie de Hofmann.
Influence des paramètres pharmacocinétiques/pharmacodynamiques (tableau III)
La vitesse d’installation de la curarisation est largement dépendante des facteurs circulatoires et de la puissance de la molécule alors que la durée d’action dépend essentiellement de la vitesse d’élimination.Vitesse d’installation de la curarisation
Le délai d’installation du bloc neuromusculaire correspond par définition au temps compris entre la fin de l’administration et l’obtention du bloc maximal.
- Paramètres hémodynamiques
Il existe une relation directe entre le débit cardiaque et le délai d’installation de la paralysie. Cette relation explique pourquoi les curares ont un délai d’action plus bref chez le nourrisson et l’enfant que chez l’adulte [209] et que les sujets âgés ont un délai d’action allongé par rapport à des patients plus jeunes [93, 128]. L’agent anesthésique d’induction intervient également. Gill et Scott ont démontré que la paralysie induite par le vécuronium s’installait plus rapidement après induction par l’étomidate qu’avec le propofol ou le thiopental. Il existe une corrélation entre la baisse tensionnelle et le délai d’installation du bloc neuromusculaire [95].Le débit sanguin musculaire peut également intervenir. Chez le chien, l’installation de la paralysie du muscle tibial antérieur, après injection de gallamine, est accélérée par l’augmentation du débit sanguin musculaire alors que la récupération n’est pas modifiée [98]. Il a été démontré l’existence d’une corrélation entre le temps d’apparition du vert d’indocyanine dans l’artère radiale et le délai d’installation du bloc [104]. L’activité métabolique du muscle peut aussi jouer un rôle. Après administration d’un bolus de 400 μg/kg d’atracurium, le délai entre l’injection et une diminution de 90 % de la force de l’adducteur du pouce est en moyenne de 2 minutes au niveau du bras stimulé par train-de-quatre alors que ce délai atteint 3,4 minutes au niveau du bras controlatéral stimulé par stimulation simple [47]. Cet effet est probablement lié à la stimulation par train-de-quatre qui augmente l’activité musculaire et les besoins en oxygène d’où l’augmentation du débit sanguin régional. Chez l’homme, l’installation du bloc neuromusculaire est plus rapide au niveau du diaphragme [65] et des muscles adducteurs laryngés [66, 162] qu’au niveau du pouce malgré leur résistance aux curares non dépolarisants. Après administration d’une dose de 40 μg/kg de vécuronium, le délai d’installation de la paralysie est de 3,3 au niveau des muscles laryngés et de 5,7 minutes au niveau de l’adducteur du pouce [66]. Ces résultats, apparemment contradictoires, s’expliquent par le fait que les muscles respiratoires sont mieux vascularisés que les muscles périphériques et reçoivent une quantité importante de molécules, ce qui entraîne l’installation plus rapide de la paralysie malgré leur résistance [104].
- Constante de transfert (ke0)
L’installation du bloc neuromusculaire est retardée dans le temps par rapport à l’évolution des concentrations artérielles plasmatiques de curare qui atteignent un pic 25 à 35 secondes après l’injection alors que la curarisation n’est pas encore détectable [67]. Ce phénomène souligne le rôle joué par les concentrations au niveau de la jonction neuromusculaire par rapport aux concentrations plasmatiques. Pour tenter de répondre à ce problème, Hull et Sheiner ont fait l’hypothèse que le site d’action pourrait être représenté par un compartiment théorique appelé " compartiment effet " en liaison avec le compartiment central et dans lequel la concentration de curare serait directement liée à l’effet, c’est-à-dire au bloc neuromusculaire [112, 206]. Ce type de modèle permet de déterminer la vitesse d’équilibration entre le plasma et la jonction neuromusculaire et de définir une constante de transfert ou ke0. Ce paramètre permet de calculer la demi-vie d’installation de l’effet ou T1/2ke0. La valeur de la ke0 est une grandeur théorique mais elle permet d’avoir une approche de la vitesse d’installation de la curarisation. Elle dépend essentiellement des paramètres circulatoires et du coefficient de partition du curare entre le sang et les muscles striés. Stanski a démontré que la ke0 de la d-tubocurarine correspondait au débit sanguin musculaire divisé par son coefficient de partition [219]. Une valeur comparable (5 à 7 min pour la T1/2ke0) a été retrouvée pour la majorité des curares non dépolarisants à l’adducteur du pouce. C’est le doxacurium qui a la demi-vie d’installation de l’effet la plus longue (14-20 min) [93] ce qui correspond au fait que c’est le curare non dépolarisant dont le délai d’action est le plus long de tous les agents utilisés chez l’homme. À l’opposé, la demi-vie d’installation de l’effet du rocuronium est la plus courte (4 min) au niveau du pouce [187]. Elle est significativement plus brève au niveau des muscles adducteurs laryngés (2,7 min) ce qui confirmerait le rôle des facteurs circulatoires pour expliquer le délai d’installation plus bref au niveau des muscles respiratoires.
- Accès au récepteur
Le temps de diffusion au sein de la fente synaptique n’influence probablement pas le délai d’action. Il a été démontré que les molécules de d-tubocurarine pouvaient pénétrer et quitter la fente synaptique en quelques millisecondes. De même la vitesse de liaison aux récepteurs cholinergiques, dès que les molécules ont pénétré dans la fente synaptique, est très courte et sans retentissement sur l’installation de la paralysie [7].
- Puissance
Il existe un nombre croissant d’arguments en faveur de la relation entre délai d’installation de la paralysie et puissance des curares. En cas de propriétés physicochimiques proches, les curares les moins puissants présentent le délai d’action le plus bref. Bowman a ainsi démontré, chez le chat, l’existence d’une relation inverse entre le délai d’installation du bloc maximal et la DA50 pour les curares stéroïdiens (fig 2) [26]. Chez l’homme, Kopman a démontré qu’en cas d’administration de doses équipotentes de d-tubocurarine, pancuronium et gallamine, l’intensité de la paralysie était comparable mais que le délai d’installation de la paralysie dépendait du curare utilisé. Un bloc de 50 % à l’adducteur du pouce était obtenu plus rapidement avec le curare le moins puissant, la gallamine (66 s), alors qu’il fallait 99 secondes avec la d-tubocurarine et 141 secondes avec le pancuronium qui est le plus puissant des trois [127]. De tous les curares non dépolarisants, disponibles chez l’homme, le doxacurium, qui est le plus puissant (DA95 : 25 μg/kg), est celui qui possède le délai d’installation de la paralysie le plus long (10 à 15 min) [9, 93]. À l’opposé, le rocuronium, qui est sept fois moins puissant que le vécuronium, présente à doses équipotentes un délai d’installation de la paralysie plus court que celui du vécuronium, que ce soit au niveau de l’adducteur du pouce (2,4 versus 5,7 min) ou des muscles adducteurs laryngés (1,4 versus 3,3 min) [162]. L’Org 9487, qui est trente fois moins puissant que le vécuronium, est le premier curare non dépolarisant à présenter un délai d’action comparable à celui du suxaméthonium [248].Ces observations s’expliquent par la théorie d’occupation des récepteurs et le concept de marge de sécurité de la jonction neuromusculaire. Quelle que soit la puissance d’un curare, un nombre critique de récepteurs doit être occupé pour que s’installe le bloc neuromusculaire. La paralysie de l’adducteur du pouce est complète quand environ 92 % des récepteurs sont occupés par les molécules de curare non dépolarisant. Après l’arrivée dans la fente synaptique, quasiment toutes les molécules de curare se retrouvent liées aux récepteurs [7]. En l’absence de différences pharmacocinétiques, quand un curare puissant est utilisé, le nombre de molécules atteignant la jonction neuromusculaire est faible par rapport à un curare de moindre puissance en raison de concentrations plasmatiques plus basses. Il en résultera que le temps nécessaire à la saturation des récepteurs sera plus long avec un curare puissant et que le délai d’installation de la paralysie sera important [63, 97, 130].
- Dose
L’intensité du bloc neuromusculaire est dose dépendante mais cette relation n’est pas linéaire. Si de faibles doses sont administrées, il peut ne pas y avoir de bloc neuromusculaire, en revanche au-delà d’une certaine dose, toute augmentation de posologie n’entraînera qu’une discrète variation d’intensité du bloc. En effet quand la paralysie devient proche de 100 %, il faut une augmentation relativement importante des concentrations pour entraîner une baisse de 1 % de la force musculaire. Le délai d’installation de la paralysie est indépendant de la dose aux posologies donnant un bloc de moins de 100 % [128] pour une molécule donnée. En revanche, le délai d’action peut être raccourci en donnant de fortes doses de curare qui permettent d’obtenir plus rapidement un degré de saturation des récepteurs de la jonction neuromusculaire entraînant l’obtention d’un bloc complet. Le délai d’action du vécuronium passe de 208 secondes après un bolus de 100 μg/kg à 106 secondes après une dose de 400 μg/kg (huit fois la DA95) [96, 228]. Aux fortes doses, le facteur limitant est probablement lié aux conditions circulatoires (débit cardiaque, débit sanguin musculaire). L’utilisation éventuelle de fortes doses entraîne deux problèmes : l’augmentation de la durée d’action et l’apparition d’éventuels effets secondaires cardiovasculaires. Seul le vécuronium a pu être utilisé à des posologies comprises entre six et huit fois la DA95 car il était jusqu’à maintenant le seul curare non dépolarisant totalement dénué d’effets secondaires cardiovasculaires, ce qui n’est plus le cas depuis l’apparition du cisatracurium. Les autres curares ne peuvent être utilisés à de telles doses en raison du risque d’effets secondaires. Ainsi l’atracurium ou le mivacurium ne peuvent être utilisés à des posologies supérieures à 600 et 200 μg/kg [200] respectivement, en raison de l’histaminolibération. L’administration de doses de vécuronium de six à huit fois la DA95 pour raccourcir le délai d’action entraîne un allongement important de la durée d’action [96, 228]. La durée d’action clinique à l’adducteur du pouce passe de 42 minutes après un bolus de 100 μg/kg à 115 minutes avec des extrêmes compris ente 35 et 191 minutes lors de l’injection d’une dose de 400 μg/kg [228].
- Durée d’action
Les curares peuvent être classés en quatre groupes en fonction de leur durée d’action clinique à l’adducteur du pouce après administration d’une dose de deux fois la DA95 [12]. Cette durée d’action doit être inférieure à 8 minutes pour les curares ultracourts. Elle est comprise entre 8 et 20 minutes pour les curares courts, entre 20 et 50 minutes pour les molécules de durée d’action intermédiaire. Les curares de longue durée d’action ont une durée d’action clinique supérieure à 50 minutes.
- Paramètres pharmacocinétiques
Contrairement au délai d’installation de la paralysie, la durée d’action est largement dépendante de la décroissance des concentrations plasmatiques. Cette dernière dépend à la fois des phénomènes de redistribution, de métabolisme et d’élimination. L’effet d’un curare commence à diminuer quand les concentrations plasmatiques artérielles deviennent inférieures aux concentrations à la jonction neuromusculaire [58]. Pour les curares de longue durée d’action (d-tubocurarine, pancuronium), la décurarisation a lieu pendant la phase d’élimination, le pseudoéquilibre entre les concentrations plasmatiques et celles de la jonction neuromusculaire étant déjà obtenu. Il existe dans ce cas une relation entre baisse des concentrations plasmatiques et demi-vie d’élimination. L’augmentation des doses entraîne un allongement de la durée d’action car le temps nécessaire pour arriver à une concentration à partir de laquelle la décurarisation s’installe sera prolongé. En revanche, l’index de récupération est relativement constant et en relation avec la constante d’élimination de la molécule considérée. L’atracurium a une demi-vie d’élimination brève (20 min), la décurarisation va donc se produire pendant la phase prédominante d’élimination. En revanche, le vécuronium ou le rocuronium se comportent différemment de l’atracurium. Bien qu’ils aient une demi-vie d’élimination comprise entre 1 et 2 heures, leur durée d’action et leur vitesse de décurarisation sont comparables à celles de l’atracurium. Ces discordances apparentes, par rapport à l’atracurium, s’expliquent par l’importance des phénomènes de redistribution pour ces deux curares [59]. Les concentrations plasmatiques vont diminuer jusqu’à des concentrations compatibles avec la décurarisation pendant la phase de distribution, rendant moins importants que pour les autres curares les phénomènes d’élimination. Ainsi, malgré des profils pharmacocinétiques différents, l’atracurium, le vécuronium et le rocuronium ont des durées d’action et des vitesses de décurarisation proches (fig 3) [59].
- Paramètres pharmacodynamiques
Après administration d’un curare non dépolarisant, le diaphragme ou les muscles adducteurs laryngés se décurarisent plus rapidement que les muscles périphériques tels que l’adducteur du pouce. Ces résultats s’expliquent par la résistance des muscles respiratoires. Plaud a pu démontrer qu’en cas de bloc lié au rocuronium, la concentration théorique dans le compartiment effet entraînant une diminution de 50 % de la force musculaire, était de 1424 μg/L pour les muscles laryngés alors qu’elle n’atteignait que 823 μg/L pour l’adducteur du pouce [187]. En cas de patient " sensible " aux effets des curares, la durée d’action sera prolongée par rapport à un autre patient car il faudra atteindre des concentrations plasmatiques plus basses avant que n’apparaissent les premiers signes de décurarisation.
- Interactions pharmacologiques
Agents halogénés
Les agents halogénés entraînent une potentialisation des effets des curares non dépolarisants. Ils entraînent un déplacement de la courbe dose-action vers la gauche. C’est l’enflurane qui a, parmi les agents halogénés, les effets les plus marqués en entraînant une baisse d’environ 30-40 % de la DA 50 à 1 CAM (concentration alvéolaire minimale). La potentialisation par l’isoflurane est intermédiaire entre celles observées avec l’halothane et l’enflurane. Les effets des nouveaux agents halogénés (desflurane, sévoflurane) semblent comparables à ceux de l’isoflurane. Cette potentialisation dépend de la concentration alvéolaire de l’agent halogéné. L’augmentation de 1,2 à 2,2 CAM d’isoflurane entraîne une baisse de la DA50 du vécuronium qui passe de 15 à 10 μg/kg [193]. Le mécanisme exact de cette potentialisation est mal connu et n’est probablement pas univoque [147]. L’augmentation du débit sanguin musculaire, qui augmenterait l’apport de curare au niveau musculaire, a été évoqué mais ce mécanisme ne permet pas d’expliquer la potentialisation observée in vitro. Les effets plus marqués en cas de stimulation tétanique ou de train-de-quatre qu’en cas de stimulation simple ont fait évoquer l’hypothèse d’une action des agents halogénés au niveau présynaptique entraînant une diminution de la libération d’acétylcholine dans la fente synaptique [147]. Les agents halogénés diminuent la dépolarisation postsynaptique induite par le carbachol, ce qui traduit leur action au niveau postsynaptique [240]. Ils pourraient agir en modifiant la conformation allostérique du récepteur nicotinique [251]. Les autres mécanismes envisagés sont une action directe sur la contraction musculaire ou une inhibition des mouvements calciques dans le réticulum sarcoplasmique [147].
Une potentialisation des effets du suxaméthonium par le protoxyde d’azote a été mise en évidence chez l’homme. Une dose submaximale de suxaméthonium (0,3 mg/kg) entraîne un bloc maximal de 45 % à l’adducteur du pouce dans le groupe contrôle versus 74 % dans le groupe ayant reçu du protoxyde d’azote. Pour apparaître, cette potentialisation nécessite l’administration de protoxyde d’azote pendant au moins 6 minutes [222], ce qui reste éloigné des conditions cliniques d’utilisation du suxaméthonium.
- Autres agents
De nombreuses études se sont intéressées aux interactions éventuelles entre agents anesthésiques intraveineux et curares. Si une potentialisation a pu être démontrée in vitro ou chez l’animal pour de nombreux agents, les conséquences cliniques sont inexistantes comparées aux effets des agents halogénés. Les agents anesthésiques pourraient agir par l’intermédiaire d’un effet stabilisant de membrane.Les anesthésiques locaux peuvent potentialiser les effets des curares non dépolarisants en bloquant les canaux sodiques, voire en bloquant les récepteurs cholinergiques en position ouverte [147].
Les interactions entre antibiotiques et curares ont été étudiées suite à la survenue de plusieurs cas de curarisations prolongées après administration d’aminosides ou de polymyxines en période peropératoire. Les aminosides semblent diminuer la libération d’acétylcholine dans la fente synaptique [226] ; ils auraient une action proche de celle du magnésium [208], ils agiraient également sur les récepteurs cholinergiques postsynaptiques. Les effets potentialisateurs les plus marqués ont été observés avec la néomycine, puis par ordre d’intensité décroissante, avec la streptomycine, la gentamicine et la kanamycine [68, 208, 226]. La nétilmycine est le seul aminoside pour lequel il n’a pas été démontré de potentialisation de la curarisation. Cette potentialisation est majorée par le magnésium et antagonisée par l’administration de calcium ou de 4-aminopyridine. Les polymyxines ainsi que les lincosamides (lincomycine, clindamycine) potentialisent également la curarisation. Le bloc qu’elles induisent est difficile à antagoniser [208] ce qui traduirait un mode d’action complexe avec des effets à plusieurs niveaux dont un blocage des récepteurs cholinergiques, un effet stabilisant de membrane, voire un effet direct sur la contractilité musculaire [147]. Chez l’homme, la potentialisation a une traduction clinique essentiellement en cas de surdosage, d’insuffisance rénale, d’administration intrapéritonéale ou intrapleurale.
Chez l’animal, l’administration d’inhibiteurs calciques tels le vérapamil ou la nifédipine peut potentialiser un bloc non dépolarisant. Ils agiraient en bloquant les canaux calciques à différents niveaux, mais le lieu exact de l’interaction n’est pas connu. Le bloc est antagonisable chez l’animal par la 4-aminopyridine [1]. Il a été démontré, chez l’homme, une résistance au pancuronium et au vécuronium [177, 225] ainsi qu’à l’atracurium [177] en cas de traitement chronique par diphénylhydantoïne ou carbamazépine. Le principal mécanisme de cette résistance induite par les antiépileptiques semble être pharmacodynamique. L’administration chronique de phénytoïne pourrait antagoniser l’acétylcholine au niveau pré- et postsynaptique ce qui entraînerait une prolifération des récepteurs extrajonctionnels, comme c’est le cas lors des syndromes de dénervation, et l’apparition d’une résistance aux curares [153]. Il a également été suggéré que la résistance pourrait être liée à l’induction enzymatique hépatique, voire à l’augmentation de la clairance d’élimination pour certains curares [153, 177].
- Interactions entre curares
Le vécuronium et le pancuronium administrés simultanément ont des effets curarisants additifs, de même que l’association d-tubocurarine-métocurine [189]. En revanche, il a été démontré une synergie lors de l’administration simultanée de d-tubocurarine avec la gallamine puis lors de l’utilisation de vécuronium ou de pancuronium avec la d-tubocurarine. L’utilisation d’associations cliniques synergiques avait été proposée pour diminuer les posologies et les effets secondaires liés à certaines molécules. Cette méthode est tombée en désuétude, en raison de son intérêt clinique limité et de l’apparition de curares présentant peu d’effets secondaires hémodynamiques. L’administration simultanée de deux curares non dépolarisants ne semble pas modifier leur pharmacocinétique ou leur degré de fixation aux protéines plasmatiques. La potentialisation serait expliquée par les effets plus marqués d’un des deux curares non dépolarisants au niveau présynaptique ou par une fixation différente des deux molécules au niveau des deux sous-unités α du récepteur cholinergique [189].L’administration préalable de suxaméthonium entraîne une augmentation de l’intensité et une prolongation du bloc non dépolarisant [48, 189]. Un bolus de 40 μg/kg de vécuronium administré plus de 30 minutes après le suxaméthonium, a une durée d’action totale de 26 minutes versus 12 minutes dans le groupe contrôle n’ayant pas reçu de suxaméthonium [48]. Le mécanisme de cette potentialisation n’est pas encore élucidé [28]. En revanche, en cas d’administration préalable d’une faible dose de curare non dépolarisant pour prévenir les fasciculations, le suxaméthonium est moins puissant et a une durée d’action raccourcie [189]. Il pourrait s’agir d’une compétition entre curare non dépolarisant et suxaméthonium au niveau des récepteurs cholinergiques postsynaptiques.
- Utilisation prolongée
L’administration prolongée de curares est rare mais parfois nécessaire chez le patient de réanimation. La survenue d’une tachyphylaxie est fréquente, elle apparaît au bout de 2 à 4 jours, entraînant une multiplication des doses par 2 à 3. Elle serait liée à l’augmentation du nombre des récepteurs cholinergiques extrajonctionnels, y compris en l’absence d’immobilisation. Plusieurs cas de paralysies prolongées ont été observés après l’arrêt de l’administration prolongée de curares. Les premiers cas de tétraparésie accompagnée d’aréflexie ont été décrits après administration prolongée de pancuronium [175], mais depuis, des atteintes similaires ont été décrites lors de l’utilisation de vécuronium [203] ou d’atracurium. Ces atteintes musculaires s’accompagnent d’atrophie musculaire et peuvent également toucher les muscles respiratoires. Le délai de récupération est très variable d’un patient à un autre. Selon les cas, une atrophie d’origine neurogène, une nécrose musculaire ou des lésions compatibles avec celles rencontrées lors des myopathies sont retrouvées. Chez certains patients, une association curare stéroïden - corticoïdes administrés à fortes doses (état de mal asthmatique, transplantation d’organes) a été notée. Les curares agiraient en bloquant la transmission neuromusculaire, ce qui favoriserait la prolifération des récepteurs extrajonctionnels [109] et la dénervation d’un certain nombre de fibres musculaires. Cette pathologie est différente de la polyneuropathie de réanimation ou critical illness neuropathy qui survient lors du sepsis en l’absence de toute administration de curare. La survenue d’une hypermagnésémie, d’une acidose métabolique, d’une insuffisance rénale conduisant à l’accumulation de métabolites comme le 3-désacétylvécuronium, apparaissent comme des facteurs aggravants [203].
- Propriétés particulières
– Curares de courte durée d’action
Mivacurium (Mivacron®)
Le mivacurium fait partie de la classe des benzylisoquinolines (fig 4). L’hydrolyse plasmatique rapide de cette nouvelle molécule explique d’une part sa courte durée d’action et d’autre part l’absence d’effet cumulatif.
- Métabolisme et pharmacocinétique
Le mivacurium, comme le suxaméthonium, est hydrolysé dans le plasma par les butyrylcholinestérases. La vitesse du métabolisme et donc la demi-vie du mivacurium sont directement dépendantes de l’activité des butyrylcholinestérases. Plus celle-ci est diminuée, plus la demi-vie augmente [39]. Les deux métabolites, un monoester et un aminoalcool quaternaire, sont porteurs d’une fonction NH4+. Ils ne traversent pas la barrière hématoencéphalique et n’ont aucun effet sur le système nerveux central, aucun effet curarisant et aucun effet hémodynamique [199]. Le mivacurium est composé de trois isomères : Trans-Trans, Cis-Trans et Cis-Cis. L’isomère Cis-Cis ne représente que 4 à 6 % de la totalité du mivacurium et il est 13 fois moins puissant que les deux autres isomères. La clairance plasmatique des isomères Cis-Trans et Trans-Trans est de 105 et de 56 mL/kg/min respectivement chez l’homme [142]. Ces chiffres très élevés traduisent l’importance du métabolisme par les pseudocholinestérases plasmatiques. Le faible volume de distribution des isomères Cis-Trans (290 mL/kg) et Trans-Trans (150 mL/kg) témoigne de leur diffusion limitée. L’existence d’une clairance très élevée et d’un faible volume de distribution explique les demi-vies d’élimination très courtes des isomères Cis-Trans (1,8 min) et Trans-Trans (1,9 min). Ces valeurs sont proches des demi-vies d’élimination observées in vitro. En revanche, l’isomère Cis-Cis a une clairance d’élimination (4,6 mL/kg/min) et une demi-vie d’élimination (53 min) comparables à celles des curares de durée d’action intermédiaire (fig 5) [142]. Cet isomère pourrait être éliminé inchangé par le foie et le rein. Bien que de faible puissance, il pourrait s’accumuler chez des patients en insuffisance rénale sévère et contribuer à la prolongation du bloc neuromusculaire. Les paramètres pharmacocinétiques du mivacurium ont été comparés chez des patients normaux, des patients présentant une insuffisance hépatique ou rénale [38] mais sans avoir dosé l’isomère Cis-Cis. Quinze minutes après l’injection d’une dose unique, la concentration des deux isomères actifs n’était plus détectable dans le plasma des patients normaux et insuffisants rénaux (limite de détection : 10 ng/mL). Chez les patients présentant une insuffisance hépatique, la concentration plasmatique des isomères actifs avait diminué en 30 minutes d’environ 95 % par rapport à la concentration maximale. Chez les patients présentant une insuffisance hépatique, l’aire sous la courbe des concentrations plasmatiques est en moyenne deux fois plus importante que chez les patients normaux ou insuffisants rénaux.
- Pharmacologie clinique (tableau IV)
– PuissanceChez l’adulte, la DA95 du mivacurium est de l’ordre de 75 μg/kg [56, 90, 199]. Le mivacurium est donc quatre fois plus puissant que l’atracurium. Les agents halogénés potentialisent les effets du mivacurium. La DA95 est égale à 45 μg/kg sous isoflurane (0,5-0,75 %) [241], et à 52 μg/kg sous enflurane (0,9-1,2 %) [33]. La dose d’intubation du mivacurium devrait être de l’ordre de 150 μg/kg en raison de la résistance aux curares non dépolarisants des muscles adducteurs laryngés et du diaphragme. Il a cependant été mis en évidence par Plaud qu’une dose de 140 μg/kg de mivacurium n’entraînait un bloc des muscles adducteurs laryngés que de 90 % en moyenne, un seul des onze patients étudiés ayant été totalement paralysé au niveau des cordes vocales [186]. Dans la pratique, la dose d’intubation du mivacurium semble être plus proche de 200 μg/kg que de 150 μg/kg, d’autant qu’il existe une variabilité interindividuelle importante [32].
- Délai d’installation de la curarisation
Pour une dose de 150 μg/kg, le délai d’installation est en moyenne de 3,3 minutes au niveau de l’adducteur du pouce. Il diminue en augmentant la dose : 2,3 minutes après 250 μg/kg [199]. Le délai d’installation de la curarisation induite par le mivacurium est donc plus long que celui de la succinylcholine. Il est comparable à celui de l’atracurium, compris entre 2 et 3 minutes [32]. Le délai d’installation est de 2,2 minutes au niveau des cordes vocales après administration d’un bolus de 140 μg/kg, ce qui reste plus long qu’avec une dose équipotente de succinylcholine (0,9 min).
- Durée d’action
La durée d’action est en moyenne de 20 minutes après administration d’un bolus de 200 μg/kg [199]. Même pour des doses supérieures à trois fois la DA95 (250 μg/kg), la durée d’action du mivacurium à l’adducteur du pouce est courte (21 min) par rapport à celle des autres myorelaxants non dépolarisants. La durée d’action clinique du mivacurium est en moyenne trois fois plus longue que celle de la succinylcholine et deux fois plus courte que celle de l’atracurium [32, 199].En cas d’administration répétée, la durée d’action clinique de chaque dose de réinjection reste constante car l’hydrolyse plasmatique prévient les effets cumulatifs. Pour des doses de réinjection de 44 μg/kg, la durée d’action de chaque dose est d’environ 9 minutes jusqu’à la sixième réinjection [56].
La durée d’action totale est de 30 minutes environ après un bolus de 200 μg/kg [199]. La durée d’action totale du mivacurium, même à une dose supérieure à trois fois la DA95, reste inférieure à celle des autres myorelaxants non dépolarisants utilisés. L’halothane (0,4-0,6 %) prolonge la durée d’action : 30 minutes sous halothane contre 24 minutes sans halogéné, pour une dose de 150 μg/kg [90].
- Récupération spontanée
La vitesse de décurarisation est proche de 6-7 minutes quelle que soit la dose en injection unique, du fait de l’absence d’effet cumulatif [199]. Les agents halogénés diminuent significativement la vitesse de récupération spontanée. La vitesse de récupération spontanée du mivacurium, pour une dose de 200 à 250 μg/kg, est en moyenne 1,5 fois plus rapide que celle de l’atracurium (500 μg/kg) et deux fois plus lente que celle de la succinylcholine (1 mg/kg).
- Perfusion continue
Le mivacurium est un curare de choix pour l’utilisation des myorelaxants non dépolarisants en perfusion continue, car dépourvu d’effet cumulatif. Pour obtenir un bloc de 95 %, au niveau de l’adducteur du pouce, la vitesse moyenne de perfusion est de l’ordre de 6 à 8 μg/kg/min. Le monitorage de la curarisation doit être systématique en raison de la variabilité interindividuelle importante. L’isoflurane et l’enflurane potentialisent la curarisation et permettent de diminuer la vitesse de perfusion. Après une perfusion d’une durée comprise entre 35 et 324 minutes, l’index de récupération est comparable à celui d’une dose unique [199]. Une fois que la décurarisation spontanée a débuté, la vitesse de récupération est indépendante de la durée de perfusion [6, 37]. Après perfusion continue, la vitesse de décurarisation du mivacurium reste supérieure à celle de l’atracurium et du vécuronium. Pour une durée de perfusion comparable (de l’ordre de 90 à 100 min), l’index de récupération du mivacurium est plus court que celui de l’atracurium (11 min) ou du vécuronium (12 min) [6].
- Antagonisation
L’activité des pseudocholinestérases peut être partiellement et transitoirement inhibée par la néostigmine ou l’édrophonium [105, 224]. Dans la pratique clinique, l’antagonisation du bloc neuromusculaire induit par le mivacurium ne semble pas poser de problème, surtout si l’administration de l’anticholinestérasique a lieu quand la force musculaire de l’adducteur du pouce est d’au moins 10 % de la valeur contrôle. Il a été mis en évidence une plus grande fréquence de curarisation résiduelle quand le bloc induit par le mivacurium n’était pas antagonisé [18]. Après administration de néostigmine chez des patients dont le bloc, au moment de l’administration de la néostigmine, était compris entre 67 et 93 %, une récupération de 95 % de la force musculaire était obtenue en 6,3 minutes, comparée à 10,3 minutes en cas de récupération spontanée [199]. Le gain de temps est donc de l’ordre de 4 minutes. Après administration en perfusion continue, la néostigmine administrée lorsque la décurarisation spontanée avait atteint 12 % de la valeur contrôle, permet d’obtenir une décurarisation complète en 8 minutes contre 17 minutes sans antagonisation [99]. Les effets de la néostigmine et de l’édrophonium ont été comparés à la récupération spontanée après administration du mivacurium en perfusion continue [100]. La durée de perfusion a été en moyenne de 58 minutes. Le gain de temps après antagonisation pour obtenir un rapport T4/T1 > 70 % a été de 6 à 8 minutes par rapport à la récupération spontanée (11 min après néostigmine, 8 min après édrophonium et 17 min lors de la récupération spontanée).
- Influence du terrain
– Âge
– Chez le nourrisson, la DA95 du mivacurium est plus élevée que chez le nouveau-né [250]. Chez les enfants âgés de 2 à 12 ans, elle est de 110 μg/kg [101]. Sous anesthésie à l’halothane (1 %), la DA 95 est de 95 μg/kg [101, 197] Chez l’enfant, la vitesse de perfusion, pour maintenir un bloc de 95 %, est plus importante que chez l’adulte, de l’ordre de 15 μg/kg/min en l’absence d’agent halogéné [30].Le délai moyen d’installation de la curarisation, après une dose de 150 μg/kg chez le nouveau-né, est de 1,6 minute. Après 200 μg/kg chez le jeune enfant, ce délai est de 1,5 minute [250]. Le raccourcissement du délai d’action chez l’enfant serait lié à l’augmentation relative du débit cardiaque par rapport à l’adulte.
Après administration d’un bolus de 200 μg/kg, la durée d’action clinique est d’environ 10 minutes chez le jeune enfant [250]. Quelle que soit la dose utilisée, la durée d’action clinique est plus courte chez l’enfant que chez l’adulte. Après une dose unique de 150 μg/kg, la durée d’action totale est de 16 minutes chez le nouveau-né (âgé de 2 à 6 mois) ou le nourrisson (âgé de 7 à 11 mois) [102]. Pour une dose de 200 μg/kg chez l’enfant (âgé de 2 à 12 ans), la durée d’action totale est de 17,9 minutes sous halothane (1 %) contre 18,4 minutes sous anesthésie balancée. La vitesse de décurarisation spontanée est plus rapide chez l’enfant que chez l’adulte, comme c’est le cas pour tous les curares non dépolarisants.
- Déficit en pseudocholinestérases
Le mivacurium étant hydrolysé par les pseudocholinestérases plasmatiques, tout déficit acquis ou congénital peut induire des modifications tant pharmacocinétiques que pharmacodynamiques.La synthèse hépatique des pseudocholinestérases plasmatiques est gouvernée par deux gènes allèles autosomiques situés sur le chromosome 3. Le gène U (usual) ou normal est présent dans la majorité de la population, les trois autres gènes identifiés étant désignés A (résistant à la dibucaïne), F (résistant au fluor) et S (silencieux) selon la réponse à des inhibiteurs (dibucaïne, fluor). Initialement, quatre phénotypes de pseudocholinestérase avaient donc été identifiés dans la population, la découverte récente de nouveaux gènes anormaux mais rares (Kalow, Hammersmith, James) fait que plus de 20 génotypes sont désormais connus [116]. Le génotype normal U-U est présent chez 96 % des patients dans la population européenne et s’accompagne d’une activité de la butyrylcholinestérase comprise entre 3 000 et 7 000 unités internationales (UI)/L [71]. Cette substitution est responsable d’une baisse de l’affinité de la butyrylcholinestérase par la dibucaïne. La constatation d’une baisse de l’activité au-dessous de 1 500 UI/L permet d’affirmer le déficit en butyrylcholinestérase mais pas d’en préciser le caractère homozygote ou hétérozygote. Après administration d’une faible dose de mivacurium (30 μg/kg) chez cinq patients hétérozygotes U-A et cinq patients homozygotes A-A pour le gène anormal A, le bloc maximal était de 91 % (écart 69-100 %) chez les patients U-A et de 100 % chez les patients A-A [178]. Le délai pour obtenir une récupération spontanée de 90 % de la valeur contrôle était en moyenne de 24 minutes (extrêmes 14-31,3 min) chez les patients U-A ; alors que chez les patients A-A, le délai d’obtention d’une récupération de 50 % de la force musculaire était de 95 minutes. L’existence d’un phénotype homozygote pour le gène anormal est rare (1 sur 2 500 patients) mais entraîne une prolongation considérable de la durée d’action du mivacurium [158]. Après administration d’un bolus de 200 μg/kg, des curarisations pouvant atteindre 6 heures ont été décrites en cas de déficit homozygote [234].
À côté des déficits congénitaux existent des déficits acquis. Les pseudocholinestérases étant synthétisées par le foie, la cause la plus fréquente de déficit acquis est l’insuffisance hépatocellulaire. Devlin a étudié les effets myorelaxants d’une dose de 150 μg/kg de mivacurium chez des patients atteints de cirrhose, la gravité étant appréciée au moyen de la classification de Child-Pugh. L’activité cholinestérasique diminuait avec la gravité de la cirrhose : 687 UI/L pour les cirrhoses classe A, 595 UI/L et 275 UI/L pour les classes B et C respectivement alors qu’elle était de 1 125 UI/L pour les patients normaux. Il existait une corrélation entre l’activité cholinestérasique et la durée d’action du mivacurium. La courte durée d’action du mivacurium n’était plus observée chez les patients présentant une cirrhose modérée (classe A). Chez ces malades, la durée d’action clinique du mivacurium devenait comparable à celle de l’atracurium. En cas d’atteinte hépatocellulaire sévère (Child C), la durée d’action clinique était de 43 minutes. L’index de récupération était comparable entre le groupe témoin (8,3 min) et les patients Child A (9,9 min) mais était très allongé dans les formes les plus sévères (27,8 min) [55].
Les autres causes de déficit acquis sont les chocs septiques, les dénutritions, les brûlures étendues ou certaines pathologies tumorales (carcinomes). Les plasmaphérèses ainsi que certains médicaments peuvent entraîner une diminution de l’activité de la butyrylcholinestérase. La baisse peut être causée par l’utilisation d’antimitotiques tels que le cyclophosphamide (Endoxan ®) [235], d’écothiopate (Phospholine ®) ou des agents organophosphorés. Le pancuronium, le propranolol ne causent qu’une discrète diminution de l’activité sans traduction clinique. La grossesse entraîne une baisse d’environ 25 % de la butyrylcholinestérase, ce qui est sans conséquence clinique. L’activité chez le nouveau-né est aux environs de 50 % de celle de l’adulte mais va se normaliser dans les 6 premiers mois de vie.
- Insuffisance rénale
En cas d’insuffisance rénale, après injection d’un bolus de 150 μg/kg suivie d’une perfusion continue, le bloc maximal et le délai d’installation ne sont pas significativement différents entre les patients normaux et ceux porteurs d’une insuffisance rénale terminale [185]. La décurarisation spontanée, après bolus, est observée plus tardivement chez l’insuffisant rénal (15,3 min) que dans le groupe contrôle (9,8 min). La vitesse de perfusion de mivacurium, pour maintenir un bloc neuromusculaire de 95 %, est diminuée chez l’insuffisant rénal par rapport aux patients normaux. La néostigmine accélère la récupération dans les deux groupes avec la même efficacité [185]. Ces altérations seraient liées à l’accumulation éventuelle de l’isomère Cis-Cis qui est à élimination rénale.
- Effets secondaires
– Histaminolibération
Comme tous les myorelaxants de la classe des benzylisoquinolines, le mivacurium est histaminolibérateur. Un index permettant de comparer l’histaminolibération des différents myorelaxants a été proposé. Cet index prend en compte les propriétés histaminolibératrices par rapport à la puissance myorelaxante. Il est égal au rapport de la dose de myorelaxant provoquant une augmentation de 100 % de l’histaminémie chez 50 % des patients (DA50 histamine) et de la dose nécessaire à l’obtention d’un effet curarisant de 95 % sur l’adducteur du pouce (DA95). Plus cet index est faible, plus l’agent myorelaxant est histaminolibérateur. Pour le mivacurium, la DA50 histamine est de 243 μg/kg, avec une DA95 curarisante de 80 μg/kg. L’index est donc proche de 3. Le mivacurium est, vis-à-vis de l’histaminolibération, proche de l’atracurium mais moins histaminolibérateur que la d-tubocurarine [200]. Plus la dose est importante, plus l’incidence des effets secondaires est élevée. Pour une dose inférieur à 150 μg/kg, aucun effet secondaire n’a été observé. Pour une dose supérieure à 200 μg/kg, la survenue des effets secondaires (érythème facial et variations hémodynamiques) a intéressé en moyenne 50 % des patients. Après 300 μg/kg, pratiquement tous les patients ont présenté des manifestations cliniques. Pour une dose de 250 μg/kg, la diminution de la vitesse d’injection (30 à 60 s) entraîne une réduction importante de l’incidence des effets cliniques dus à l’histaminolibération [200]. L’importance de l’histaminolibération non spécifique et l’incidence de ces manifestations cliniques semblent acceptables pour une dose inférieure à trois fois la DA95 (soit 250 μg/kg), injectée en 30 secondes au moins.
- Effets hémodynamiques
Les effets hémodynamiques sont liés à l’histaminolibération. Ils sont donc dépendants de la dose et de la vitesse d’injection. Jusqu’à une dose de 150 μg/kg, la pression artérielle ne varie pas de manière significative. Pour des doses supérieures à 150 μg/kg, la diminution de la pression artérielle est d’autant plus prononcée que la dose est plus élevée [200]. Pour une dose de 200 μg/kg, la pression artérielle moyenne diminue d’environ 15 % ; alors qu’après 250 μg/kg celle-ci peut être abaissée de 20 %. La diminution de la pression artérielle est encore plus marquée (30 %) pour une dose de 300 μg/kg. Lorsque l’injection est plus lente (30-60 s), la pression artérielle moyenne ne varie plus de manière significative par rapport aux valeurs contrôles [200].
- Utilisation clinique
La dose recommandée pour l’intubation doit être au moins égale à 150 μg/kg. Cette dose peut être éventuellement augmentée, mais ne doit pas dépasser 200 μg/kg afin de minimiser les effets hémodynamiques. Du fait de la courte durée d’action du mivacurium, le premier bolus d’entretien doit être administré 15 à 25 minutes après une dose initiale de 150 à 200 μg/kg. Si la dose d’entretien est de 100 μg/kg, sa durée d’action ne sera que d’une dizaine de minutes. Même s’il existe une grande variabilité interindividuelle, la durée d’action de chaque bolus sera constante pour un même patient. La faible durée d’action et l’absence d’effets cumulatifs facilite l’utilisation du mivacurium en perfusion continue. L’administration continue ne doit être débutée qu’après réapparition d’au moins une réponse au train-de-quatre afin de ne pas ignorer un éventuel déficit en pseudocholinestérase [158]. Chez l’adulte, la perfusion est débutée à une vitesse de 10 μg/kg/min, alors que chez l’enfant la vitesse initiale est de 15 μg/kg/min. La vitesse doit être ensuite adaptée sur les données du monitorage. L’adaptation de la posologie est fréquente pendant les 15 premières minutes suivant le début de la perfusion. Passé ce délai, la vitesse de perfusion varie peu.En cas de survenue d’une curarisation prolongée, il importe de poursuivre la ventilation contrôlée et la sédation. La néostigmine ne peut être utilisée qu’après le début de la décurarisation spontanée avec la réapparition de la quatrième réponse au train-de-quatre.
- Curares de durée d’action intermédiaire
Atracurium (Tracrium®)
L’atracurium est un curare non dépolarisant de la famille des benzylisoquinolines. Il représente un mélange de dix isomères. Son originalité réside dans son métabolisme plasmatique non enzymatique : la voie de Hofmann.
- Métabolisme et pharmacocinétique (tableau V)
L’atracurium est dégradé dans le plasma par la voie de Hofmann en laudanosine et monoacrylate (fig 6) [111]. La vitesse de dégradation par la voie de Hofmann dépend du pH et de la température. La demi-vie de dégradation de l’atracurium est de 71 minutes à pH 7,4 en milieu tampon. La vitesse de dégradation est multipliée par 4 quand le pH passe de 6,9 à 7,6 [164]. La laudanosine représente plus de 60 % des métabolites totaux. La laudanosine est dépourvue d’effets curarisants mais peut provoquer des convulsions chez l’animal. Chez l’homme, sa clairance est d’environ 10 ml/kg/min, la demi-vie d’élimination est proche de 200 minutes. Des concentrations maximales de 1,45 μg/mL ont été retrouvées après 4 heures d’administration continue [76], ce qui reste inférieur au seuil convulsivant (15 μg/mL chez le chien). L’autre métabolite formé par la voie de Hofmann est un monoacrylate quaternaire qui n’a pas d’activité pharmacologique aux concentrations observées chez l’homme. L’atracurium peut également être hydrolysé dans le foie et le plasma par des estérases aspécifiques en un acide et un alcool quaternaire. Chez l’homme, cette hydrolyse est indépendante de l’activité des pseudocholinestérases plasmatiques. La part relative de chacune des deux voies de dégradation de l’atracurium reste discutée [84]. La voie de Hofmann serait prépondérante en cas de pH élevé, l’hydrolyse jouant un rôle plus important en cas de baisse du pH. La demi-vie de dégradation de l’atracurium est identique dans le plasma de sujets normaux et dans celui de patients porteurs d’un déficit en pseudocholinestérases [76]. Les produits de dégradation obtenus par cette voie présentent des effets ganglioplégiques et myorelaxants mais à des doses très supérieures à celles retrouvées après administration de doses usuelles d’atracurium.La décroissance des concentrations plasmatiques peut être décrite par un modèle ouvert bicompartimental avec dégradation par la voie de Hofmann dans les deux compartiments. Sa clairance plasmatique est proche de 5 mL/min/kg [84, 236], le volume de distribution à l’équilibre varie selon les études entre 87 et 141 mL/kg. Ces paramètres expliquent la courte demi-vie d’élimination de l’atracurium, proche de 20 minutes, ce qui est inférieur à celle des autres curares non dépolarisants de durée d’action intermédiaire, à l’exception du cisatracurium. Une seule étude s’est intéressée aux trois groupes d’isomères (Cis-Cis, Cis-Trans, Trans-Trans) et n’a pas mis en évidence de différence pharmacocinétique entre les trois groupes [227].
- Pharmacologie clinique
La DA50 est proche de 130 μg/kg chez l’homme, sa DA95 à l’adducteur du pouce est d’environ 200 μg/kg lors d’une anesthésie balancée. À cette dose, le délai d’action au niveau de l’adducteur du pouce est de 4 minutes, il est compris entre 3 et 4 minutes après un bolus de 300 μg/kg [8]. Le délai d’action au niveau des cordes vocales est de 2,2 minutes après un bolus de 500 μg/kg [229]. Le délai d’action au niveau du diaphragme (fig 7) [181] est comparable à celui des muscles laryngés. À l’opposé, les muscles des voies aériennes supérieures sont très sensibles aux effets des curares non dépolarisants. Après administration d’une faible dose d’atracurium (50 μg/kg), il existe une paralysie incomplète des muscles des voies aériennes impliqués dans la déglutition alors que des muscles périphériques, tels ceux de la main, ne sont pas curarisés [52]. Ces résultats expliquent pourquoi en cas de curarisation résiduelle, même minime, des muscles périphériques, le risque de survenue d’une détresse respiratoire par obstruction des voies aériennes supérieures existe car certains muscles impliqués dans la perméabilité des voies aériennes supérieures se décurarisent plus tardivement que l’adducteur du pouce.La durée d’action totale au niveau du pouce est d’une trentaine de minutes à la dose de 200 μg/kg [8] ; elle atteint 50-60 minutes après un bolus de 500 μg/kg. L’index de récupération reste constant en fonction de la dose, il est en moyenne de 11 à 12 minutes.
Des réinjections de 100 à 200 μg/kg ont une durée d’action clinique de 20 à 35 minutes. Il n’y a pas d’allongement progressif de cette durée d’action ainsi que de l’index de récupération en cas de réinjections multiples, ce qui traduit l’absence d’effets cumulatifs [5]. L’atracurium peut être utilisé en perfusion continue en raison de l’absence d’accumulation. Après administration d’un bolus, le débit de perfusion pour maintenir une dépression de 90 % de la force musculaire de l’adducteur du pouce est compris entre 4 et 10 μg/kg/min. L’index de récupération et le débit de perfusion restent constants quelle que soit la durée de perfusion ainsi que chez les patients âgés de plus de 60 ans [50].
La curarisation induite par l’atracurium est facilement antagonisable par les anticholinestérasiques. Une dose de 2,5 mg de néostigmine administrée quand l’adducteur du pouce est paralysé de 90 % permet d’obtenir un rapport T4/T1 égal à 70 % en 8 minutes alors que le délai est de 25 minutes en cas de décurarisation spontanée [107]. Si l’édrophonium est d’action plus rapide que la néostigmine, ses effets s’épuisent plus rapidement. Une récupération d’au moins 25 % de la force musculaire du pouce (quatre réponses au train-de-quatre) est nécessaire pour antagoniser complètement avec l’édrophonium le bloc induit par l’atracurium [89]. Comme c’est le cas pour tous les curares non dépolarisants, l’administration d’un anticholinestérasique en cas de curarisation profonde ne permet pas d’accélérer la décurarisation. L’injection de néostigmine, quand il n’y a que cinq à six réponses au compte post-tétanique, s’accompagne d’une récupération d’un rapport T4/T1 en 23 minutes en moyenne avec des extrêmes compris entre 19 et 41 minutes [79].
- Influence du terrain
– ÂgeLa DA95 de l’atracurium est comprise entre 170 et 280 μg/kg chez l’enfant. Les valeurs retrouvées chez le nourrisson sont un peu plus faibles, comprises entre 156 et 230 μg/kg selon le type d’anesthésie employé. La dose d’intubation recommandée est de 500-600 μg/kg. La DA95 de l’atracurium est plus basse chez le nouveau-né que chez les enfants plus âgés [157], ce qui s’accompagne d’une diminution de 25 % des débits de perfusion pour avoir le même degré de bloc [118]. La durée d’action est plus courte chez l’enfant ou le nourrisson que chez l’adulte, un bolus de 300 μg/kg ayant une durée d’action totale de 32 minutes [29]. Il n’a pas été mis en évidence de différence pharmacocinétique entre les enfants et les adultes, le volume de distribution à l’équilibre et la clairance d’élimination étant de 129 mL/kg et 6,8 mL/kg/min chez l’enfant. L’augmentation du volume de distribution chez le nourrisson (210 mL/kg) est contrebalancé par une augmentation de la clairance (7,9 mL/kg/min), d’où l’absence de modification de la demi-vie d’élimination de l’atracurium (20 min) [83].
La durée d’action, la vitesse de perfusion et l’index de récupération ne diffèrent pas significativement chez les patients de plus de 60 ans par rapport à des adultes plus jeunes [50]. L’absence d’altération de la clairance plasmatique chez le sujet âgé est probablement expliquée par le mode de dégradation de l’atracurium, indépendant de la fonction rénale.
- Insuffisance rénale
Il n’a pas été mis en évidence de différences pharmacocinétiques ou pharmacodynamiques importantes au cours de l’insuffisance rénale [54, 82]. La laudanosine, étant à élimination rénale, peut s’accumuler en cas d’insuffisance rénale sévère mais les concentrations restent très inférieures au seuil convulsivant. Sa demi-vie d’élimination est de 234 minutes au cours de l’insuffisance rénale sévère [236]. D’après les paramètres pharmacocinétiques de la laudanosine, une administration d’atracurium pendant plusieurs heures serait responsable de l’apparition d’une concentration de laudanosine aux environs de 1,6 μg/mL ce qui est très inférieur au seuil convulsivant [236].
- Insuffisance hépatique
La durée d’action de l’atracurium n’est pas modifiée en cas d’insuffisance hépatique [13, 207] en raison de l’élimination indépendante de la fonction hépatique. La demi-vie d’élimination de l’atracurium chez des patients présentant une hépatite fulminante est de 23 minutes. Il existait chez ces patients une augmentation de 30 % du volume de distribution traduisant l’augmentation du secteur hydrique extracellulaire [237].
- Température
La température peut avoir un retentissement sur la curarisation induite par l’atracurium en raison de son influence sur la vitesse de dégradation par la voie de Hofmann. Au cours des circulations extracorporelles, le débit de perfusion nécessaire pour maintenir une curarisation profonde diminue de 40 % quand la température centrale descend à 25-26 °C [87].
- Effets secondaires
Chez l’homme, l’administration d’une dose de 600 μg/kg multiplie par deux les concentrations plasmatiques d’histamine. L’index DA50 histamine/DA95 à l’adducteur du pouce est aux environs de 2-3 [10]. Les manifestations cliniques induites par l’histaminolibération sont comparables à celles liées à l’administration de mivacurium. Elles peuvent être prévenues par une injection lente en 30 secondes. Il importe d’autre part de ne pas dépasser une posologie d’atracurium de 600-800 μg/kg.L’atracurium est dénué d’effet ganglioplégique ou sympathomimétique, même à des doses très supérieures aux doses curarisantes [106]. Son action vagolytique est faible, le rapport DA50 vagolytique/DA50 curarisante est de 24 chez le chat. Chez l’homme, la pression artérielle moyenne, la fréquence cardiaque demeurent inchangées après un bolus de 600 μg/kg, la pression capillaire pulmonaire diminuant de 16 %. Il faut une dose de 1 200 μg/kg pour voir apparaître une baisse transitoire de la pression artérielle moyenne (10 %) associée à une élévation de la fréquence cardiaque (10 %) et à une baisse des résistances artérielles systémiques (16 %) vraisemblablement liée à une histaminolibération [103].
- Utilisation clinique
La dose recommandée pour l’intubation est de 400-500 μg/kg. L’entretien de la curarisation peut se faire par des bolus de 100 μg/kg dont la durée d’action clinique est d’une vingtaine de minutes. Le maintien de la curarisation par une perfusion continue d’atracurium est possible car il est de durée d’action intermédiaire et dépourvu d’effets cumulatifs. Le débit nécessaire en perfusion continue pour maintenir une paralysie de 90 % de l’adducteur du pouce est compris entre 5 et 10 μg/kg/min. En cas d’administration continue, les variations interindividuelles de sensibilité imposent le recours systématique au monitorage de la curarisation pour adapter le débit de perfusion et éviter tout risque de sur- ou sous-dosage. La perfusion ne doit être démarrée qu’après début de la récupération spontanée (une réponse au train-de-quatre par exemple) ce qui permet d’avoir une indication utile sur la sensibilité du patient et la vitesse de perfusion nécessaire. Les adaptations du débit de perfusion peuvent être réalisées en fonction de la réponse au train-de-quatre et de la profondeur souhaitée de la curarisation. Un débit de perfusion stable est obtenu avec l’atracurium en 30 minutes environ [49]. L’utilisation d’halogénés, surtout en cas d’intervention prolongée, entraîne une diminution des débits de perfusion pour avoir le même degré de paralysie.Outre les indications habituelles des curares non dépolarisants, l’atracurium est plus spécifiquement indiqué en cas d’insuffisance rénale ou hépatique du fait de son mode d’élimination indépendant de ces deux organes. Son intérêt, chez le sujet âgé, réside dans l’absence d’allongement de la vitesse de décurarisation.
Son utilisation doit être prudente, en cas de terrain atopique ou allergique, en raison des risques plus importants d’histaminolibération chez ces patients.
- Cisatracurium (Nimbex®)
Le cisatracurium est l’un des dix isomères de l’atracurium (fig 4). Il fait donc partie de la classe des benzylisoquinolines. Son intérêt essentiel repose sur une histaminolibération moindre que celle liée à l’atracurium. Il est donc attendu que cette nouvelle molécule provoque moins d’effets hémodynamiques à doses élevées que l’atracurium.
- Métabolisme et pharmacocinétique
Comme l’atracurium, le cisatracurium est hydrolysé dans le plasma principalement par la voie de Hofmann, indépendamment des fonctions hépatiques et rénales. En revanche, la voie métabolique impliquant les estérases plasmatiques ne joue qu’un rôle limité chez l’homme [243]. In vitro, la demi-vie de dégradation du cisatracurium dans le plasma est de 29 minutes. Les deux métabolites terminaux produits sont la laudanosine et un alcool monoquaternaire dénué d’effet myorelaxant. L’alcool monoquaternaire résulte de l’hydrolyse par les estérases plasmatiques de l’acrylate produit initialement par la voie de Hofmann. Le cisatracurium étant quatre à cinq fois plus puissant que l’atracurium, les doses administrées sont moindres et la production de laudanosine est inférieure à celle induite par l’administration d’atracurium. En cas de perfusion continue de plus de 24 heures chez le patient de réanimation, la concentration plasmatique de laudanosine atteint 4,4 μg/mL, en cas d’utilisation d’atracurium, alors qu’elle n’est que de 1,3 μg/mL en cas d’administration de doses équipotentes de cisatracurium. Moins de 15 % de la dose administrée de cisatracurium est retrouvée sous forme inchangée dans les urines. Le volume de distribution se limite au secteur hydrique extracellulaire (144 mL/kg), la clairance plasmatique totale est de l’ordre de 5,3 mL/min/kg, et la demi-vie d’élimination est comprise entre 22 et 25 minutes [141]. Ces données sont comparables avec celles de l’atracurium. Les caractéristiques pharmacocinétiques ne sont pas significativement modifiées par l’âge [176]. En cas d’insuffisance rénale, alors que le volume de distribution reste stable, la clairance plasmatique totale augmente de 13 % par rapport aux patients normaux [75].
- Pharmacologie clinique
La DA50 et la DA95 sont respectivement égales à 29 μg/kg et 48 μg/kg [14]. La dose d’intubation devrait être égale à 100 μg/kg. Cependant, la dose recommandée est de l’ordre de 150 μg/kg soit trois fois la DA95, ce qui permet d’obtenir de bonnes conditions d’intubation 120 secondes après l’injection. Le délai d’installation de la curarisation au niveau de l’adducteur du pouce est plus long avec le cisatracurium (5,2 min) qu’avec l’atracurium (3,2 min) à doses équipotentes (100 μg/kg et 500 μg/kg pour le cisatracurium et l’atracurium respectivement). L’augmentation de la dose initiale raccourcit le délai d’installation. Ainsi, après une dose de 200 μg/kg (soit cinq fois la DA95), le délai est de 2,7 minutes à l’adducteur du pouce [14].La durée d’action clinique d’un bolus de 100 μg/kg est de 45 minutes, durée comparable à celle de l’atracurium à dose équipotente. La récupération d’un train-de-quatre supérieur à 70 % est de 67 minutes en moyenne. La durée d’action clinique passe à 68 minutes pour une dose de 200 μg/kg [14]. L’entretien de la curarisation peut être réalisé soit par des bolus répétés (un bolus de 30 μg/kg permet l’obtention d’un bloc satisfaisant de l’ordre de 20 min), soit par l’utilisation d’une perfusion continue. Le débit moyen de la perfusion pour maintenir une paralysie de 90 à 99 % de l’adducteur du pouce est de 1,5 μg/kg/min pour des durées de perfusion continue comprises entre 11 et 249 minutes. L’index de récupération reste constant, quelle que soit la durée d’administration, ce qui traduit l’absence d’effets cumulatifs vraisemblablement liée à la dégradation du cisatracurium par la voie de Hofmann. En réanimation, un train-de-quatre supérieur à 70 % est obtenu en 68 minutes en moyenne après l’arrêt d’une perfusion d’une durée moyenne de 80 heures [190].
La néostigmine permet d’antagoniser efficacement le bloc neuromusculaire induit par le cisatracurium. Administrée après que l’adducteur du pouce a récupéré 10 % de la force musculaire, la néostigmine permet d’obtenir une récupération de 95 % de la force musculaire en 6,8 minutes, l’index de récupération étant proche de 3 minutes [14]. Un rapport T4/T1 supérieur à 70 % était obtenu en 9,3 minutes en moyenne quand la néostigmine était injectée à 10 % de récupération du bloc à l’adducteur du pouce.
- Influence du terrain
– ÂgeLa DA95 du cisatracurium, chez l’enfant au cours d’une anesthésie à l’halothane, est de 40 μg/kg. À la dose de 100 μg/kg, le délai d’installation et la durée d’action clinique sont respectivement de 4 et 30 minutes. Comme chez l’adulte, le cisatracurium n’a pas d’effets cumulatifs, l’index de récupération est en moyenne de 11 minutes. L’administration de néostigmine, quand le pouce a récupéré au moins 25 % de sa force musculaire, permet d’obtenir un rapport T4/T1 supérieur à 70 % en 2,5 minutes. Le cisatracurium ne provoque pas de variation significative des paramètres hémodynamiques chez l’enfant.
Les paramètres pharmacodynamiques du cisatracurium sont peu modifiés chez le vieillard. Le délai d’installation de la curarisation est plus long d’environ 1 minute chez les sujets âgés par rapport aux patients plus jeunes. La diminution de 15 % de la keo chez le vieillard serait la conséquence de la baisse du débit cardiaque chez le patient âgé, elle permet d’expliquer l’allongement du délai d’action avec l’âge [217]. La durée d’action clinique est prolongée de 4 minutes chez les sujets âgés, après administration d’un bolus de 100 μg/kg de cisatracurium mais cette différence n’est pas cliniquement significative. Il existe un discret allongement de la demi-vie d’élimination chez le sujet qui serait lié à l’augmentation du volume apparent de distribution (+ 17 %). La clairance plasmatique est inchangée, ce qui confirmerait le faible rôle joué par le rein dans l’élimination du cisatracurium [176, 217].
- Insuffisance rénale
En cas d’insuffisance rénale sévère, le délai d’installation de la paralysie est discrètement prolongé. Il n’y a pas d’allongement de la durée d’action clinique, en revanche la durée d’action totale et l’index de récupération sont modérément allongés de 10 % et 34 % respectivement au cours de l’insuffisance rénale [27]. Ces observations s’expliquent par une baisse de 13 % de la clairance, le volume apparent de distribution restant inchangé. Il en résulte un allongement de 4 minutes de la demi-vie d’élimination. Les concentrations plasmatiques de laudanosine chez l’insuffisant rénal, après administration de cisatracurium, restent basses (33 ng/mL) [75].
- Insuffisance hépatique
En présence d’une insuffisance hépatocellulaire, le délai d’installation de la curarisation est allongé par rapport aux patients normaux (3,3 versus 2,4 min). La durée d’action clinique et la durée d’action totale sont allongées par rapport aux patients normaux de 7 et 5 minutes respectivement, l’index de récupération restant constant. Comme avec les autres curares non dépolarisants, le volume apparent de distribution est augmenté de 21 %. La demi-vie d’élimination ne varie pas en raison d’une augmentation concomitante de 16 % de la clairance d’élimination [114].
- Effets secondaires
Bien que le cisatracurium soit un des dix isomères constitutifs de l’atracurium, il n’est que très faiblement histaminolibérateur. Après injection de cisatracurium, même pour des doses égales à huit fois la DA95, l’élévation de l’histaminémie reste largement inférieure à celle induite par l’atracurium, aucun des patients de cette série n’ayant présenté de signes cliniques d’histaminolibération [139]. Le cisatracurium n’entraîne que peu de variations hémodynamiques, même à fortes doses. Le rapport DA50 vagolytique/DA95 neuromusculaire est de 27 chez le chat. Ni la pression artérielle ni la fréquence cardiaque ne varient significativement pour des doses de cisatracurium égales à huit fois la DA95 (400 μg/kg) [139]. Chez les patients devant être opérés d’un pontage aortocoronarien, les variations hémodynamiques provoquées par l’administration de 100 μg/kg de cisatracurium ou de vécuronium sont comparables. De plus, l’injection rapide de cisatracurium (5-10 s) ne modifie pas la stabilité hémodynamique [126].
- Utilisation clinique
La dose recommandée de cisatracurium pour l’intubation est de 150 μg/kg. À cette posologie, le délai d’action et d’intubation est comparable à celui de l’atracurium mais la durée d’action est plus longue que celle du vécuronium ou de l’atracurium. Il tire son intérêt, en cas d’interventions de longue durée, de l’absence d’accumulation que ce soit en cas de bolus répétés ou d’administration continue comme en témoigne un index de récupération indépendant de la dose. Étant plus puissant que l’atracurium, les doses administrées sont moindres et la production de laudanosine est inférieure à celle induite par l’administration d’atracurium. L’absence d’effets hémodynamiques en fait un curare de choix en cas d’atteinte cardiovasculaire ou d’état de choc. Il peut être utilisé en cas d’insuffisance hépatique ou rénale sévère car son métabolisme est indépendant des fonctions hépatiques et rénales.Son utilisation est possible chez le patient de réanimation quand une curarisation est nécessaire, d’autant que ses métabolites n’ont pas d’effets myorelaxants et que sa dégradation est indépendante de l’état rénal ou hépatique. C’est le seul curare non dépolarisant qui possède actuellement l’autorisation de mise sur le marché (AMM) dans cette indication.
- Vécuronium (Norcuron®)
Le vécuronium est un curare stéroïdien dont la structure dérive de celle du pancuronium (fig 8).
- Métabolisme et pharmacocinétique
Le vécuronium est peu fixé aux protéines plasmatiques, environ 30 % [73]. Il est métabolisé par le foie par désacétylation en position 3 et 17. Le 3-désacétylvécuronium a des propriétés curarisantes, sa puissance étant comprise entre 50 et 100 % de celle du vécuronium selon les espèces [34]. Le 3-17 bis-désacétylvécuronium a des propriétés curarisantes 60 fois inférieures à celles du vécuronium. La captation hépatique du vécuronium est rapide, le rein ne jouant qu’un faible rôle dans l’élimination. Après administration d’un bolus de 150 μg/kg, chez l’homme, environ 40 % sont retrouvés sous forme inchangée dans la bile [15]. La captation hépatique importante entraîne une baisse rapide des concentrations plasmatiques de vécuronium lors de la phase de distribution. L’élimination rénale joue un rôle moins important, 20 à 30 % de la dose administrée seraient éliminés par cette voie [15]. Chez le patient sain, le 3-désacétylvécuronium n’est pas détectable dans le plasma [16, 15] et moins de 5 % de la dose de vécuronium injectée sont retrouvés sous cette forme dans les urines [16]. La clairance du 3-désacétylvécuronium est abaissée de 50 % par rapport à celle du vécuronium ce qui, associé à un volume de distribution plus important, explique que sa demi-vie d’élimination soit plus longue que celle du vécuronium [34]. L’absence ou les quantités négligeables de 3-désacétylvécuronium retrouvées dans le plasma, après administration de vécuronium, seraient liées à son élimination biliaire ou à son stockage hépatique prédominant. Chez le chat, l’existence d’une insuffisance hépatique entraîne une baisse de la clairance d’élimination et un allongement du bloc neuromusculaire lié à l’administration de 3-désacétylvécuronium [204]. Chez l’homme, le 3-désacétylvécuronium ne contribue pas au bloc neuromusculaire lié au vécuronium, à l’exception d’une éventuelle administration prolongée de fortes doses de vécuronium chez des patients de réanimation pour lesquels les capacités de captation hépatique seraient saturées [203].Dans les minutes suivant l’administration de vécuronium, la décroissance des concentrations plasmatiques est plus rapide qu’avec d’autres curares stéroïdiens, tel le pancuronium. Cette baisse est liée à une distribution initiale plus rapide ainsi qu’une clairance importante comprise entre 3 et 5 mL/min/kg [81, 216]. Le volume apparent de distribution est proche de 480 mL/kg alors que celui du pancuronium est de 290 mL/kg. La demi-vie d’élimination du vécuronium est de 116 minutes mais sa durée d’action est comparable à celle de l’atracurium en raison d’une distribution initiale importante avec baisse rapide des concentrations plasmatiques permettant d’atteindre rapidement des concentrations à partir desquelles la décurarisation apparaît [216] (fig 3).
- Pharmacologie clinique
Chez l’homme, au cours d’une anesthésie balancée, la DA50 du vécuronium est de 24 μg/kg, la DA95 à l’adducteur du pouce est proche de 40 μg/kg [129, 143]. Le délai d’action est de 3,4 minutes après un bolus de 100 μg/kg [96]. La DA90 du vécuronium est d’environ 80 μg/kg au niveau des muscles adducteurs laryngés [66]. Après administration d’un bolus de 100 μg/kg, le délai d’action est de 1,6 minute au niveau du diaphragme [36]. Comme c’est le cas avec l’atracurium, de faibles doses de vécuronium (10 μg/kg) entraînent une paralysie partielle des muscles impliqués dans la déglutition sans paralysie détectable des muscles de la main [52].La durée d’action clinique à l’adducteur du pouce est de 30 à 40 minutes, après injection d’un bolus de 100 μg/kg. L’index de récupération est de 12 minutes à l’adducteur du pouce aux doses usuelles, il reste constant en fonction de la dose [2, 16]. Une récupération de 25 % de la force musculaire des muscles adducteurs laryngés est obtenue 12 minutes en moyenne avant celle de l’adducteur du pouce après une dose de 70 μg/kg de vécuronium [66]. Des résultats comparables ont été observés avec le diaphragme.
Des réinjections de 25 μg/kg entraînent une durée d’action clinique de 15 à 20 minutes [31]. Cet intervalle reste constant au fil des réinjections, ce qui traduit l’absence d’effets cumulatifs avec le vécuronium. De même, en cas d’administration continue, la dose nécessaire pour maintenir un niveau constant de curarisation reste stable dans le temps.
Le bloc neuromusculaire induit par le vécuronium est facilement et rapidement antagonisable par la néostigmine. L’administration de néostigmine, quand les quatre réponses au train-de-quatre sont présentes, permet d’obtenir un rapport T4/T1 supérieur à 0,7 en moins de 4 minutes [168]. Comme c’est le cas avec l’atracurium, l’édrophonium a un délai d’action plus rapide que celui de la néostigmine mais ne permet pas d’obtenir un rapport T4/T1 supérieur à 70 % chez tous les patients [168].
- Influence du terrain
– ÂgeLa DA95 du vécuronium est voisine de 80 μg/kg chez l’enfant entre 3 et 10 ans au cours d’une anesthésie balancée, alors qu’elle n’est que de 55 μg/kg chez l’adolescent [163]. La DA95 est abaissée de 40 % chez le nourrisson par rapport à l’enfant [163]. Les raisons de cette résistance de l’enfant au vécuronium comme aux autres curares non dépolarisants n’ont pas reçu d’explication claire pour l’instant mais ces valeurs justifient l’emploi d’une dose d’intubation comprise entre 70 et 120 μg/kg chez l’enfant pour le vécuronium. Après administration d’un bolus de 100 μg/kg, le délai d’action est en moyenne de 70 secondes chez le nourrisson versus 107 secondes chez l’enfant âgé de 3 à 10 ans [119]. Le raccourcissement de ce délai chez le nourrisson serait lié à l’augmentation relative du débit cardiaque dans les premiers mois de vie. Après injection d’une dose de 100 μg/kg, la récupération d’une force musculaire de 10 % au pouce est obtenue en 15 minutes chez l’enfant âgé de 3 à 10 ans versus 24 minutes chez l’enfant de 1 à 3 ans et 42 minutes chez le nourrisson [119]. Les différences pharmacocinétiques sont peu importantes entre enfants et adultes, il existe une diminution de 30 % du volume apparent de distribution chez l’enfant par rapport à l’adulte, les clairances étant comparables. En revanche, le volume apparent de distribution chez le nourrisson est plus élevé (360 mL/kg) ce qui serait lié à l’importance du secteur hydrique extracellulaire dans la première année de vie [85]. L’augmentation du volume apparent de distribution chez le nourrisson contribuerait à l’allongement de la durée d’action du vécuronium observé dans la première année de vie.
Il n’existe pas d’augmentation de la sensibilité au vécuronium chez le vieillard. En revanche, Lien a mis en évidence un allongement significatif de la durée d’action et de l’index de récupération chez des patients âgés de plus de 70 ans par rapport à des adultes jeunes. Cet allongement des durées a une origine pharmacocinétique et est lié à un abaissement de la clairance d’élimination chez le vieillard par rapport aux patients plus jeunes. La baisse de la clairance s’explique par l’altération des débits et des fonctions rénales et hépatiques liée au vieillissement. Le volume apparent de distribution étant conservé, la demi-vie d’élimination est prolongée de 60 % chez le vieillard [140]. Le débit de perfusion chez les patients âgés de plus de 60 ans doit être diminué d’au moins 30 % [51].
- Insuffisance rénale
En raison de son mode d’élimination hépatique prédominant, l’utilisation du vécuronium a été proposée chez l’insuffisant rénal sévère. La durée d’action clinique d’un bolus de 100 μg/kg est modérément allongée en cas d’insuffisance rénale sévère (29,6 min) par rapport aux sujets sains (23,6 min). La baisse de 20 % de la clairance d’élimination chez l’insuffisant rénal sans modification concomitante du volume apparent de distribution entraîne un allongement modéré de la demi-vie d’élimination (15 %) [16]. En cas d’injections répétées du quart de la dose initiale, il existe un allongement progressif de la durée d’action clinique qui passe de 11 à 16 minutes à la sixième réinjection chez l’insuffisant [137]. Il a été démontré par d’Honneur que la néostigmine pouvait être utilisée en cas d’insuffisance rénale, et qu’elle restait aussi active que chez les sujets sains en cas de curarisation induite par le vécuronium [53].
- Insuffisance hépatique
La demi-vie d’élimination du vécuronium passe de 55 à 73 minutes en cas de cirrhose. Cet allongement est la conséquence d’une baisse de la clairance d’élimination, le volume apparent de distribution restant inchangé [135] de même que la fixation aux protéines plasmatiques [73]. La réponse des patients cirrhotiques au vécuronium dépend de la dose. Jusqu’à une dose de 100 μg/kg, la durée d’action n’est pas allongée chez le cirrhotique [115]. Ces résultats s’expliqueraient par le fait que la distribution reste le principal facteur limitant de la durée d’action à ces doses. En revanche, pour de fortes doses (200 μg/kg), la durée d’action clinique passe de 67 à 95 minutes et l’index de récupération est deux fois plus long chez le cirrhotique [115, 135]. La clairance d’élimination du vécuronium est abaissée de 45 % en cas de cholestase, le volume apparent de distribution restant inchangé [136]. Après injection d’un bolus de 200 μg/kg, la durée d’action clinique est prolongée, atteignant 80 minutes en cas de cholestase au lieu de 53 minutes dans le groupe contrôle. Ces perturbations seraient secondaires à l’accumulation plasmatique des sels biliaires qui diminueraient la captation hépatique du vécuronium et son élimination [244].
- Obésité
Le volume apparent de distribution et la clairance d’élimination du vécuronium sont abaissés chez l’obèse quand ils sont calculés en fonction du poids corporel. En revanche, quand ces valeurs sont normalisées en tenant compte de la surface corporelle, il n’existe plus de différence par rapport aux sujets sains. Il n’a pas été mis en évidence de différence de sensibilité en cas d’obésité. La prolongation de la durée de curarisation et de l’index de récupération, chez le patient obèse, est liée à la prescription de doses plus importantes quand la prescription est faite en fonction du poids [202].
- Effets secondaires
L’histaminolibération pharmacologique est quasi inexistante après injection de vécuronium, comme c’est le cas avec les curares stéroïdiens.Le vécuronium, même à des doses dix fois supérieures aux doses curarisantes, est dénué d’effets ganglioplégiques [69]. Les effets sympathomimétiques du vécuronium sont inexistants, contrairement au pancuronium. Ils apparaissent pour des doses 33 fois supérieures à celles du pancuronium, de plus le vécuronium n’inhibe pas le recaptage neuronal des catécholamines [152]. Le rapport DA50 vagolytique/DA50 curarisante est de 96 chez le chat, ce qui traduit son absence d’action vagolytique [70]. Quelle que soit l’espèce étudiée, les effets hémodynamiques du vécuronium sont très discrets. Chez l’homme, l’administration de doses élevées allant jusqu’à 300 μg/kg n’entraîne pas de modification de la fréquence cardiaque ou de la pression artérielle [144]. Certains auteurs ont rapporté des épisodes de bradycardie importante lors d’inductions anesthésiques dans lesquelles étaient utilisé le vécuronium. Il s’agissait dans tous les cas d’anesthésie avec des morphinomimétiques parfois à fortes doses ; leur responsabilité dans la survenue de la bradycardie est vraisemblable. Ces cas de bradycardie ne sont pas observés lors de l’utilisation de morphinomimétiques à doses modérées [45].
- Utilisation clinique
La dose recommandée pour l’intubation est comprise chez l’adulte entre 70 et 100 μg/kg. À cette posologie, la durée d’action clinique est d’une quarantaine de minutes. L’entretien de la curarisation fait appel à des bolus du quart de la dose initiale ou à une perfusion continue à la dose de 1 à 2 μg/kg/min. Les réinjections ou le débit de perfusion nécessaire sont guidés au mieux par l’utilisation du monitorage de la curarisation. Comme c’est le cas avec les autres curares non dépolarisants, le débit de perfusion sera diminué en cas d’utilisation d’agents halogénés.L’absence d’effets hémodynamiques du vécuronium en fait le curare de choix en cas d’état de choc, chez le patient coronarien ou hypertendu. Il est également proposé préférentiellement en cas de terrain atopique. En cas de contre-indication au suxaméthonium, il peut être proposé à fortes doses (six à huit fois la DA95) pour l’anesthésie du patient à l’estomac plein. Mais à cette dose, la durée d’action clinique est de 90 à 120 minutes. Le vécuronium doit être utilisé avec prudence et sous couvert du monitorage de la curarisation en cas d’insuffisance hépatique ou de cholestase.
- Rocuronium (Esmeron®)
Le rocuronium est un curare non dépolarisant stéroïdien, dérivé du vécuronium (fig 8), dont la principale différence tient en sa faible puissance, ce qui explique la rapidité d’installation de la curarisation. La plus faible puissance du rocuronium serait la conséquence de sa faible affinité pour les récepteurs cholinergiques nicotiniques.
- Métabolisme et pharmacocinétique
Le rocuronium, comme le vécuronium, est capté par le foie avant d’être éliminé par la bile, essentiellement sous forme non métabolisée. Chez l’animal, plus de 70 % sont éliminés sous forme inchangée dans la bile, moins de 30 % de la dose étant retrouvé dans les urines. Les métabolites du rocuronium (17-désacétylrocuronium et 16 N-désallylrocuronium) n’ont qu’une très faible activité pharmacologique et ne sont retrouvés dans le plasma qu’à de très faibles concentrations [167].Les paramètres pharmacocinétiques du rocuronium sont proches de ceux du vécuronium, à l’exception du volume de distribution à l’équilibre qui est de 270 mL/kg pour le rocuronium contre 410 mL/kg pour le vécuronium. La clairance plasmatique est d’environ 4 mL/kg/min, la demi-vie d’élimination est de 131 minutes dans l’étude de Wierda et al [247]. Comme c’est le cas pour le vécuronium, la terminaison de l’effet du rocuronium dépend essentiellement des processus de distribution.
- Pharmacologie clinique
Le rocuronium est environ cinq à huit fois moins puissant que le vécuronium, la DA95 à l’adducteur du pouce est d’environ 300 μg/kg pour le rocuronium [246]. Une dose de 500 μg/kg de rocuronium entraîne une paralysie complète de l’adducteur du pouce mais un bloc d’environ 80 % au niveau des muscles adducteurs laryngés (fig 9) [162]. Une dose de 600 μg/kg permet d’obtenir un bloc quasi complet des muscles respiratoires [35].Du fait de sa faible puissance, le délai d’installation est court. Pour une dose de 500 μg/kg, il est de 2,4 minutes au niveau de l’adducteur du pouce. Ce délai d’installation est environ deux fois plus bref que celui de l’atracurium ou du vécuronium [148]. Dans l’étude de Cooper, les conditions d’intubation étaient bonnes ou excellentes 60 secondes après l’administration de 600 μg/kg de rocuronium chez 19 des 20 patients étudiés. Elles étaient excellentes ou bonnes chez tous les patients intubés au bout de 90 secondes [41]. L’augmentation des doses raccourcit le délai d’action qui passe de 89 secondes à l’adducteur du pouce après une dose de 600 μg/kg à 75 et 55 secondes après injection d’une dose de 900 et 1 200 μg/kg respectivement [148].
La durée d’action clinique à l’adducteur du pouce, à la dose de 600 μg/kg est de 42 minutes, comparable à celle d’une dose équipotente de vécuronium [20]. La durée d’action clinique est d’une vingtaine de minutes au niveau du diaphragme après administration de 600 μg/kg [35]. L’augmentation des doses s’accompagne d’un allongement de la durée d’action qui atteint 53 minutes, au niveau du pouce, après un bolus de 900 μg/kg. L’index de récupération est compris entre 8 et 14 minutes.
En cas d’administration répétée, la durée d’action clinique de chaque réinjection (150 μg/kg) est d’une quinzaine de minutes. Elle atteint une vingtaine de minutes pour une dose de 200 μg/kg. Il n’apparaît qu’un discret allongement de cette durée d’action clinique au-delà de la troisième réinjection, ce qui traduit la faible accumulation de rocuronium chez l’homme [125]. L’index de récupération spontanée était d’environ 17 minutes après une durée de perfusion de 138 minutes dans l’étude de Sparr et al [218].
La décurarisation peut être accélérée par l’administration de néostigmine. L’injection de néostigmine lorsque la force musculaire de l’adducteur du pouce a atteint 25 % de la valeur contrôle, permet d’obtenir, en 5 minutes environ, une récupération de 90 % de la force musculaire de l’adducteur du pouce [230]. Un train-de-quatre égal à 70 % est obtenu en 6 à 8 minutes après l’injection de néostigmine à 25 % de récupération de la force musculaire.
- Influence du terrain
– ÂgeChez l’enfant âgé de 1 à 5 ans, la DA95 du rocuronium à l’adducteur du pouce est de 303 μg/kg, comparable à celle de l’adulte jeune. Un bloc de 100 % à l’adducteur du pouce est obtenu en moyenne en 78 secondes après l’administration d’un bolus de 600 μg/kg de rocuronium, ce qui est significativement plus court que chez l’adulte. Comme c’est le cas avec les autres curares non dépolarisants, ce délai est encore plus court chez le nourrisson (64 s avec des extrêmes allant de 20 à 180 s). Après un bolus de 600 μg/kg, la durée d’action clinique est de 27 minutes et l’index de récupération de 11 minutes. La durée d’action clinique est allongée chez le nourrisson (42 min), l’index de récupération atteint 27 minutes. Chez l’enfant, la néostigmine injectée quand l’adducteur du pouce a récupéré 25 % de sa force, entraîne un raccourcissement de l’index de récupération qui passe de 7,1 à 3,3 minutes [170]. Il n’existe pas de différence de puissance du rocuronium entre les sujets âgés et les adultes jeunes. En revanche, le délai d’action est significativement plus long à l’adducteur du pouce chez le sujet âgé (3,9 min) que chez le sujet jeune (2,7 min), ceci étant lié à la réduction du débit cardiaque avec l’âge. Une dose de 300 μg/kg de rocuronium a une durée d’action clinique et totale significativement plus longue chez le patient âgé que chez l’adulte jeune [17].
- Insuffisance rénale
Szenohradszky n’a pas mis en évidence, après administration d’un bolus de 600 μg/kg de rocuronium, de modification de la clairance plasmatique au cours de la transplantation rénale. Il existait une augmentation modérée du volume apparent de distribution (30 %) (fig 10) d’où un allongement de la demi-vie d’élimination au cours de la transplantation (97 min) [223]. Le délai d’installation de la paralysie n’était pas modifié chez l’insuffisant rénal par rapport aux sujets sains. Il n’existait pas dans cette étude d’allongement de la durée d’action, contrairement au travail de Cooper qui retrouvait une augmentation de 25 % de la durée d’action totale au cours de l’insuffisance rénale sévère, un train-de-quatre égal à 70 % étant obtenu en 99 minutes chez les patients insuffisants rénaux contre 73 minutes chez les sujets normaux [40]. Ces résultats imposent une utilisation prudente du rocuronium chez l’insuffisant rénal sévère, en particulier l’utilisation du monitorage de la curarisation pour guider les réinjections.
- Insuffisance hépatique
En cas de cirrhose (Child B), il existe un allongement du délai d’installation de la paralysie (158 s versus 108 s) qui s’expliquerait, comme c’est le cas pour les autres curares non dépolarisants, par une augmentation de volume du compartiment central (35 %). En revanche, il n’existe pas de modification significative de la sensibilité ainsi que de la clairance d’élimination. La demi-vie d’élimination est de 96 minutes chez le cirrhotique et de 88 minutes chez les patients normaux. Après administration d’un bolus de 600 μg/kg, la durée d’action totale est modérément prolongée chez le cirrhotique [124]. Dans l’étude de Magorian qui a porté essentiellement sur des patients de classification Child C, des résultats similaires ont été observés en termes de délai d’installation ou de clairance d’élimination. Il existait en revanche un allongement significatif de la demi-vie d’élimination qui passait de 75 à 111 minutes chez les patients cirrhotiques [149]. Ces modifications étaient secondaires à une augmentation du volume apparent de distribution chez le cirrhotique, ce qui s’expliquerait par l’augmentation du compartiment hydrique extracellulaire liée à la cirrhose.
- Effets secondaires
Le rocuronium, comme les autres curares stéroïdiens, n’entraîne pas d’histaminolibération aux doses utilisées en clinique. Lévy et al ont démontré l’absence d’élévation de l’histaminémie plasmatique dans les minutes suivant l’administration de rocuronium, même à des doses allant jusqu’à 1 200 μg/kg [138]. En revanche, il peut, comme tout autre curare, être responsable d’accident anaphylactique. La réactivité cutanée, lors de tests réalisés chez des patients allergiques à un curare au moins, est apparue superposable à celle obtenue avec les autres curares non dépolarisants stéroïdiens. Laxenaire et al ont démontré qu’une réaction cutanée obtenue avec un test intradermique dilué à 10-1 pourrait être considérée comme un indicateur de faible réactivité croisée [132]. Il a été montré, chez l’animal, que le rocuronium n’entraînait pas de variations hémodynamiques aux doses usuelles. Il est dénué d’effets ganglioplégiques ou sympathomimétiques et n’inhibe pas le recaptage des catécholamines. Une tachycardie peut apparaître (+ 5 %) chez le chien pour des doses égales ou supérieures à cinq fois la DA95. Le rapport DA50 vagolytique/DA50 neuromusculaire est de 7, le rapport DA50 ganglioplégique/DA50 neuromusculaire est de 22 [171]. Chez l’homme, l’administration de doses comprises entre deux et trois fois la DA95 à l’adducteur du pouce n’a que très peu d’effets hémodynamiques. Dans l’étude de Cornet et al, il n’a pas été observé de variation de la pression artérielle moyenne, de la fréquence cardiaque, de la pression d’occlusion de l’artère pulmonaire ou de l’index cardiaque, après administration d’un bolus de 900 μg/kg de rocuronium [44].
- Utilisation clinique
Le rocuronium peut être utilisé de la même façon et avec les mêmes indications générales que le vécuronium ou l’atracurium, mais avec l’avantage d’un délai d’action plus bref. La dose recommandée est de 600 μg/kg, elle permet d’obtenir de bonnes conditions d’intubation, comparables à celles obtenues avec la succinylcholine, en 60-90 secondes [41] pour une durée d’action clinique d’une trentaine de minutes. L’entretien de la curarisation peut être réalisé par des réinjections du quart de la dose initiale (150 μg/kg) ou par une perfusion débutée à la dose de 5-10 μg/kg/min. En cas d’utilisation d’une perfusion continue, le monitorage de la curarisation est indispensable pour adapter le débit de perfusion en raison de la variabilité interindividuelle. En cas d’utilisation d’agent halogéné, le débit de perfusion pour assurer le même degré de curarisation est diminué d’environ 30-50 %, selon la concentration, la durée d’administration et l’agent halogéné utilisé. Chez l’enfant de plus de 1 an, les réinjections seront plus fréquents que chez l’adulte, en raison du raccourcissement de la durée d’action clinique.Bien qu’il soit possible d’intuber dans de bonnes conditions 1 minute après son administration, le rocuronium n’est pas une alternative au suxaméthonium en cas d’anesthésie du patient à l’estomac plein en raison de sa durée d’action et des risques encourus si le patient ne peut être intubé. Le rocuronium peut être éventuellement employé chez le patient à l’estomac plein en cas de contre-indication au suxaméthonium.
- Curares de longue durée d’action
P-ancuronium (Pavulon®) (fig 8)
- Métabolisme et pharmacocinétique
D’origine stéroïdienne, la fixation du pancuronium aux protéines plasmatiques est peu importante, d’environ 30 % [73]. Elle n’est pas influencée par l’insuffisance hépatique ou rénale. Il est métabolisé dans le foie en 3-OH-pancuronium qui présente des propriétés myorelaxantes deux fois plus faibles que celles du pancuronium. C’est le seul métabolite détectable après administration de pancuronium. Il représente dans les urines 10 à 20 % de la dose totale et moins de 5 % dans la bile [3]. Chez le sujet sain, le pancuronium est éliminé essentiellement par le rein, 40 à 70 % de la dose administrée étant retrouvée dans les urines, essentiellement sous forme inchangée. La filtration glomérulaire est le principal mécanisme d’élimination. En raison de son ionisation importante dans les urines, une réabsorption tubulaire est improbable. De même, l’élimination biliaire est faible et ne joue pas un rôle important dans l’élimination du pancuronium.Que la cinétique du pancuronium soit décrite par un modèle pharmacocinétique bi- ou tricompartimental, le volume apparent de distribution est compris entre 260 et 284 mL/kg/min, c’est-à-dire proche du secteur hydrique extracellulaire. La clairance d’élimination est comprise entre 1,7 et 1,9 mL/kg/min. La demi-vie d’élimination varie de 110 à 140 minutes [46, 74]. Bien que la demi-vie d’élimination du pancuronium soit comparable à celle du vécuronium, sa durée d’action est nettement plus longue en raison de sa distribution et d’une baisse plus lente des concentrations plasmatiques dans les minutes suivant l’injection (fig 3).
- Pharmacologie clinique
La DA50 et la DA95 du pancuronium à l’adducteur du pouce sont de 30 et 53 μg/kg respectivement au cours de l’anesthésie balancée chez l’homme. Le rapport des DA50 diaphragme/DA50 adducteur du pouce est de 2 [61], ce qui est plus élevé que pour les autres curares non dépolarisants. La DA50 du pancuronium au niveau du masséter est abaissée de 15 % par rapport à celle de l’adducteur du pouce chez l’adulte [212]. À une dose proche de la DA95, le délai d’action est d’environ 5 minutes à l’adducteur du pouce. Il est de respectivement 4,2 et 1,8 minutes après administration d’une dose de 70 et 150 μg/kg [134]. Le délai d’action, au niveau du masséter, est abaissé de 16 % par rapport au pouce [212]. La durée d’action clinique est nettement supérieure à celles observées avec les curares non dépolarisants de durée d’action intermédiaire. Elle est en moyenne de 64 minutes après un bolus de 70 μg/kg et de 160 minutes après administration de 150 μg/kg. La durée d’action totale d’une dose de 70 μg/kg est de 99 minutes [11]. L’index de récupération est en moyenne de 47 minutes après injection d’un bolus de 70 μg/kg.Le bloc induit par le pancuronium peut être antagonisé par les anticholinestérasiques mais il faut tenir compte de la décurarisation spontanée plus lente avec le pancuronium qu’avec les curares non dépolarisants de durée d’action intermédiaire. Après administration de néostigmine quand la force musculaire était comprise entre 10 et 20 % de la valeur contrôle, il faut 10 à 20 minutes pour obtenir une récupération de 90 % de la force musculaire de l’adducteur du pouce [122]. Si l’édrophonium a un délai d’action plus bref que celui de la néostigmine, son utilisation n’est pas recommandée pour antagoniser les effets du pancuronium car sa durée d’action est inférieure à celle des autres anticholinestérasiques.
- Influence du terrain
– ÂgeLa DA95 du pancuronium est de 93 μg/kg chez l’enfant lors d’une anesthésie balancée alors qu’elle est de 77 μg/kg chez l’adolescent. La DA95 est de 72 μg/kg chez le nourrisson. Après administration d’une dose de 70 μg/kg, le délai d’installation de la paralysie est de 2,4 et 4,3 minutes respectivement chez l’enfant et l’adulte. Au cours d’une anesthésie avec de l’halothane, chez l’enfant, une dose de 100 μg/kg a une durée d’action de 92 minutes, l’index de récupération étant de 28 minutes. Les paramètres pharmacocinétiques, chez l’enfant âgé de 3 à 6 ans, sont comparables à ceux observés chez l’adulte [159].
La sensibilité du vieillard au pancuronium est comparable à celle de l’adulte jeune, le courbes dose-action étant superposables [74]. La clairance d’élimination est abaissée de 30 % chez le sujet âgé alors que le volume apparent de distribution est peu modifié. La baisse de la clairance semble liée à la baisse de la filtration glomérulaire observée chez le sujet âgé ; elle est responsable de l’allongement de la demi-vie d’élimination [74]. Les altérations pharmacocinétiques expliquent l’allongement de la durée d’action (66 %) et de l’index de récupération (59 %) chez le sujet âgé.
- Insuffisance rénale
La demi-vie d’élimination du pancuronium est augmentée de 500 % chez l’insuffisant rénal sévère par rapport au sujet sain. Cet allongement est essentiellement lié à la baisse de la clairance d’élimination, l’excrétion biliaire ne pouvant compenser la diminution d’élimination par voie rénale [154]. L’augmentation modérée du volume du compartiment central est secondaire à l’hyperhydratation liée à l’insuffisance rénale. L’administration d’un bolus de 80 μg/kg entraîne une durée d’action totale de 200 minutes en cas d’insuffisance rénale versus 120 minutes dans le groupe contrôle.
- Insuffisance hépatique
Bien que le foie ne soit pas le principal organe impliqué dans l’élimination du pancuronium, il existe une diminution de 25 % de la clairance plasmatique en cas de cirrhose. Elle est associée à une augmentation de 50 % du volume apparent de distribution qui expliquerait la " résistance " et l’allongement du délai d’action lors de l’administration de pancuronium chez le cirrhotique. La demi-vie d’élimination passe de 114 à 208 minutes en cas de cirrhose [72]. Il existe, en cas de cholestase, un allongement de 60 à 100 % de la demi-vie d’élimination lié selon les études à une augmentation du volume apparent de distribution ou une baisse d’environ 50 % de la clairance d’élimination. La captation hépatique du pancuronium pourrait être diminuée en cas de cholestase.
- Effets secondaires
Même à des doses huit fois supérieures aux doses myorelaxantes, le pancuronium est dénué d’activité ganglioplégique chez l’animal. Le rapport DA50 vagolytique/DA50 curarisante est de 5,1 chez le chat [110]. Chez le chien, l’administration d’une dose triple de la DA95 entraîne une élévation de 15 % de la fréquence cardiaque liée aux effets sympathomimétiques du pancuronium. En effet, le pancuronium entraîne une augmentation de la libération des catécholamines en inhibant les récepteurs présynaptiques muscariniques des terminaisons noradrénergiques ainsi que les interneurones dopaminergiques [23]. De plus, le pancuronium peut inhiber, mais à doses élevées, le recaptage intraneuronal des catécholamines. Chez l’homme, l’administration d’une dose de 100 μg/kg entraîne une augmentation d’environ 10 % de la fréquence cardiaque, de la pression artérielle systémique et de l’index cardiaque sans modifications des résistances vasculaires systémiques. L’effet tachycardisant est d’autant plus marqué que la fréquence cardiaque initiale est basse. En pratique cet effet est parfois recherché pour contrebalancer l’effet bradycardisant de fortes doses de morphinomimétiques.
- Utilisation clinique
La dose initiale de pancuronium est comprise entre 70 et 100 μg/kg ; elle entraîne une curarisation comprise entre 80 et 120 minutes. Les réinjections doivent être de un quart de la dose initiale. Les réinjections doivent être de plus en plus espacées dans le temps compte tenu des risques d’accumulation du pancuronium. Le monitorage de la curarisation permet d’adapter de façon optimale l’intervalle entre deux réinjections. L’antagonisation du bloc par la néostigmine ne doit être envisagée que quand les quatre réponses au train-de-quatre sont présentes en raison de la lenteur de la décurarisation spontanée sous pancuronium.Les indications du pancuronium sont limitées depuis l’apparition des curares non dépolarisants de durée d’action intermédiaire car la fréquence des curarisations résiduelles en salle de réveil est nettement plus importante [19]. Il reste utilisé en cas d’intervention de longue durée ou quand la ventilation postopératoire est souhaitée. La tachycardie qu’il entraîne est parfois gênante mais il reste utilisé par de nombreuses équipes en chirurgie cardiaque pour contrebalancer l’effet des hautes doses de morphinomimétiques. Il est contre-indiqué, en association avec l’halothane, chez les sujets traités par antidépresseurs tricycliques car, en élevant la concentration en catécholamines circulantes, il expose au risque d’arythmie ventriculaire sévère. Il est également contre-indiqué en cas de phéochromocytome.
- Curares ultracourts
– Org 9487L’Org 9487 est un curare stéroïdien dont la structure dérive directement de celle du vécuronium (fig 8). Les propriétés pharmacologiques de l’Org 9487 sont liées à sa faible puissance.
- Métabolisme, pharmacocinétique
Chez l’homme, l’Org 9487 semble être métabolisé dans le foie en 3-désacétyl- ou 3-hydroxy-Org 9487 qui est retrouvé dans le plasma puis dans les urines. Sa puissance est d’environ 50 % de celle de l’Org 9487. Au bout de 24 heures, 12 à 20 % d’une dose d’Org 9487 sont retrouvés dans les urines dont un tiers environ sous forme inchangée et deux tiers sous forme de 3-désacétyl-Org 9487. Des traces de 3,17-bisdésacétyl-Org 9487 peuvent être également retrouvées [245].Après administration d’un bolus de 1,5 mg/kg, le volume apparent de distribution est de 457 mL/kg et la clairance plasmatique de 11,1 mL/kg/min chez l’homme. La demi-vie d’élimination serait comprise entre 71 et 88 minutes [231, 245], ce qui est un peu plus court qu’avec le vécuronium ou le rocuronium. La courte durée d’action de l’Org 9487 par rapport aux autres curares s’expliquerait par l’importance de la distribution initiale [231].
- Pharmacologie clinique
La DA90 de l’Org 9487 à l’adducteur du pouce varie selon les études entre 1 et 1,15 mg/kg, chez l’homme, ce qui en fait un curare environ 30 fois moins puissant que le vécuronium. Après administration d’une dose de 1,5 mg/kg, le délai d’installation à l’adducteur du pouce est de 83 secondes [248]. Une dose de 1,5 mg/kg a une durée d’action clinique de 9 minutes et une durée d’action totale de 17 minutes. L’index de récupération est de 6 minutes. Un train-de-quatre supérieur à 70 % est obtenu en 23 minutes en moyenne [245]. En raison de sa durée d’action plus brève que celle des autres curares non dépolarisants, il a été proposé d’administrer la néostigmine (40 μg/kg) précocement 2 minutes après l’injection d’Org 9487. La durée d’action clinique est alors de 5,7 minutes et la durée d’action totale de 10,8 minutes. Un train-de-quatre égal à 70 % est obtenu en 12 minutes environ [248].La dose d’Org 9487 pour maintenir un bloc de plus de 80 % à l’adducteur du pouce lors d’une perfusion est d’environ 3,4 mg/kg/h. L’allongement du délai d’obtention d’un train-de-quatre supérieur à 70 % à l’arrêt de la perfusion par rapport à un bolus traduit l’accumulation de l’Org 9487 chez l’homme [231]. Cette accumulation pourrait être liée à la production de 3-hydroxy-Org 9487 ou plus vraisemblablement à la survenue de la récupération en phase d’élimination et non plus de distribution, d’où une baisse moins rapide des concentrations plasmatiques.
Les indications précises de l’Org 9487 ne sont pas encore définies avec précision mais il pourrait être amené à remplacer le suxaméthonium. Outre ses indications en cas d’anesthésie chez le patient à l’estomac plein, il pourrait être utilisé lors des interventions de courte durée mais où l’intubation est indiquée. La possibilité de pouvoir antagoniser les effets de l’Org 9487 par la néostigmine, 2 minutes après son administration, pourrait en faire un curare de choix en cas d’intubation difficile ou d’un autre problème prévu sur les voies aériennes.
- Curares dépolarisants
– Suxaméthonium (Célocurine®)
Synthétisé en 1906 par Hunt et de Taveau [113], il fallut attendre 1949 pour que ses propriétés curarisantes soient décrites chez l’animal. Brucke, von Dardel et Mayrhoffer furent les premiers à l’utiliser chez l’homme pour ses propriétés curarisantes [88]. C’est le seul curare non dépolarisant utilisé en France. La vitesse d’installation de la curarisation et la courte durée d’action restent inégalées mais ses effets secondaires limitent son utilisation.
- Propriétés physiocochimiques
Le suxaméthonium est formé de deux molécules d’acétylcholine unies par leurs radicaux quaternaires (fig 11). Les deux fonctions ammonium quaternaire sont distantes de 14 A. Fortement soluble dans l’eau, le suxaméthonium est dégradé par la chaleur, la lumière et les pH alcalins. Son poids moléculaire est de 544 Da. En raison de sa destruction à la chaleur, le suxaméthonium doit être conservé entre + 4 et + 10 °C.
- Métabolisme et pharmacocinétique
Il est difficile de déterminer la pharmacocinétique précise du suxaméthonium, en raison de problèmes analytiques liés à la dégradation plasmatique. En effet, le suxaméthonium est hydrolysé rapidement dans le plasma par les pseudocholinestérases ou butyrylcholinestérases en succinylmonocholine, dont les effets myorelaxants sont 40 fois plus faibles que ceux du suxaméthonium, puis plus lentement en acide succinique et choline [146]. La vitesse d’hydrolyse de la succinylcholine est estimée à environ 100 μg/kg/min [62]. La choline et la succinylmonocholine sont éliminées par filtration glomérulaire. La métabolisation hépatique est très lente, quant à l’hydrolyse plasmatique alcaline non enzymatique, elle n’a qu’un faible rôle et n’intervient qu’en cas de déficit en pseudocholinestérases.Après administration d’un bolus, les concentrations plasmatiques décroissent rapidement selon une cinétique d’ordre 1. Cette décroissance rapide est liée, outre l’hydrolyse plasmatique, à la distribution dans l’ensemble de l’organisme, seule une faible fraction de la dose administrée atteint la jonction neuromusculaire. La demi-vie du suxaméthonium serait comprise entre 3 et 4 minutes. Il n’y aurait pas de distribution par passage intracellulaire car le suxaméthonium est fortement ionisé au pH plasmatique. La constante d’élimination est plus importante chez le nourrisson et l’enfant que chez l’adulte. La demi-vie serait comprise entre 1,7 et 1,8 minutes.
- Mode d’action
Le suxaméthonium se fixe au niveau des deux sous-unités α du récepteur nicotinique cholinergique postsynaptique de la plaque motrice. Il entraîne une dépolarisation initiale de la membrane postsynaptique similaire mais de durée prolongée par rapport à celle déclenchée par l’acétylcholine. Alors que l’acétylcholine est rapidement détruite par l’acétylcholinestérase, la succinylcholine va rester plusieurs minutes au niveau de la fente synaptique, réagissant de façon répétée avec les récepteurs cholinergiques en les maintenant ouverts. Les potentiels de plaque induits par la succinylcholine ne se limitent pas à la plaque motrice elle-même mais s’étendent à la zone périjonctionnelle. Celle-ci se caractérise par la présence d’un grand nombre de canaux sodiques insensibles à l’acétylcholine mais qui peuvent être activés par un changement de potentiel, donc par le potentiel de plaque. C’est l’activation de ces canaux sodiques qui va produire le potentiel d’action qui se propagera sur toute la longueur de la fibre musculaire. Le processus d’inactivation de ces canaux sodiques est normalement rapide permettant le retour au potentiel de repos de la cellule car le potentiel de plaque ne dure que quelques millisecondes. En maintenant dépolarisée la plaque motrice, le suxaméthonium est responsable du maintien en état inactivé des canaux sodiques de la zone périjonctionnelle. Ces canaux vont agir comme une barrière, empêchant la propagation d’un potentiel d’action dans la fibre musculaire, d’où le bloc neuromusculaire [160]. Outre ce mécanisme, le suxaméthonium induit une désensibilisation des récepteurs cholinergiques. Le récepteur désensibilisé n’est pas activé même s’il y a deux molécules d’acétylcholine fixées sur les deux sous-unités α. La désensibilisation diminuerait l’effet des agonistes. Le mécanisme serait une phosphorylation du récepteur protéique par une kinase présente dans la membrane. Cette phosphorylation entraînerait un changement de conformation du canal ionique du récepteur, ce qui préviendrait tout mouvement ionique. Contrairement à un autre curare dépolarisant, le décaméthonium, le suxaméthonium ne bloque pas directement le canal ionique. Ces actions du suxaméthonium sont responsables du bloc de phase I observé après administration d’une dose unique [160]. Les fasciculations seraient liées à l’action présynaptique et à la dépolarisation des récepteurs cholinergiques présynaptiques induites par le suxaméthonium. La d-tubocurarine inhiberait les fasciculations en se fixant sur ces récepteurs présynaptiques.
- Pharmacologie clinique
– PuissanceChez l’adulte, la DA90 du suxaméthonium à l’adducteur du pouce est de 0,26 mg/kg [210]. Les agents halogénés potentialisent les effets du suxaméthonium, la DA90 étant de 0,21 mg/kg sous halothane. Le protoxyde d’azote potentialise les effets du suxaméthonium d’environ 30 % [222], mais cette interaction n’a probablement pas de retentissement clinique en raison des conditions habituelles d’induction anesthésique. L’administration préalable d’une dose minime de curare non dépolarisant diminue la puissance du suxaméthonium. La sensibilité du masséter est comparable à celle de l’adducteur du pouce alors que le diaphragme est plus résistant au suxaméthonium que le pouce, la DA90 étant 1,8 fois celle de l’adducteur du pouce [211]. Le bloc neuromusculaire est plus intense au niveau des muscles adducteurs laryngés que de l’adducteur du pouce (fig 12) [161]. Les muscles adducteurs laryngés diffèrent des muscles périphériques par leur richesse en fibres musculaires de type II et une vitesse de contraction plus grande. Plusieurs travaux ont démontré que ces fibres de type II seraient plus sensibles aux effets du suxaméthonium que les fibres de type I qui sont majoritaires dans les muscles périphériques, tel l’adducteur du pouce. La plus grande sensibilités des muscles laryngés au suxaméthonium serait liée en partie à cette différence de composition des muscles.
- Évolution de la curarisation
L’injection intraveineuse d’un bolus entraîne l’apparition rapide de fasciculations musculaires dont l’intensité est influencée par la dose utilisée et l’importance des masses musculaires. Une dose de 1 mg/kg entraîne une paralysie complète de l’adducteur du pouce en 60 secondes. Ce bloc de phase I se caractérise à un stade de paralysie partielle par :
- une réponse musculaire soutenue à un tétanos 50 Hz ;
- l’absence de facilitation post-tétanique ;
- un rapport T4/T1 soutenu lors d’une stimulation par train-de-quatre ;
- une potentialisation du bloc par les anticholinestérasiques ;
- l’antagonisation partielle par les curares non dépolarisants.
Une dose de 0,5 mg/kg entraîne une paralysie complète des muscles laryngés en 54 secondes pour 100 secondes à l’adducteur du pouce [161]. C’est ce phénomène et la sensibilité des muscles laryngés au suxaméthonium qui expliqueraient pourquoi il est possible d’intuber dans de bonnes conditions alors que l’adducteur du pouce n’est pas encore totalement paralysé. Après administration d’un bolus de 1 mg/kg, la décurarisation de l’adducteur du pouce apparaît en 4 à 8 minutes chez le sujet normal. Une force musculaire de 90 % de la valeur contrôle est obtenue en 6 à 13 minutes [117].La survenue d’un bloc de phase II est rare ; elle a été décrite lors de l’utilisation de suxaméthonium pour l’entretien de la curarisation en perfusion ou en injections répétées. Ce type de bloc est observé pour des doses totales d’un moins 3 à 5 mg/kg ou lors d’une administration continue d’un moins 60 à 90 minutes [191]. Le mécanisme retenu serait lié à une activation persistante des récepteurs nicotiniques présynaptiques entraînant une baisse de la libération d’acétylcholine. De plus, les fortes doses de suxaméthonium agiraient comme l’hémicholinium en bloquant la synthèse d’acétylcholine [160]. L’installation du bloc de phase II est souvent précédée d’une tachyphylaxie avec diminution des effets neuromusculaires pour des doses identiques et répétées. Il se caractérise par :
- une réponse musculaire non soutenue lors d’une stimulation tétanique ;
- une facilitation post-tétanique ;
- un rapport T4/T1 inférieur à 50 % ;
- une inhibition du bloc par les anticholinestérasiques.
La durée de récupération d’une force musculaire normale lors d’un bloc de phase II est variable d’un patient à un autre ; elle dépend également de la dose et de la durée d’administration. Elle est en moyenne d’une quinzaine de minutes après l’arrêt de l’administration de suxaméthonium [191].
- Effets secondaires
Il importe de différencier les effets secondaires habituels du suxaméthonium des complications beaucoup plus rares mais souvent imprévisibles. Les premiers sont d’intensité limitée et/ou peuvent être évités par la connaissance de la pharmacologie du suxaméthonium.
- Effets secondaires habituels
– Effets musculairesLes fasciculations sont un phénomène transitoire, couramment observé, lors de l’installation de la paralysie. Leur survenue peut être prévenue par l’administration d’une faible dose de curare non dépolarisant 3 minutes avant le suxaméthonium. Cette technique expose à des troubles de la déglutition ou de la ventilation liés aux effets du curare non dépolarisant. La fréquence des douleurs musculaires varie selon les études de 5 à 83 % [180]. Une relation entre leur fréquence de survenue et la mobilisation précoce du patient a été envisagée mais n’a jamais pu être confirmée. Il semblerait que les douleurs musculaires puissent survenir chez environ 50 % des patients subissant une laparotomie, que le suxaméthonium soit utilisé ou non. Zahl et Apfelbaum n’ont pu démontrer une baisse de fréquence des myalgies quand le vécuronium remplaçait le suxaméthonium [252]. Leur intensité peut être diminuée par l’administration préalable de diazépam ou d’une faible dose de curare non dépolarisant mais au prix d’un allongement de 30 % du délai d’installation de la curarisation. Il est nécessaire d’augmenter d’environ 50 % la dose de suxaméthonium pour avoir un bloc neuromusculaire d’intensité comparable [160]. La précurarisation permet d’autre part de limiter l’élévation de la kaliémie et des créatine phosphokinases (CPK) d’origine musculaire [155]. L’augmentation des CPK est plus importante en cas d’utilisation d’agents halogénés que lors de l’administration d’agents anesthésiques intraveineux ; le mécanisme en serait une perturbation de la régulation des mouvements du calcium intracellulaire [160].
Le spasme des masséters se définit comme une rigidité des muscles masséters après administration de succinylcholine, pouvant gêner l’intubation, alors que les autres muscles sont relâchés [194]. De nombreuses études ont démontré au cours de ces dernières années qu’il existait, après administration de succinylcholine, une augmentation de tonus des muscles masséters durant 1 à 2 minutes [188, 195, 213]. Cet effet semble être dose dépendant, maximal durant les fasciculations, et est observé même quand l’halothane est remplacé par l’isoflurane. Une précurarisation ne prévient pas cette augmentation de tonus contrairement à une dose paralysante de curare non dépolarisant [214]. Il est maintenant admis que c’est l’exagération de cette réaction qui pourrait entraîner chez certains patients un trismus, voire des difficultés d’intubation. Sa fréquence varie selon les études entre 0,1 et 1 % [145, 194]. Le spasme des masséters a été longtemps considéré comme un signe précurseur d’hyperthermie maligne. S’il ne fait pas de doute qu’un trismus est observé au cours de l’hyperthermie maligne, la mise en évidence de cette hypertonie ne signifie pas forcément l’apparition d’une hyperthermie maligne [194]. En revanche, l’attention de l’anesthésiste doit être attirée par ce signe et impose la recherche des autres signes d’hyperthermie maligne (hypercapnie, tachycardie, acidose métabolique).
- Hyperkaliémie
Une élévation discrète de la kaliémie est constante après injection de suxaméthonium. Elle est plus importante en cas d’anesthésie à l’halothane (0,2 - 0,5 mmol/L) qu’au thiopental (0,1 - 0,35 mmol/L) [108, 123, 182, 242]. Cette élévation de la kaliémie n’est pas totalement abolie par une précurarisation. Contrairement à ce qui a été longtemps admis, ces modifications ne sont pas plus marquées chez les enfants porteurs de strabisme que dans une population témoin [156]. En revanche, certaines situations peuvent s’accompagner d’une hyperkaliémie majeure en cas d’administration de suxaméthonium. Le mécanisme serait dû au fait que le suxaméthonium n’agit plus uniquement au niveau de la plaque motrice mais à la totalité de la membrane musculaire. Les pathologies en cause sont souvent des atteintes neurologiques ou musculaires : accident vasculaire récent, paraplégie, dystrophies musculaires ou myotonies, sepsis ou traumatismes étendus [42, 43] ; elles sont une contre-indication à l’utilisation de succinylcholine. En cas d’hémiplégie, le risque de déclenchement d’une hyperkaliémie est maximal entre la première semaine et le sixième mois après sa survenue. Le risque pourrait cependant persister, même 10 ans plus tard [153]. La précurarisation ne garantit pas l’abolition de l’hyperkaliémie. L’insuffisance rénale n’est pas une contre-indication formelle à l’utilisation de succinylcholine si la kalièmie est contrôlée. En cas de brûlures, le risque d’hyperkaliémie est dépendant de l’étendue de la brûlure. Il serait maximal pendant 7 à 8 jours mais il est recommandé d’éviter la succinylcholine pendant plusieurs semaines jusqu’à cicatrisation complète [153].
- Effets cardiovasculaires
En raison de sa parenté structurale avec l’acétylcholine, le suxaméthonium peut stimuler les différents récepteurs cholinergiques nicotiniques et muscariniques de l’organisme. L’effet dominant est une bradycardie par stimulation des récepteurs cardiaques muscariniques, en particulier sinoauriculaires [201, 249]. Cet effet est plus marqué chez l’enfant et en cas de réinjections. Il peut être prévenu par l’administration préalable d’atropine. La stimulation des récepteurs nicotiniques ganglionnaires est faible et sans retentissement clinique dans la majorité des cas. En cas d’injections répétées, la choline, issue de la dégradation du suxaméthonium, sensibiliserait le coeur et majorerait les effets bradycardisants du suxaméthonium [249]. Le suxaméthonium semble dépourvu d’effet inotrope négatif. La survenue d’une tachycardie, après injection de suxaméthonium, est liée à la stimulation des récepteurs nicotiniques ganglionnaires des voies sympathiques et à l’augmentation de la libération de noradrénaline [174]. L’apparition d’une tachycardie serait favorisée par l’existence d’une hypoxie ou d’une hypercapnie ou l’utilisation d’halothane ou de digitaliques. Chez certains patients, l’existence d’une tachycardie est secondaire à la survenue d’une hyperkaliémie massive.
- Effets digestifs
Le suxaméthonium entraîne une augmentation transitoire de la pression intragastrique. Elle dépend en partie de l’intensité des fasciculations [166] ; l’augmentation moyenne est comprise entre 7 et 12 cm d’eau mais elle peut atteindre 40 cm d’eau. Cependant, il a été démontré que lors des fasciculations, la pression du sphincter oesophagien inférieur augmentait plus que la pression intragastrique [215], ce qui limiterait le risque de régurgitations chez le patient à l’estomac plein. L’augmentation de pression intragastrique peut être prévenue par une précurarisation [166]. L’augmentation de pression intragastrique est plus faible chez l’enfant car les fasciculations musculaires sont de moindre intensité.
- Effets oculaires
Le suxaméthonium entraîne une augmentation de pression intraoculaire comprise entre 5 et 10 mm de mercure. Cet effet dure 5 à 6 minutes ; il serait lié en partie à la contraction prolongée de la musculature oculaire extrinsèque et n’est pas aboli par une précurarisation [165]. L’augmentation de pression intraoculaire est d’autant plus marquée que l’anesthésie est légère, elle est maximale lors de la laryngoscopie et de l’intubation. Cette propriété expose au risque d’expulsion du vitré en cas d’ouverture de la chambre antérieure ou de plaie du globe oculaire. Cependant, Edmonson a démontré qu’en cas d’utilisation des techniques de crash induction, la pression intraoculaire n’atteignait jamais les valeurs contrôles mesurées avant l’induction de l’anesthésie [77].
- Accidents graves
– Accidents allergiquesLes curares sont une des principales causes d’accidents allergiques en cours d’anesthésie. La fréquence des réactions anaphylactoöides, tous mécanismes confondus, serait d’environ un cas pour 3 500 anesthésies, un accident anaphylactique vrai étant observé pour 6 000 anesthésies. Le suxaméthonium ne représente qu’environ 10 % des parts de marché des curares en France mais serait impliqué dans 43 % des accidents allergiques liés aux curares. Il serait en cause dans environ 28 % des accidents anaphylactiques liés à l’anesthésie [131]. En Grande-Bretagne, après calcul en fonction de la consommation relative des agents anesthésiques, le suxaméthonium est en tête des accidents anesthésiques. Watkins estime la fréquence à environ 1 pour 4 000 quand le thiopental est utilisé en association pour l’induction [238]. Bien qu’une activation non spécifique de la voie du complément ait été parfois rendue responsable, le principal mécanisme apparaît être anaphylactique et lié à la présence d’IgE. Les IgE présentes sur les basophiles et les mastocytes sont responsables de la libération d’histamine, de tumor necrosis factor (TNF) et de platelet activating factor (PAF). La libération de prostaglandines et de leucotriènes survient dans un second temps. C’est la libération de ces médiateurs qui est responsable du collapsus cardiovasculaire quasi constant, avec éventuellement bronchospasme, réactions cutanées ou oedème de Quincke [169]. Ces accidents surviennent plus fréquemment chez les femmes et ont même été observés chez des patients qui n’avaient jamais reçu de suxaméthonium, voire n’avaient jamais été anesthésiés [169]. Il est probable que les patients peuvent se sensibiliser par des expositions préalables à des cosmétiques, des aliments ou des produits industriels contenant des ammoniums quaternaires [86]. Un terrain atopique serait retrouvé chez un patient sur trois [169]. une allergie croisée avec les autres curares in vitro est retrouvée chez environ 80 % des patients [131].
- Curarisation prolongée
Le suxaméthonium étant hydrolysé par les pseudocholinestérases plasmatiques, un déficit acquis ou congénital peut entraîner une prolongation de la durée de curarisation car seule la butyrylcholinestérase est capable d’estérifier le suxaméthonium. L’acétylcholinestérase, présente dans la fente synaptique de la jonction neuromusculaire, n’est pas capable de compenser un déficit en pseudocholinestérases. Une corrélation entre l’activité pseudocholinestérasique et la durée d’action du suxaméthonium a pu être démontrée chez les patients porteurs d’un génotype U-U [233].En cas de déficit congénital hétérozygote de génotype UA ou UF, la durée d’action du suxaméthonium n’est que très modérément prolongée, la force musculaire à l’adducteur du pouce réapparaissant une dizaine de minutes après l’administration d’un bolus de 1 mg/kg, une force musculaire de 90 % de la valeur contrôle étant obtenue en 9 à 38 minutes selon les patients [117]. Dans le cas rare d’un déficit hétérozygote avec deux gènes anormaux, la durée totale de la curarisation peut atteindre 30 à 60 minutes. C’est en cas d’anomalie congénitale homozygote que la durée d’action du suxaméthonium est très allongée. Un bolus de 1 mg/kg peut entraîner une paralysie complète d’une quarantaine de minutes, l’adducteur du pouce récupérant une force musculaire normale en 90 à 180 minutes [117]. La fréquence des patients homozygotes, porteurs du gène anormal, est d’environ 0,04 % en France, soit une incidence d’une curarisation prolongée pour 2 500 patients environ. Les déficits acquis en pseudocholinestérases n’entraînent que très rarement un allongement significatif de la durée d’action d’un bolus de suxaméthonium car il faut une réduction d’un moins 50 % de l’activité cholinestérasique pour avoir une traduction clinique.
En cas de survenue d’une curarisation prolongée, le traitement nécessite la poursuite de la ventilation contrôlée et la sédation jusqu’à la récupération d’une fonction musculaire normale. Dans certains pays sont disponibles des solutions de pseudocholinestérases purifiées qui ont pu être utilisées avec succès chez des patients présentant une curarisation prolongée [172, 179].
- Hyperthermie maligne
L’hyperthermie maligne est une complication rare de l’anesthésie, sa fréquence étant comprise entre 1/15 000 et 1/30 000 anesthésies. Elle est induite par l’exposition à des agents halogénés associés ou non au suxaméthonium. Elle est liée à une anomalie localisée sur le chromosome 19 qui entraîne une anomalie du récepteur à la ryanodine, responsable de la libération de calcium dans le myoplasme. Outre l’hyperthermie, l’acidose, les signes cardiaques, il existe une rigidité de tous les muscles du corps et une rhabdomyolyse. Parmi les signes musculaires, le spasme des masséters peut être un signe avant-coureur d’hyperthermie maligne, mais sa fréquence est beaucoup plus importante (1/100) et il peut être de survenue isolée. Plutôt qu’une hyperthermie maligne vraie, il semblerait que le suxaméthonium puisse déclencher, chez des patients porteurs de maladie neuromusculaire (dystrophie musculaire de Duchenne [192, 205], myotonies [4], des complications non spécifiques et liées à l’atteinte musculaire préexistante. Il peut s’agir, selon les patients, d’hyperkaliémie, de tachycardie ou fibrillation ventriculaire, d’hyperthermie, de contractures musculaires ou de rhabdomyolyse ; une élévation sérique des CPK est très fréquemment associée.
- Utilisation clinique
Les indications du suxaméthonium se sont progressivement réduites, plus en raison des risques d’accidents rares mais imprévisibles que de ses autres effets secondaires.
- Posologie
La dose recommandée chez l’adulte est de 1 mg/kg par voie intraveineuse, l’intubation pouvant alors être réalisée 30 secondes après l’injection.Le principal avantage du suxaméthonium est l’association d’un bref délai d’installation de la curarisation associé à une courte durée d’action. Le relâchement musculaire favorise la laryngoscopie et la paralysie des muscles adducteurs laryngés permettant l’introduction de la sonde d’intubation dans des conditions optimales. D’un point de vue pratique, l’apparition des fasciculations au niveau des muscles périphériques s’accompagne de l’installation de la paralysie des muscles laryngés. En cas de précurarisation par une faible dose de curare non dépolarisant (un dixième de la dose usuelle), la posologie de suxaméthonium doit être portée à 1,5 mg/kg chez l’adulte pour avoir une vitesse d’installation et une intensité de curarisation comparables à celles d’un bolus isolé de 1 mg/kg. Chez l’enfant et le nourrisson la posologie initiale est plus importante que chez l’adulte, une dose de 1,5 mg/kg est recommandée. L’administration préalable d’atropine prévient la survenue d’une bradycardie sinusale. En cas d’administration d’un curare non dépolarisant après une dose de succinylcholine pour l’intubation, le bloc non dépolarisant est plus profond et dure plus longtemps qu’habituellement, cette potentialisation est observée même 30 minutes après l’administration du suxaméthonium [48].
- Indications
L’indication de choix reste l’anesthésie du patient à l’estomac plein ou chaque fois qu’il existe une situation à un risque d’inhalation du contenu gastrique. De même le suxaméthonium reste le curare de choix en cas d’anesthésie générale pour césarienne, aucun curare non dépolarisant, jusqu’à maintenant, n’offrant des conditions d’intubation aussi bonnes dans un délai si court. Une autre indication reste la prévention des fractures au cours des sismothérapies.En cas de contre-indication à la succinylcholine chez un patient à l’estomac plein, plusieurs attitudes sont possibles. Le patient peut être intubé sans curare en associant propofol et morphinomimétique mais il existe un risque de toux, voire de laryngospasme. Si la curarisation du patient est nécessaire, plutôt que d’utiliser la technique de la priming dose qui expose, elle-même, au risque de régurgitation, voire d’inhalation, il est préférable d’utiliser le rocuronium ou de fortes doses de vécuronium mais au prix d’une curarisation durant plus de 1 heure.
En cas d’intubation difficile prévue, plusieurs attitudes existent. Certains proposent parfois l’emploi de suxaméthonium en raison de la qualité du relâchement procuré et de la possibilité de reprise rapide de la ventilation spontanée en cas d’intubation impossible.
L’apparition des curares non dépolarisants de durée d’action intermédiaire (vécuronium, atracurium), puis plus récemment du mivacurium, ont fait progressivement disparaître les indications du suxaméthonium pour le maintien de la curarisation car il existe un risque de passage en bloc de phase II. Ce bloc peut apparaître en cas de bolus répétés ou surtout d’administration continue quand la dose dépasse 3 à 5 mg/kg.
- Contre-indications
Certaines contre-indications sont formelles et ne doivent pas être transgressées, il s’agit :
- des antécédents personnels ou familiaux d’hyperthermie maligne ;
- des myopathies, de la maladie de Steinert ;
- des antécédents d’allergie à la succinylcholine ou d’allergie croisée aux myorelaxants ;
- des déficits congénitaux en pseudocholinestérases ;
- des hyperkaliémies ou des situations exposant à une fuite potassique majeure (paraplégie ou hémiplégie d’installation récente, syndrome de dénervation, brûlures, tétanos).
– D’autres contre-indications sont relatives mais imposent la prudence dans l’utilisation :
- terrain atopique ;
- troubles du rythme, insuffisance cardiaque ;
- chirurgie à globe oculaire ouvert, en cas de plaie du globe oculaire ; chez un patient à l’estomac plein, il est recommandé de réaliser une précurarisation ;
- myasthénie ;
- traitement par l’écothiopate (Phospholine®).
Références
- [1] Agoston S, Maestrone E, Van Hezik EJ, Ket JM, Houwertjes MC, Uges DR Effective treatment of verapamil intoxication with 4-aminopyrydine in the cat. J Clin Invest 1984 ; 73 : 1291-1296 [crossref]
- [2] Agoston S, Salt P, Newton D, Bencini A, Boomsma P, Erdmann W The neuromuscular blocking action of Org NC 45, a new pancuronium derivative, in anaesthetized patients. A pilot study Br J Anaesth 1980 ; 52(suppl) : 53S-59S
- [3] Agoston S, Vermeer GA, Kersten UW, Meijer DK The fate of pancuronium bromide in man. Acta Anaesthesiol Scand 1973 ; 17 : 267-375
- [4] Aldridge LM Anaesthetic problems in myotonic dystrophy : a case report and review of the Aberdeen experience comprising 48 general anaesthetics in a further 16 patients. Br J Anaesth 1985 ; 57 : 1119-1130
- [5] Ali HH, Savarese JJ, Basta SJ, Sunder N, Gionfriddo M Evaluation of cumulative properties of three new non-depolarizing neuromuscular blocking drugs BW A444U, atracurium and vecuronium. Br J Anaesth 1983 ; 55(suppl) : 107S-111S
- [6] Ali HH, Savarese JJ, Embree PB, Basta SJ, Stout RG, Bottros LH , et al. Clinical pharmacology of mivacurium chloride (BW B1090U) infusion : comparison with vecuronium and atracurium. Br J Anaesth 1988 ; 61 : 541-546
- [7] Armstrong DL, Lester HA The kinetics of d-tubocurarine action and restricted diffusion within the synaptic cleft. J Physiol 1979 ; 294 : 365-386
- [8] Basta SJ, Ali HH, Savarese JJ, Sunder N, Gionfriddo M, Cloutier G, Lineberry C , et al. Clinical pharmacology of atracurium besylate (BW 33A) : a new non-depolarizing muscle relaxant. Anesth Analg 1982 ; 61 : 723-729
- [9] Basta SJ, Savarese JJ, Ali HH, Embree PB, Schwartz AF, Rudd D , et al. Clinical pharmacology of doxacurium chloride : a new long-acting non depolarizing muscle relaxant. Anesthesiology 1988 ; 69 : 478-486
- [10] Basta SJ, Savarese JJ, Ali HH, Moss J, Gionfriddo M Histamine-releasing potencies of atracurium, dimethyltubocurarine and tubocurarine. Br J Anaesth 1983 ; 55 : 105S-106S
- [11] Baurain M, Dernovoi B, Lefebvre R, Barvais L, D’Hollander A, Duvaldestin P , et al. Évolution spontanée de la paralysie obtenue par des doses équipotentes de vécuronium, atracurium, fazadinium, pancuronium, gallamine et d-tubocurarine. Ann Fr Anesth Reanim 1987 ; 6 : 493-497 [crossref]
- [12] Bedford RF From the FDA. [abstract] Anesthesiology 1995 ; 82 : 33A
- [13] Bell CF, Hunter JM, Jones RS, Utting JE Use of atracurium and vecuronium in patients with oesophageal varices. Br J Anaesth 1985 ; 57 : 160-168
- [14] Belmont MR, Lien CA, Quessy S, Abou-Donia MM, Abalos A, Eppich L , et al. The clinical neuromuscular pharmacology of 51 W89 in patients receiving nitrous oxide/opioid/barbiturate anesthesia. Anesthesiology 1995 ; 82 : 1139-1145 [crossref]
- [15] Bencini AF, Scaf AH, Sohn YJ, Kersten-Kleef UW, Agoston S Hepatobility disposition of vecuronium bromide in man. Br J Anaesth 1986 ; 58 : 988-995
- [16] Bencini AF, Scaf AH, Sohn YJ, Meistelman C, Lienhart A, Kersten UW , et al. Diposition and urinary excretion of vecuronium bromide in anesthetized patients with normal renal function or renal failure. Anesth Analg 1986 ; 65 : 245-251
- [17] Bevan DR, Fiset P, Balendran P, Law-Min JC, Ratcliffe A, Donati F Pharmacodynamic behavior of rocuronium in the elderly. Can J Anaesth 1993 ; 40 : 127-132 [crossref]
- [18] Bevan DR, Kahwaji R, Ansermino JM, Reimer E, Smith MF, O’Connor GA , et al. Residual block after mivacurium with or without edrophonium reversal in adults and children. Anesthesiology 1996 ; 84 : 362-367 [crossref]
- [19] Bevan DR, Smith CE, Donati F Postoperative neuromuscular blockade : a comparison between atracurium, vecuronium, and pancuronium. Anesthesiology 1988 ; 69 : 272-276
- [20] Booth MG, Marsh B, Bryden FM, Robertson EN, Baird WL A comparison of the pharmacodynamics of rocuronium and vecuronium during halothane anaesthesia. Anaesthesia 1992 ; 47 : 832-834 [crossref]
- [21] Bovet D Some aspects of the relationship between chemical constitution and curare-like activity. Ann NY Acad Sci 1951 ; 54 : 407-437 [crossref]
- [22] Bovet D, Courvoisier S, Ducrot R, Horclois R Recherche sur les poisons curarisants de synthèse. Arch Int Pharmacodyn 1949 ; 80 : 137-158
- [23] Bowman WC Non-relaxant properties of neuromuscular blocking drugs. Br J Anaesth 1982 ; 54 : 147-160
- [24] Bowman WC. Pharmacology of neuromuscular function. London : Wright, 1990 : 1-316.
- [25] Bowman WC. Prejunctional mechanisms involved in neuromuscular transmission. In : Jones RM, Aitkenhead AR, Foëx P eds. Neuromuscular transmission. London : BMJ Publishing Group, 1996 : 1-27.
- [26] Bowman WC, Rodger W, Houston J, Marshall RJ, McIndewar I Structure : action relationships among some desacetoxy analogues of pancuronium and vecuronium in the anesthetized cat. Anesthesiology 1988 ; 69 : 57-62
- [27] Boyd AH, Eastwood NB, Parker CJR, Hunter JM Pharmacodynamics of the 1R cis- 1’R cis isomer of atracurium (51W89) in health and chronic renal failure. Br J Anaesth 1995 ; 74 : 400-404 [crossref]
- [28] Braga MF, Rowan EG, Harvey AL, Bowman WC Interactions between suxamethonium and non-depolarizing neuromuscular blocking drugs. Br J Anaesth 1994 ; 72 : 198-204
- [29] Brandom BW, Woelfel SK, Cook DR, Fehr BL, Rudd GD Clinical pharmacology of atracurium in infants. Anesth Analg 1984 ; 63 : 309-312
- [30] Brandom BW, Woelfel SK, Cook DR, Weber S, Powers DM, Weakly JN Comparison of mivacurium and suxamethonium administered by bolus and infusion. Br J Anaesth 1989 ; 62 : 488-493
- [31] Buzello W, Noldge G Repetitive administration of pancuronium and vecuronium (Org NC 45, Norcuron) in patients undergoing long lasting operations. Br J Anaesth 1982 ; 54 : 1151-1157
- [32] Caldwell JE, Heier T, Kitts JB, Lynam DP, Fahey MR, Miller RD Comparison of the neuromuscular block induced by mivacurium, suxamethonium or atracurium during nitrous oxide-fentanyl anaesthesia. Br J Anaesth 1989 ; 63 : 393-399
- [33] Caldwell JE, Kitts JB, Heier T, Fahey MR, Lynam DP, Miller RD The dose-response relationship of mivacurium chloride in humans during nitrous oxide-fentanyl or nitrous oxide-enflurance anesthesia. Anesthesiology 1989 ; 70 : 31-35
- [34] Caldwell JE, Szenohradszky J, Segredo V, Wright PM, McLoughlin C, Sharma ML , et al. The pharmacodynamics and pharmacokinetics of the metabolite 3-desacetylvecuronium (ORG 7268) and its parent compound, vecuronium, in human volunteers. J Pharmacol Exp Ther 1994 ; 270 : 1216-1222
- [35] Cantineau JP, Porte F, D’Honneur G, Duvaldestin P Neuromuscular effects of rocuronium on the diaphragm and adductor pollicis in anesthetized patients. Anesthesiology 1994 ; 81 : 585-590 [crossref]
- [36] Chauvin M, Lebrault C, Duvaldestin P The neuromuscular blocking effect of vecuronium on the human diaphragm. Anesth Analg 1987 ; 66 : 117-122 [crossref]
- [37] Choi WW, Mehta MP, Murray DJ, Sokoll MD, Forbes RB, Gergis SD , et al. Neuromuscular and cardiovascular effects of mivacurium chloride in surgical patients receiving nitrous oxide-narcotic or nitrous oxide-isoflurane anaesthesia. Can J Anaesth 1989 ; 36 : 641-650 [crossref]
- [38] Cook DR, Freeman JA, Lai AA, Kang Y, Stiller RL, Aggarwal S , et al. Pharmacokinetics of mivacurium in normal patients and in those with hepatic or renal failure. Br J Anaesth 1992 ; 69 : 580-585
- [39] Cook DR, Stiller RL, Weakly JN, Chakravorti S, Brandom BW, Welch RM In vitro metabolism of mivacurium chloride (BW B1090U) and succinylcholine. Anesth Analg 1989 ; 68 : 452-456
- [40] Cooper RA, Maddineni VR, Mirakhur RK, Wierda JM, Brady M, Fitzpatrick KT Time course of neuromuscular effects and pharmacokinetics of rocuronium bromide (Org 9426) during isoflurane anaesthesia in patients with and without renal failure. Br J Anaesth 1993 ; 71 : 222-226
- [41] Cooper RA, Mirakhur RK, Clarke RS, Boules Z Comparison of intubating conditions after administration of Org 9246 (rocuronium) and suxamethonium. Br J Anaesth 1992 ; 69 : 269-273
- [42] Cooperman LH Succinylcholine-induced hyperkalemia in neuromuscular disease. JAMA 1970 ; 213 : 1867-1871
- [43] Cooperman LH, Strobel GE, Kennel EM Massive hyperkalemia after administration of succinylcholine. Anesthesiology 1970 ; 32 : 161-164 [crossref]
- [44] Cornet JP, Abiad M, Coriat P, Saada M, Gosgnach ML, Viars P Evaluation of the effects of rocuronium bromide on haemodynamics and left ventricular function in patients undergoing abdominal aortic surgery. Eur J Anaesthesiol 1994 ; 11 : 78-81
- [45] Cozanitis DA, Erkola O A clinical study into the possible intrinsic bradycardic activity of vecuronium. Anaesthesia 1989 ; 44 : 648-650 [crossref]
- [46] Cronnelly R, Fisher DM, Miller RD, Gencarelli P, Nguyen-Gruenke L, Castagnoli N Pharmacokinetics and pharmacodynamics of vecuronium (ORG NC 45) and pancuronium in anesthetized humans. Anesthesiology 1983 ; 58 : 405-408
- [47] Curran MJ, Donati F, Bevan DR Onset and recovery of atracurium and suxamethonium-induced neuromuscular blockade with simultaneous train-of-four and single twitch stimulation. Br J Anaesth 1987 ; 59 : 989-994
- [48] D’Hollander AA, Agoston S, De Ville A, Cuvelier F Clinical and pharmacological actions of a bolus injection of suxamethonium : two phenomena of distinct duration. Br J Anaesth 1983 ; 55 : 131-134
- [49] D’Hollander AA, Hennart DA, Barvais L, Baurain M Administration of atracurium by infusion for long surgical procedures. Simple techniques for routine use Br J Anaesth 1986 ; 58(suppl) : 56S-59S
- [50] D’Hollander AA, Luyckx C, Barvais L, De Ville A Clinical evaluation of atracurium besylate requirement for a stable muscle relaxation during surgery : lack of age-related effects. Anesthesiology 1983 ; 59 : 237-240
- [51] D’Hollander AA, Massaux F, Nevelsteen M, Agoston S Age-dependent dose-response relationship of ORG NC 45 in anaesthetized patients. Br J Anaesth 1982 ; 54 : 653-657
- [52] D’Honneur G, Gall O, Gerard A, Rimaniol JM, Lambert Y, Duvaldestin P Priming doses of atracurium and vecuronium depress swallowing in humans. Anesthesiology 1992 ; 77 : 1070-1073
- [53] D’Honneur G, Rebaine C, Slavov V, Ruggier R, De Chaubry V, Duvaldestin P Neostigmine reversal of vecuronium neuromuscular block and the influence of renal failure. Anesth Analg 1996 ; 82 : 134-138 [crossref]
- [54] Debros FM, Lai A, Scott R, Debros J, Batson AG, Goudsouzian N , et al. Pharmacokinetics and pharmacodynamics of atracurium during isoflurane anesthesia in normal and anephric patients. Anesth Analg 1986 ; 65 : 743-746
- [55] Devlin JC, Head-Rapson AG, Parker CJ, Hunter JM Pharmacodynamics of mivacurium chloride in patients with hepatic cirrhosis. Br J Anaesth 1993 ; 71 : 227-231
- [56] Diefenbach C, Mellinghoff H, Lynch J, Buzello W Mivacurium : dose-response relationship and administration by repeated injection or infusion. Anesth Analg 1992 ; 74 : 420-423
- [57] Docherty JR, McGrath JC Sympathomimetic effects of pancuronium bromide on the cardiovascular system of the pithed rat : a comparison of the effects of drugs blocking the neuronal uptake of noradrenaline. Br J Pharmacol 1978 ; 64 : 589-599
- [58] Donati F Onset of action of relaxants. Can J Anaesth 1988 ; 35(suppl) : S52-S18
- [59] Donati F Pharmacokinetics and pharmacodynamics factors in the clinical use of muscle relaxants. Semin Anesth 1994 ; 13 : 310-320
- [60] Donati F. Mode d’action des curares. Conférences d’actulisation de la société française d’anesthésie et de réanimation. Paris : Masson, 1995 : 153-160.
- [61] Donati F, Antzaka C, Bevan DR Potency of pancuronium at the diaphragm and the adductor pollicis muscle in humans. Anesthesiology 1986 ; 65 : 1-5
- [62] Donati F, Bevan DR Long-term succinylcholine infusion during isoflurane anesthesia. Anesthesiology 1983 ; 58 : 6-10
- [63] Donati F, Meistelman C A kinetic-dynamic model to explain the relationship between high potency and slow onset time for neuromuscular blocking drugs. J Pharmacokinet Biopharm 1991 ; 19 : 537-552 [crossref]
- [64] Donati F, Meistelman C. Transmission neuromusculaire. In : Samii K ed. Anesthésie réanimation chirurgicale. Paris : Flammarion, 1995 : 90-99
- [65] Donati F, Meistelman C, Plaud B Vecuronium neuromuscular blockade at the diaphragm, the orbicularis oculi, and adductor pollicis muscles. Anesthesiology 1990 ; 73 : 870-875
- [66] Donati F, Meistelman C, Plaud B Vecuronium neuromuscular blockade at the adductor muscles of the larynx and adductor pollicis. Anesthesiology 1991 ; 74 : 833-837
- [67] Ducharme J, Varin F, Bevan DR, Donati F Importance of early blood sampling on vecuronium pharmacokinetic and pharmacodynamic parameters. Clin Pharmacokinet 1993 ; 24 : 507-518 [crossref]
- [68] Dupuis JY, Martin R, Tétrault JP Atracurium and vecuronium interaction with gentamycin and tobramycin. Can J Anaesth 1989 ; 36 : 407-411 [crossref]
- [69] Durant NN, Houwertjes MC, Crul JF Comparison of the neuromuscular blocking properties of Org NC 45 and pancuronium in the rat, cat and rhesus monkey. Br J Anaesth 1980 ; 52 : 723-730
- [70] Durant NN, Marshall IG, Savage DS, Nelson DN, Sleigh T, Carlyle IC The neuromuscular and autonomic blocking activities of pancuronium, Org NC 45 and other pancuronium analogues in the cat. J Pharm Pharmacol 1979 ; 31 : 831-836
- [71] Duvaldestin P Curarisations prolongées au mivacurium et au suxaméthonium : la biologie moléculaire permettra-t-elle une approche diagnostique et thérapeutique ? Ann Fr Anesth Reanim 1995 ; 14 : 465-466 [crossref]
- [72] Duvaldestin P, Agoston S, Henzel D, Kersten UW, Desmonts JM Pancuronium pharmacokinetics in patients with liver cirrhosis. Br J Anaesth 1978 ; 50 : 1131-1136
- [73] Duvaldestin P, Henzel D Binding of tubocurarine, fazadinium, pancuronium and ORG NC45 to serum proteins in normal man and in patients with cirrhosis. Br J Anaesth 1982 ; 54 : 513-516
- [74] Duvaldestin P, Saada J, Berger JL, D’Hollander AA, Desmonts JM Pharmacokinetics, pharmacodynamics and dose-response relationships of pancuronium in control and elderly subjects. Anesthesiology 1982 ; 56 : 36-40
- [75] Eastwood NB, Boyd AH, Parker CJR, Hunter JM Pharmacokinetics of 1R-cis 1’R-cis atracurium besylate (51W89) and plasma laudanosine concentrations in health and chronic renal failure. Br J Anaesth 1995 ; 75 : 431-435
- [76] Eddleston JM, Harper NJN, Pollard BJ, Edwards D, Gwinnut CL Concentrations of atracurium and laudanosine in cerebrospinal fluid and plasma during intracranial surgery. Br J Anaesth 1989 ; 63 : 525-530
- [77] Edmondson L, Lindsay SL, Lanigan LP, Woods M, Chew HE Intra-ocular pressure changes during rapid sequence induction of anaesthesia. Anaesthesia 1988 ; 43 : 1005-1010
- [78] Edwards RP, Miller RD, Roizen MF, Ham J, Way WL, Lake CR , et al. Cardiac responses to imipramine and pancuronium during anesthesia with halothane or enflurane. Anesthesiology 1979 ; 50 : 421-425
- [79] Engbaek J, Ostergaard D, Skovgaard LT, Viby-Mogensen J Reversal of intense neuromuscular blockade following infusion of atracurium. Anesthesiology 1990 ; 72 : 803-806
- [80] Erkola O, Rautoma P, Meretoja OA Mivacurium when preceded by pancuronium becomes a long-acting muscle relaxant. Anesthesiology 1996 ; 84 : 562-565 [crossref]
- [81] Fahey MR, Morris RB, Miller RD, Nguyen TL, Upton RA Pharmacokinetics of ORG NC45 (Norcuron) in patients with and without renal failure. Br J Anaesth 1981 ; 53 : 1049-1053
- [82] Fahey MR, Rupp SM, Fisher DM, Miller RD, Sharma M, Canfell PC , et al. The pharmacokinetics and pharmacodynamics of atracurium in patients with and without renal failure. Anesthesiology 1984 ; 61 : 699-702
- [83] Fisher DM, Canfell PC Pharmacokinetics and pharmacodynamics of atracurium in infants and children. Anesthesiology 1990 ; 73 : 33-37
- [84] Fisher DM, Canfell PC, Fahey MR, Rosen JI, Rupp SM, Sheiner LB , et al. Elimination of atracurium in humans : contribution of Hofmann elimination and ester hydrolysis versus organ-based elimination. Anesthesiology 1986 ; 65 : 6-12
- [85] Fisher DM, Castagnoli K, Miller RD Vecuronium kinetics and dynamics in anesthetized infants and children. Clin Pharmacol Ther 1985 ; 37 : 402-406
- [86] Fisher DM, More DG The epidemiology and clinical features of anaphylactic reactions in anaesthesia. Anaesth Intensive Care 1981 ; 9 : 226-234
- [87] Flynn PJ, Hughes R, Walton B, Jothilingam S Use of atracurium infusions for general surgical procedures including cardiac surgery with induced hypothermia. Br J Anaesth 1983 ; 55 : 135S-138S
- [88] Foldes FF. Introduction and historical perspectives. In : Pollard BJ ed. Applied neuromuscular pharmacology. Oxford : Oxford University Press, 1994 : 1-16
- [89] Fox MA, Keens SJ, Utting JE Neostigmine in the antagonism of the action of atracurium. Br J Anaesth 1987 ; 59 : 468-472
- [90] From RP, Pearson KS, Choi WW, Abou-Donia M, Sokoll MD Neuromuscular and cardiovascular effects of mivacurium chloride (BW B1090U) during nitrous oxide-fentanyl-thiopentone and nitrous oxide- halothane anaesthesia. Br J Anaesth 1990 ; 64 : 193-198
- [91] Gardier RW, Tsevdos EJ, Jackson DB The effect of pancuronium and gallamine on muscularinic transmission in the superior cervical ganglion. J Pharmacol Exp Ther 1978 ; 204 : 46-53
- [92] Gardier RW, Tsevdos EJ, Jackson DB, Delaunois AL Distinct muscarinic mediation of suspected dopaminergic activity in sympathetic ganglions. Fed Proc 1978 ; 37 : 2422-2428
- [93] Gariepy LP, Varin F, Donati F, Salib Y, Bevan DR Influence of aging on the pharmacokinetics and pharmacodynamics of doxacurium. Clin Pharmacol Ther 1993 ; 53 : 340-347
- [94] Gibb AJ, Marshall IG Pre- and post-juntional effects of tubocurarine and other nicotinic antagonists during repetitive stimulation in the rat. J Physiol 1984 ; 35 : 275-297
- [95] Gill RS, Scott RP Etomidate shortens the onset time of neuromuscular block. Br J Anaesth 1992 ; 69 : 444-446
- [96] Ginsberg B, Glass PS, Quill T, Shafron D, Ossey KD Onset and duration of neuromuscular blockade following high-dose vecuronium administration. Anesthesiology 1989 ; 71 : 201-205
- [97] Glavinovic MI, Law-Min JC, Kapural L, Donati F, Bevan DR Speed of action of various muscle relaxants at the neuromuscular junction binding vs. buffering hypothesis J Pharmacol Exp Ther 1993 ; 265 : 1181-1186
- [98] Goat VA, Yeung ML, Blakeney C, Feldman SA The effect of blood flow upon the activity of gallamine triethiodide. Br J Anaesth 1976 ; 48 : 69-73
- [99] Goldberg ME, Larijani GE, Azad SS, Sosis M, Seltzer JL, Ascher J , et al. Comparison of tracheal intubating conditions and neuromuscular blocking profiles after intubating doses of mivacurium chloride or succinylcholine in surgical outpatients. Anesth Analg 1989 ; 69 : 93-99
- [100] Goldhill DR, Whitehead JP, Emmott RS, Griffith AP, Bracey BJ, Flynn PJ Neuromuscular and clinical effects of mivacurium chloride in healthy adult patients during nitrous oxide-enflurane anaesthesia. Br J Anaesth 1991 ; 67 : 289-295
- [101] Goudsouzian NG, Alifimoff JK, Eberly C, Smeets R, Griswold J, Miler V , et al. Neuromuscular and cardiovascular effects of mivacurium in children. Anesthesiology 1989 ; 70 : 237-242
- [102] Goudsouzian NG, Denman W, Schwarts A, Shorten G, Foster V, Samara B Pharmacodynamic and hemodynamic effects of mivacurium in infants anesthetized with halothane and nitrous oxide. Anesthesiology 1993 ; 79 : 919-925
- [103] Guggiari M, Gallais S, Bianchi A, Guillaume A, Viars P Effets hémodynamiques de l’atracurium chez l’homme. Ann Fr Anesth Reanim 1985 ; 4 : 484-488 [crossref]
- [104] Harrison GA, Junius F The effect of circulation time on the neuromuscular action of suxamethonium. Anaesth Intensive Care 1972 ; 1 : 34-40
- [105] Hart PS, Wright PM, Brown R, Lau M, Sharma ML, Miller RD , et al. Edrophonium increases mivacurium concentrations during constant mivacurium infusion, and large doses minimally antagonize paralysis. Anesthesiology 1995 ; 82 : 912-918 [crossref]
- [106] Healy TE, Palmer JP In vitro comparison between the neuromuscular and ganglion blocking potency ratios of atracurium and tubocurarine. Br J Anaesth 1982 ; 54 : 1307-1311
- [107] Hennart D, D’Hollander A, Plasman C, De Jonckheere M Importance of the level of paralysis recovery for a rapid antagonism of atracurium neuromuscular blockade with moderate doses of edrophonium. Anesthesiology 1986 ; 64 : 384-387
- [108] Henning RD, Bush GH Plasma potassium after halothane-suxamethonium induction in children. Anaesthesia 1983 ; 37 : 802-805
- [109] Hoghe CW, Itani MS, Martyn JAJ Resistance to D-tubocurarine in lower motor neuron injury is related to increased acetylcholine receptors at the neuromuscular junction. Anesthesiology 1990 ; 73 : 703-709
- [110] Hughes R, Chapple DJ Effects of non-depolarizing neuromuscular blocking agents on peripheral autonomic mechanisms in cats. Br J Anaesth 1976 ; 48 : 59-68
- [111] Hughes R, Chapple DJ The pharmacology of atracurium : a new competitive neuromuscular blocking agent. Br J Anaesth 1981 ; 53 : 31-44
- [112] Hull CJ, Van Beem HB, McLeod K, Sibbald A, Watson MJ A pharmacodynamic model for pancuronium. Br J Anaesth 1978 ; 50 : 1113-1123
- [113] Hunt R, De Taveau R On the physiological action of certain cholin derivatives and new methods for detecting cholin. Br Med J 1906 ; 2 : 1788-1791
- [114] Hunter JM, De Wolf A The pharmacodynamics and pharmacokinetics of cisatracurium in patients with renal or hepatic failure. Curr Opin Anaesthesiol 1996 ; 9(suppl 1) : S42-S46
- [115] Hunter JM, Parker C, Bell CF, Jones RS, Utting JE The use of different doses of vecuronium in patients with liver dysfunction. Br J Anaesth 1985 ; 57 : 758-764
- [116] Jensen FS, Skovgaard LT, Viby-Mogensen J Identification of human plasma cholinesterase variants in 6, 688 individuals using biochemical analysis. Acta Anaesthesiol Scand 1995 ; 39 : 157-162 [crossref]
- [117] Jensen FS, Viby-Mogensen J Plasma cholinesterase and abnormal reaction to succinylcholine : twenty years’experience with the Danish Cholinesterase Research Unit. Acta Anaesthesiol Scand 1995 ; 39 : 150-156 [crossref]
- [118] Kalli I, Meretoja OA Infusion of atracurium in neonates, infants and children. A study of dose requirements Br J Anaesth 1988 ; 60 : 651-654
- [119] Kalli I, Meretoja OA Duration of action of vecuronium in infants and children anaesthetized without potent inhalation agents. Acta Anaesthesiol Scand 1989 ; 33 : 29-33
- [120] Katz B, Miledi R The statistical nature of the acetylcholine potential and its molecular components. J Physiol 1972 ; 224 : 665-699
- [121] Katz B, Miledi R Transmission leakage from motor nerve endings. Proc R Soc Lond 1977 ; 196 : 59-72 [crossref]
- [122] Katz RL Clinical neuromuscular pharmacology of pancuronium. Anesthesiology 1971 ; 34 : 550-556 [crossref]
- [123] Keneally JP, Bush GH Changes in serum potassium after suxamethonium in children. Anaesth Intensive Care 1974 ; 11 : 147-149
- [124] Khalil M, D’Honneur G, Duvaldestin P, Slavov V, De Hys C, Gomeni R Pharmacokinetics and pharmacodynamics of rocuronium in patients with cirrhosis. Anesthesiology 1994 ; 80 : 1241-1247
- [125] Khueni-Brady KS, Puhringer F, Koller J, Mitterschiffthaler G Evaluation of the time course of action of maintenance doses of rocuronium (ORG 9426) under halothane anaesthesia. Acta Anaesthesiol Scand 1993 ; 37 : 137-139
- [126] Konstadt SN, Reich DL, Stanley TE, Deperio M, Chuey C, Schwartzbach C , et al. A two-center comparison of the cardiovascular effects of cisatracurium (Nimbex) and vecuronium in patients with coronary artery disease. Anesth Analg 1995 ; 81 : 1010-1014 [crossref]
- [127] Kopman AF Pancuronium, gallamine, and D-tubocurarine compared : is speed of onset inversely related to drug potency. Anesthesiology 1989 ; 70 : 915-920
- [128] Koscielniak-Nielsen ZJ, Bevan JC, Popovic V, Baxter MR, Donati F, Bevan DR Onset of maximum neuromuscular block following succinylcholine or vecuronium in four age groups. Anesthesiology 1993 ; 79 : 229-234 [crossref]
- [129] Krieg N, Hendrickx HH, Crul JF Relative potency of Org NC 45, pancuronium, alcuronium and D-tubocurarine in anesthetized man. Br J Anaesth 1980 ; 52 : 783-788
- [130] Law-Min JC, Bekavac I, Glavinovic MI, Donati F, Bevan DR Iontophoretic study of speed of action of various muscle relaxants. Anesthesiology 1992 ; 77 : 351-356
- [131] Laxenaire MC Drugs and other agents involved in anaphylactic shock occuring during anaesthesia. A french multicenter epidemiological inquiry Ann Fr Anesth Reanim 1993 ; 12 : 91-96 [crossref]
- [132] Laxenaire MC, Moneret-Vautrin DA, Gastin I, Widmer S, Guéant JL. Réactivité croisée du rocuronium avec les autres myorelaxants. In : Le Rocuronium. Paris : Arnette Blackwell, 1995 : 19-23
- [133] Laxenaire MC, Moneret-Vautrin DA, Guéant JL. Réactions allergiques au cours de l’anesthésie. In : Conférences d’actualisation de la société française d’anesthésie et de réanimation. Paris : Elsevier, 1996 : 229-247
- [134] Lebowitz PW, Ramsey FM, Savarese JJ, Ali HH, Debros FM Combination of pancuronium and metocurine : neuromuscular and hemodynamic advantages over pancuronium alone. Anesth Analg 1981 ; 60 : 12-17
- [135] Lebrault C, Berger JL, D’Hollander AA, Gomeni R, Henzel D, Duvaldestin P Pharmacokinetics and pharmacodynamics of vecuronium (ORG NC 45) in patients with cirrhosis. Anesthesiology 1985 ; 62 : 601-605
- [136] Lebrault C, Duvaldestin P, Henzel D, Chauvin M Pharmacokinetics and pharmacodynamics of vecuronium in patients with cholestasis. Br J Anaesth 1986 ; 58 : 983-987
- [137] Lepage JY, Malinge M, Cozian A, Pinaud M, Blanloeil Y, Souron R Vecuronium and atracurium in patients with end-stage renal failure. A comparative study Br J Anaesth 1987 ; 59 : 1004-1010
- [138] Levy JH, Davis GK, Duggan J, Szlam F Determination of the hemodynamics and histamine release of rocuronium (Org 9426) when administered in increased doses under N2O/O2- sufentanil anesthesia. Anesth Analg 1994 ; 78 : 318-321
- [139] Lien CA, Belmont MR, Abalos A, Eppich L, Quessy S, Abou-Donia MM , et al. The cardiovascular effects and histamine-releasing properties of 51W89 in patients receiving nitrous oxide/opioid/barbiturate anesthesia. Anesthesiology 1995 ; 82 : 1131-1138 [crossref]
- [140] Lien CA, Matteo RS, Ornstein E, Schwartz AE, Diaz J Distribution, elimination, and action of vecuronium in the elderly. Anesth Analg 1991 ; 73 : 39-42
- [141] Lien CA, Schmith VD, Belmont MR, Abalos A, Kisor DF, Savarese JJ Pharmacokinetics of cisatracurium in patients receiving nitrous oxide/opioid/barbiturate anesthesia. Anesthesiology 1996 ; 84 : 300-308 [crossref]
- [142] Lien CA, Schmith VD, Embree PB, Belmont MR, Wargin WA, Savarese JJ The pharmacokinetics and pharmacodynamics of the stereoisomers of mivacurium in patients receiving nitrous oxide/opioid/barbiturate anesthesia. Anesthesiology 1994 ; 80 : 1296-1302
- [143] Lienhart A, Desnault H, Viars P Détermination de la courbe dose-effet du vécuronium chez l’homme anesthésie. Ann Fr Anesth Reanim 1983 ; 2 : 3-6 [crossref]
- [144] Lienhart A, Guggiari M, Tauvent A, Maneglia R, Cousin MT, Viars P Effets hémodynamiques du vécuronium chez l’homme. Ann Fr Anesth Reanim 1983 ; 2 : 7-16 [crossref]
- [145] Littleford JA, Patel LR, Bose D, Cameron CB, McKillop C Masseter muscle spasm in children : implications of continuing the triggering anesthetic. Anesth Analg 1991 ; 72 : 151-160
- [146] Litwiller RW Succinylcholine hydrolysis : a review. Anesthesiology 1969 ; 31 : 356-360
- [147] Maestrone E. Interactions of neuromuscular blocking agents in surgical patients. In : Agoston S, Bowman WC eds. Muscle relaxants. Amsterdam : Elsevier, 1990 : 199-229
- [148] Magorian T, Flannery KB, Miller RD Comparison of rocuronium, succinylcholine, and vecuronium for rapid- sequence induction of anesthesia in adult patients. Anesthesiology 1993 ; 79 : 913-918
- [149] Magorian T, Wood P, Caldwell J, Fisher D, Segredo V, Szenohradszky J , et al. The pharmacokinetics and neuromuscular effects of rocuronium bromide in patients with liver disease. Anesth Analg 1995 ; 80 : 754-759 [crossref]
- [150] Marone G, Stellato C, Mastronardi P, Mazarella B Mechanisms of activation of human mast cells and basophils by general anaesthetic drugs. Ann Fr Anesth Reanim 1993 ; 12 : 116-125 [crossref]
- [151] Marshall IG, Prior C Update on the acetylcholine receptor and the neuromuscular junction. Baillieres Clin Anaesthesiol 1994 ; 8 : 299-315 [crossref]
- [152] Marshall RJ, Mc Grath JC, Miller RD, Docherty JR, Lamar JC Comparison of the cardiovascular actions of Org NC 45 with those produced by other non-depolarizing neuromuscular blocking agents in experimental animals. Br J Anaesth 1980 ; 52(suppl) : 21S-31S
- [153] Martyn JA, White DA, Gronert GA, Jaffe RS, Ward JM Up-and-down regulation of skeletal muscle acetylcholine receptors. Effects on neuromuscular blockers Anesthesiology 1992 ; 76 : 822-843
- [154] McLeod K, Watson MJ, Rawlins MD Pharmacokinetics of pancuronium in patients with normal and impaired renal function. Br J Anaesth 1976 ; 48 : 341-345
- [155] McLoughlin C, Elliot P, McCarthy P, Mirakhur RK Muscle pains and biochemical changes following suxamethonium administration after six pretreatment regimens. Anaesthesia 1992 ; 47 : 202-206 [crossref]
- [156] McLoughlin C, Mirakhur RK, Elliot P, Craig HJ, Trimble ER Changes in serum potassium, calcium and creatinine kinase following suxamethonium administration in children with and without strabismus. Pediatr Anaesth 1991 ; 1 : 101-106 [crossref]
- [157] Meakin G, Shaw EA, Baker RD, Morris P Comparison of atracurium-induced neuromuscular blockade in neonates. infants and children Br J Anaesth 1988 ; 60 : 171-175
- [158] Meistelman C Mivacurium et curarisation prolongée. Ann Fr Anesth Reanim 1995 ; 14 : 463-464 [crossref]
- [159] Meistelman C, Agoston S, Kersten UW, Saint-Maurice C, Bencini AF, Loose JP Pharmacokinetics and pharmacodynamics of vecuronium and pancuronium in anesthetized children. Anesth Analg 1986 ; 65 : 1319-1323
- [160] Meistelman C, McLoughlin C Suxamethonium - Current controversies. Curr Anaesth Crit Care 1993 ; 4 : 53-58 [crossref]
- [161] Meistelman C, Plaud B, Donati F Neuromuscular effects of succinylcholine on the vocal cords and adductor pollicis muscles. Anesth Analg 1991 ; 73 : 278-282
- [162] Meistelman C, Plaud B, Donati F Rocuronium (ORG 9426) neuromuscular blockade at the adductor muscles of the larynx and adductor pollicis in humans. Can J Anaesth 1992 ; 39 : 665-669 [crossref]
- [163] Meretoja OA, Wirtavuori K, Neuvonen PJ Age-dependence of the dose-response curve of vecuronium in pediatric patients during balanced anesthesia. Anesth Analg 1988 ; 67 : 21-26
- [164] Merret RA, Thompson CW, Webb FW In vitro degradation of atracurium in human plasma. Br J Anaesth 1983 ; 55 : 61-66
- [165] Meyers EF, Krupin T, Johnson M, Zink H Failure of nondepolarising neuromuscular blockers to inhibit succinylcholine-induced increased intraocular pressure, a controlled study. Anesthesiology 1978 ; 48 : 149-151
- [166] Miller RD, Way WL Inhibition of succinylcholine-induced increased intragastric pressure by non depolarizing muscle relaxants and lidocaine. Anesthesiology 1971 ; 34 : 185-188
- [167] Mirakhur RK Safety aspects of non-depolarizing neuromuscular blocking agents with special reference to rocuronium bromide. Eur J Anaesthesiol 1994 ; 11(suppl 9) : 133-140
- [168] Mirakhur RK, Gibson FM, Lavery GG Antagonism of vecuronium-induced neuromuscular blockade with edrophonium or neostigmine. Br J Anaesth 1987 ; 59 : 473-477
- [169] Moneret-Vautrin DA, Guéant JL, Kamel L, Laxenaire MC, El Kholty S, Nicolas JP Anaphylaxis to muscle relaxants : cross-sensitivity studied by radioimmunoassays compared to intradermal tests in 34 cases. J Allergy Clin Immunol 1988 ; 82 : 745-752 [crossref]
- [170] Motsch J, Leuwer M, Pfau M, Zimmerman J, Martin E Time course of action and recovery of rocuronium bromide in children during halothane anaesthesia : a preliminary report. Eur J Anaesthesiol 1994 ; 11(suppl 9) : 75-77
- [171] Muir AW, Houston J, Green KL, Marshall RJ, Bowman WC, Marshall IG Effects of a new neuromuscular blocking agent (Org 9426) in anaesthetized cats and pigs and in isolated nerve-muscle preparations. Br J Anaesth 1989 ; 63 : 400-410
- [172] Naguib M, El-Gammal M, Daoud W, Ammar A, Moukhtar H, Turkistani A Human plasma cholinesterase for antagonism of prolonged mivacurium- induced neuromuscular blockade. Anesthesiology 1995 ; 82 : 1288-1292 [crossref]
- [173] Nana A, Cardan E, Domokos M Blood catecholamine changes after pancuronium. Acta Anaesthesiol Scand 1973 ; 17 : 83-87 [crossref]
- [174] Nigrovic V, McCullough LS, Wajskol A, Levin JA, Martin JT Succinylcholine-induced increase in plasma catecholamine levels in humans. Anesth Analg 1983 ; 62 : 627-632
- [175] Op de Coul AA, Lambregts PC, Koeman J, Van Puyenbroek MJ, Ter Laak HJ Neuromuscular complications in patients given Pavulon (pancuronium bromide) during artificial ventilation. Clin Neurol Neurosurg 1985 ; 87 : 17-22
- [176] Ornstein E, Lien CA, Matteo RS, Ostapkovich ND, Diaz J, Wolf KB Pharmacodynamics and pharmacokinetics of cisatracurium in geriatric surgical patients. Anesthesiology 1996 ; 84 : 520-525 [crossref]
- [177] Ornstein E, Matteo RS, Schwartz AE, Silverberg PA, Young WL, Diaz J The effects of phenytoin on the magnitude and duration of neuromuscular block following atracurium or vecuronium. Anesthesiology 1987 ; 67 : 191-196
- [178] Ostergaard D, Jensen FS, Jensen E, Skovgaard LT, Viby-Mogensen J Mivacurium-induced neuromuscular blockade in patients with atypical plasma cholinesterase. Acta Anaesthesiol Scand 1993 ; 37 : 314-318 [crossref]
- [179] Ostergaard D, Jensen FS, Viby-Mogensen J Reversal of intense mivacurium block with human plasma cholinesterase in patients with atypical plasma cholinesterase. Anesthesiology 1995 ; 82 : 1295-1298 [crossref]
- [180] Pace NL Prevention of succinylcholine myalgias : a meta-analysis. Anesth Analg 1990 ; 70 : 477-483
- [181] Pansard JL, Chauvin M, Lebrault C, Gauneau P, Duvaldestin P Effect of an intubating dose of succinylcholine and atracurium on the diaphragm and the adductor pollicis in humans. Anesthesiology 1987 ; 67 : 326-330
- [182] Paton WD The effects of muscle relaxants other than muscle relaxation. Anesthesiology 1959 ; 20 : 453-443
- [183] Paton WD, Waud DR The margin of safety of neuromuscular transmission. J Physiol 1967 ; 191 : 59-90
- [184] Pederson SE, Cohen JB D-tubocurarine binding sites are located on at alpha-gamma and alpha-delta subunit interfaces of the nicotinic acetylcholine receptor. Proc Natl Acad Sci USA 1990 ; 87 : 2785-2789
- [185] Phillips BJ, Hunter JM Use of mivacurium chloride by constant infusion in the anephric patient. Br J Anaesth 1992 ; 68 : 492-498
- [186] Plaud B, Debaene B, Lequeau F, Meistelman C, Donati F Mivacurium neuromuscular block at the adductor muscles of the larynx and adductor pollicis in humans. Anesthesiology 1996 ; 85 : 77-81 [crossref]
- [187] Plaud B, Proost JH, Wierda JM, Barre J, Debaene B, Meistelman C Pharmacokinetics and pharmacodynamics of rocuronium at the vocal cords and the adductor pollicis in humans. Clin Pharmacol Ther 1995 ; 58 : 185-191 [crossref]
- [188] Plumley MH, Bevan JC, Saddler JM, Donati F, Bevan DR Dose-related effects of succinylcholine on the adductor pollicis and masseter muscles in children. Can J Anaesth 1990 ; 37 : 15-20 [crossref]
- [189] Pollard BJ. Interactions involving relaxants. In : Applied neuromuscular pharmacology. Oxford : Oxford University Press, 1994 : 202-248
- [190] Prielipp RC, Coursin DB, Scuderi PE, Bowton DL, Ford SR, Cardenas VJ , et al. Comparison of the infusion requirements and recovery profiles of vecuronium and cisatracurium 51W89 in intensive care unit patients. Anesth Analg 1995 ; 81 : 3-12 [crossref]
- [191] Ramsey FM, Lebowitz PW, Savarese JJ, Ali HH Clinical characteristics of long-term succinylcholine neuromuscular blockade during balanced anesthesia. Anesth Analg 1980 ; 59 : 110-116
- [192] Rosenberg H, Heiman-Patterson T Duchenne’s muscular dystrophy and malignant hyperthermia : another warning. Anesthesiology 1983 ; 59 : 362 [crossref]
- [193] Rupp SM, Miller RD, Gencarelli PJ Vecuronium-induced neuromuscular blockade during enflurane, isoflurane and halothane anesthesia in humans. Anesthesiology 1984 ; 60 : 102-105
- [194] Saddler JM Jaw stiffness-An ill understood condition. Br J Anaesth 1991 ; 67 : 515-516
- [195] Saddler JM, Bevan JC, PlumLey MH, Polomeno RC, Donati F, Bevan DR Jaw muscle tension after succinylcholine in children undergoing strabismus surgery. Can J Anaesth 1990 ; 37 : 21-25 [crossref]
- [196] Salt JP, Barnes PK, Conway CM Inhibition of neuronal uptake of noradrenaline in the isolated perfused rat heart by pancuronium and its homologues Org 6368, Org 7268 and NC 45. Br J Anaesth 1980 ; 52 : 313-317
- [197] Sarner JB, Brandom BW, Woelfel SK, Dong ML, Horn MC, Cook DR , et al. Clinical pharmacology of mivacurium chloride (BW B1090U) in children during nitrous oxide-halothane and nitrous oxide-narcotic anesthesia. Anesth Analg 1989 ; 68 : 116-121
- [198] Sastry BV Nicotinic receptor. Anaesth Pharmacol Rev 1993 ; 1 : 6-19
- [199] Savarese JJ, Ali HH, Basta SJ, Embree PB, Scott RP, Sunder N , et al. The clinical neuromuscular pharmacology of mivacurium chloride (BW B1090U). A short-acting nondepolarizing ester neuromuscular blocking drug Anesthesiology 1988 ; 68 : 723-732
- [200] Savarese JJ, Ali HH, Basta SJ, Scott RP, Embree PB, Wastila WB , et al. The cardiovascular effects of mivacurium chloride (BW B1090U) in patients receiving nitrous oxide-opiate-barbiturate anesthesia. Anesthesiology 1989 ; 70 : 386-394
- [201] Schoenstadt DA, Whitcher CE Observations on the mechanism of succinylcholine-induced cardiac arythmias. Anesthesiology 1963 ; 24 : 358-362
- [202] Schwartz AE, Matteo RS, Ornstein E, Halevy JD, Diaz J Pharmacokinetics and pharmacodynamics of vecuronium in the obese surgical patient. Anesth Analg 1992 ; 74 : 515-518
- [203] Segredo V, Caldwell JE, Matthay M, Sharma ML, Gruenke LD, Miller RD Persistent paralysis in critically ill patients after long-term administration of vecuronium. N Engl J Med 1992 ; 327 : 524-528
- [204] Segredo V, Shin Y, Sharma ML, Gruenke LD, Caldwell JE, Khuenl-Brady KS , et al. Pharmacokinetics, neuromuscular effects, and biodisposition of 3-desacetylvecuronium (Org 7268) in cats. Anesthesiology 1991 ; 74 : 1052-1059
- [205] Sethna NF, Rockoff MA, Worthen HM, Rosnow JM Anesthesia-related complications in children with Duchenne muscular dystrophy. Anesthesiology 1988 ; 68 : 462-465
- [206] Sheiner LB, Stanski DR, Vozeh S, Miller RD, Ham J Simultaneous modeling of pharmacokinetics and pharmacodynamics : application to D-tubocurarine. Clin Pharmacol Ther 1979 ; 25 : 358-371
- [207] Simpson DA, Green DW Use of atracurium during major abdominal surgery in infants with hepatic dysfunction from biliary atresia. Br J Anaesth 1986 ; 58 : 1214-1217
- [208] Singh YN, Marshall IG, Harvey AL Depression of transmitter release and postjunctional sensitivity during neuromuscular block produced by antibiotics. Br J Anaesth 1979 ; 51 : 1027-1033
- [209] Smith CE, Baxter M, Bevan JC, Donati F, Bevan DR Accelerated onset and delayed recovery of D-tubocurarine blockade with pancuronium in infants and children. Can J Anaesth 1987 ; 34 : 555-559 [crossref]
- [210] Smith CE, Donati F, Bevan DR Dose-response curves for succinylcholine : single versus cumulative techniques. Anesthesiology 1988 ; 69 : 338-342
- [211] Smith CE, Donati F, Bevan DR Potency of succinylcholine at the diaphragm and at the adductor pollicis muscle. Anesth Analg 1988 ; 67 : 625-630
- [212] Smith CE, Donati F, Bevan DR Differential effects of pancuronium on masseter and adductor pollicis muscles in humans. Anesthesiology 1989 ; 71 : 57-61 [crossref]
- [213] Smith CE, Donati F, Bevan DR Effects of succinylcholine at the masseter and adductor pollicis muscles in adults. Anesth Analg 1989 ; 69 : 158-162
- [214] Smith CE, Saddler JM, Bevan JC, Donati F, Bevan DR Pretreatment with non-depolarizing neuromuscular blocking agents and suxamethonium-induced increases in resting jaw tension in children. Br J Anaesth 1990 ; 64 : 577-581
- [215] Smith G, Dailling R, Williams TI Gastro-oesophageal pressure gradient changes produced by induction of anaesthesia and suxamethonium. Br J Anaesth 1978 ; 50 : 1137-1143
- [216] Sohn YJ, Bencini AF, Scaf AH, Kersten UW, Agoston S Comparative pharmacokinetics and dynamics of vecuronium and pancuronium in anesthetized patients. Anesth Analg 1986 ; 65 : 233-239
- [217] Sorooshian SS, Stafford MA, Eastwood NB, Boyd AH, Hull CJ, Wright PM Pharmacokinetics and pharmacodynamics of cisatracurium in young and elderly adult patients. Anesthesiology 1996 ; 84 : 1083-1091 [crossref]
- [218] Sparr HJ, Khuenl-Brady KS, Eriksson LI Pharmacodynamics and pharmacokinetics of rocuronium following continuous infusion in patients during intravenous anaesthesia. Eur J Anesthesiol 1994 ; 11 : 63-65
- [219] Stanski DR, Ham J, Miller RD, Sheiner LB Pharmacokinetics and pharmacodynamics of D-tubocurarine during nitrous oxide-narcotic and halothane anesthesia in man. Anesthesiology 1979 ; 51 : 235-241
- [220] Stovner J, Oftedal N, Holmboe J The inhibition of cholinesterases by pancuronium. Br J Anaesth 1975 ; 47 : 949-954
- [221] Sutherland GA, Squire IB, Gibb AJ, Marshall IG Neuromuscular blocking and autonomic effects of vecuronium and atracurium in the anaesthetized cat. Br J Anaesth 1983 ; 55 : 1119-1126
- [222] Szalados JE, Donati F, Bevan DR Nitrous oxide potentiates succinylcholine neuromuscular blockade in humans. Anesth Analg 1991 ; 72 : 18-21
- [223] Szenohradszky J, Fisher DM, Segredo V, Caldwell JE, Bragg P, Sharma ML , et al. Pharmacokinetics of rocuronium bromide (ORG 9426) in patients with normal renal function or patients undergoing cadaver renal transplantation. Anesthesiology 1992 ; 77 : 899-904 [crossref]
- [224] Szenohradszky J, Lau M, Brown R, Sharma ML, Fisher DM The effect of neostigmine on twitch tension and muscle relaxant concentration during infusion of mivacurium or vecuronium. Anesthesiology 1995 ; 83 : 83-87 [crossref]
- [225] Tempelhoff R, Modica PA, Jellish WS, Spitznagel EL Resistance to atracurium-induced neuromuscular blockade in patients with intractable seizure disorders treated with anticonvulsants. Anesth Analg 1990 ; 71 : 665-669
- [226] Torda T The nature of gentamicin-induced neuromuscular block. Br J Anaesth 1980 ; 52 : 325-329
- [227] Tsui D, Graham GG, Torda TA The pharmacokinetics of atracurium isomers in vitro and in humans. Anesthesiology 1987 ; 67 : 722-728
- [228] Tullock WC, Diana P, Cook DR, Wilks DH, Brandom BW, Stiller RL , et al. Neuromuscular and cardiovascular effects of high-dose vecuronium. Anesth Analg 1990 ; 70 : 86-90
- [229] Ungureanu D, Meistelman C, Frossard J, Donati F The orbicularis oculi and the adductor pollicis muscles as monitors of atracurium block of laryngeal muscles. Anesth Analg 1993 ; 77 : 775-779
- [230] Van den Broek L, Proost JH, Wierda JM Early and late reversibility of rocuronium bromide. Eur J Anaesthesiol 1994 ; 11(suppl 9) : 128-132
- [231] Van den Broek L, Wierda JM, Smeulers NJ, Proost JH Pharmacodynamics and pharmacokinetics of an infusion of Org 9487, a new short-acting steroidal neuromuscular blocking agent. Br J Anaesth 1994 ; 73 : 331-335
- [232] Vercruysse P, Bossuyt P, Hanegreefs G, Verbeuren TJ, Vanhoutte PM Gallamine and pancuronium inhibit prejunctional and postjunctional muscarinic receptors in canine saphenous veins. J Pharmacol Exp Ther 1979 ; 209 : 225-230
- [233] Viby-Mogensen J Correlation of succinylcholine duration of action with plasma cholinesterase activity in subjects with genotypically normal enzyme. Anesthesiology 1980 ; 53 : 517-520 [crossref]
- [234] Viggiano M, Soler C, Dumont JC, Pellissier D, François G Bloc neuromusculaire prolongé après injection de mivacurium. Ann Fr Anesth Reanim 1995 ; 14 : 502-504 [crossref]
- [235] Vigouroux D, Voltaire L Curarisation prolongée après mivacurium chez une patiente traitée par cyclophosphamide. Ann Fr Anesth Reanim 1995 ; 14 : 508-510 [crossref]
- [236] Ward S, Boheimer N, Weatherley BC, Simmonds RJ, Dopson TA Pharmacokinetics of atracurium and its metabolites in patients with normal renal function, and in patients in renal failure. Br J Anaesth 1987 ; 59 : 697-706
- [237] Ward S, Neill EA Pharmacokinetics of atracurium in acute hepatic failure (with acute renal failure). Br J Anaesth 1983 ; 55 : 1169-1172
- [238] Watkins J Second report from an anaesthetic reactions advisory service. Anaesthesia 1989 ; 44 : 157-159 [crossref]
- [239] Waud BE, Waud DR The margin of safety of neuromuscular transmission in the muscle of the diaphragm. Anesthesiology 1972 ; 37 : 417-422
- [240] Waud BE, Waud DR Comparison of the effects of general anesthetics on the end plate of skeletal muscles. Anesthesiology 1975 ; 43 : 540-547
- [241] Weber S, Brandom BW, Powers DM, Sarner JB, Woelfel SK, Cook DR , et al. Mivacurium chloride (BW 1090U)-induced neuromuscular blockade during nitrous oxide-isoflurane and nitrous oxide-narcotic anesthesia in adult surgical patients. Anesth Analg 1988 ; 67 : 495-499
- [242] Weintraub HD, Heisterkamp DV, Cooperman LH Changes in plasma potassium concentration after depolarizing blockers in anaesthetized man. Br J Anaesth 1969 ; 41 : 1048-1052
- [243] Welch RM, Brown A, Ravitch J, Dahl R The in vitro degradation of cisatracurium, the R, cis-R’-isomer of atracurium, in human and rat plasma. Clin Pharmacol Ther 1995 ; 58 : 132-142 [crossref]
- [244] Westra P, Houwertjes MC, Wesseling H, Meijer DK Bile salts and neuromuscular blocking agents. Br J Anaesth 1981 ; 53 : 407-415
- [245] Wierda JM, Beaufort AM, Kleef UW, Smeulers NJ, Agoston S Preliminary investigations of the clinical pharmacology of three short-acting non-depolarizing neuromuscular blocking agents. Org 9453, Org 9489 and Org 9487 Can J Anaesth 1994 ; 41 : 213-220 [crossref]
- [246] Wierda JM, De Wit AP, Kuizenga K, Agoston S Clinical observations on the neuromuscular blocking action of ORG 9426, a new steroidal non-depolarizing agent. Br J Anaesth 1990 ; 64 : 521-523
- [247] Wierda JM, Kleef UW, Lambalk LM, Kloppenburg WD, Agoston S The pharmacodynamics and pharmacokinetics of ORG 9426, a new non depolarizing neuromuscular blocking agent, in patients anaesthetized with nitrous oxide, halothane and fentanyl. Can J Anaesth 1991 ; 38 : 430-435 [crossref]
- [248] Wierda JM, Van den Broek L, Proost JH, Verbaan BW, Hennis PJ Time course of action and endotracheal intubating conditions of Org 9487, a new shortacting steroidal muscle relaxant ; a comparison with succinylcholine. Anesth Analg 1993 ; 77 : 579-584
- [249] Williams CH, Deutsch S, Linde HW, Bullough JW, Dripps RD Effects of intravenously administered succinylcholine on cardiac rate, rythm and arterial blood pressure in anesthetized man. Anesthesiology 1961 ; 22 : 947-954 [crossref]
- [250] Woelfel SK, Brandom BW, McGowan FX, Cook DR Clinical pharmacology of mivacurium in pediatric patients less than off years old during nitrous oxidehalothane anesthesia. Anesth Analg 1993 ; 77 : 713-720
- [251] Young AP, Sigman DS Allosteric effects of volatile anesthetics on the membrane-bound acetylcholine receptor protein, Part 1. Mol Pharmacol 1981 ; 20 : 498-505
- [252] Zhal K, Apfelbaum JE Muscle pain occurs after outpatient laparoscopy despite substitution of vecuronium after succinylcholine. Anesthesiology 1989 ; 70 : 408-411
Prs Claude Meistelman, Bertrand Debaene, François Donati. Pharmacologie des curares. EMC (Elsevier Masson SAS), Anesthésie-Réanimation, 36-355-A-10, 1998
(une étude comme je les aime. Elle démontre le paradoxe qu’augmenter la dépense, fait faire des économies. AB)
Le surcoût lié au sugammadex décrypté dans un service d’anesthésie-réanimation
Jeudi 27 octobre 2011
L’arrivée du nouveau décurarisant sugammadex (Bridion*, Merck & Co) dans un service d’anesthésie-réanimation a entraîné une augmentation des coûts de ce service, essentiellement du fait de ceux liés à son utilisation et non de ceux liés au changement de pratique de curarisation, rapporte une équipe nancéo-parisienne dans les Annales françaises d’anesthésie et de réanimation (Afar).
Le sugammadex cible deux curares stéroïdiens, peu utilisés en France, le rocuronium (Esmeron*) et le vécuronium (Norcuron*), également commercialisés par MSD. Son arrivée est donc amenée à modifier les pratiques en termes de curarisation ainsi que les coûts de l’anesthésie. Mais les auteurs soulignent que seulement deux études médico-économiques ont été menées, provenant du Royaume-Uni.
Julien Raft du centre Alexis-Vautrin à Nancy et ses collègues ont évalué le surcoût lié à l’arrivée du sugammadex dans le service d’anesthésie-réanimation de ce centre, après une année d’utilisation, comparée à l’année précédant son arrivée (la première commande date de juillet 2009), et ont rapporté le résultat à l’activité du service durant la période concernée.
La différence de coût de la curarisation/décurarisation entre les deux périodes a été de +27.587 euros.
Ce surcoût s’est avéré essentiellement lié au changement de pratique de la décurarisation, pour le sugammadex au détriment de la néostigmine -nettement moins chère-, ce coût étant passé de 658 euros à 28.225 euros.
Parallèlement, le coût lié à la modification des pratiques en termes d’utilisation des curares, en faveur du rocuronium, est compensé par la baisse de l’utilisation des autres curares, non stéroïdiens (atracurium, cisatracurium et mivacurium), dont le nombre de flacons commandés a diminué d’au moins 60% chacun entre les deux périodes.
Le coût de la curarisation n’a ainsi que marginalement augmenté, passant de 6.757 euros à 6.779 euros.
En moyenne, le coût d’une anesthésie a augmenté de 18,13 euros en ne tenant compte que des actes susceptibles d’utiliser un curare, et de 8,22 euros en tenant compte de l’ensemble de l’activité du département d’anesthésie au bloc opératoire.
Une analyse médico-économique, prenant en compte la récupération plus précoce avec le sugammadex et donc une rotation plus importante des salles d’opération, ainsi que les effets indésirables associés ou évités par cet agent, doit être réalisée pour établir son coût réel et son acceptabilité, concluent les auteurs.
En attendant, "ces résultats (...) pourraient permettre une extrapolation à d’autres structures hospitalières et une anticipation du surcoût du sugammadex, dans une négociation avec les décideurs économiques", suggèrent-ils.
(Afar, vol.30 n°10, p758-759)
/cd/eh/APM
redaction@apmnews.com
[CDOJP003]
Julien Raft, Médecin anesthésiste réanimateur
Département d’anesthésie-réanimation, Institut de cancérologie de Lorraine, avenue de Bourgogne, 54511 Vandœuvre-lès-Nancy, France
Une série d’articles provenant du site sciencedirect.com
Évaluation prospective de la curarisation chez 100 patients consécutifs
Jean-François Fiaud Xavier Raingeval Matthieu Langlois Étiennette Salivet de Fouchecour Frédéric Le Saché
- Introduction
L’évaluation de la décurarisation est une obligation après administration d’un curare. Elle repose sur l’utilisation d’un curamètre avec accéléromètre. Elle est définie par un TOF à 4/4 avec un rapport T1/T4 > 90 %. L’absence de mesure peut conduire à une curarisation résiduelle méconnue pouvant entrainer des complications respiratoires sévères (syndrome d’inhalation, pneumopathie, détresse respiratoire) du fait d’une altération des réflexes de déglutition, de la perméabilité des voies aériennes supérieures, de l’inefficacité de la toux ainsi qu’un inconfort des patients. Une évaluation clinique de la curarisation ne permet pas de mettre en évidence une curarisation résiduelle.
- Matériel et méthodes
Évaluer le niveau de curarisation des patients (TOF-Watch®, Organon) lors de leur admission en SSPI après une anesthésie générale avec administration de curare pour le contrôle des voies aériennes. Les proportions sont exprimées avec intervalle de confiance à 95 %. Un test de Mann et Whitney est réalisé pour comparer les variables non gaussiennes.
- Résultats
Cent patients consécutifs, opérés de chirurgie orthopédique, ont été inclus dans le cadre d’une évaluation des pratiques professionelles. Soixante-dix patients étaient curarisés lors de leur admission en SSPI. Douze patients étaient extubés à leur admission en SSPI dont 1 présentait une curarisation résiduelle (TOF 4/4 T1/T4 < 90 %) soit 8 % [IC95 %(0–23 %)]. Trente-quatre patients ont été antagonisés après réalisation du TOF. La durée médiane entre la dernière administration des curares et l’admission en SSPI était respectivement de 1 h 21 min dans le groupe curarisé vs 2 h 01 dans le groupe non curarisé (p < 0,0001 ; test de Mann Whitney) (Fig. 1).
- Discussion
Une curarisation résiduelle peut être retrouvée très à distance de l’administration du curare. Une évaluation systématique de la curarisation des patients doit être réalisée avant extubation. La mesure du TOF, après une anesthésie générale ayant recours à des curares semble indispensable pour sécuriser nos pratiques vis-à-vis d’évènements rares.
— -
Mise à disposition du couple : rocuronium/sugammadex : impact sur le risque de curarisation résiduelle au CHU Félix-Guyon (Réunion) entre 2009 et 2013
GillesBoulesteix1 SanelHamzic2 Toky Rafanomezantsoa1 frédéric Rouillard2 Cyril Ferdynus1 Michel Bohrer1
- Introduction
Le risque de curarisation résiduelle (CR) est un risque trop fréquent (> 40 %) en anesthésie, avec les curares non dépolarisants : atracurium (A), cisatracurium (C), rocuronium (R). La prévention de ce risque passe par l’utilisation systématique d’un curamétre chez tous patients recevant un curare, associé à une antagonisation lorsque le T4/T1 est < 0,9 avant extubation. L’antagonisation peut s’effectuer à l’aide de la prostigmine (P), ou bien par le sugammadex (S) pour le rocuronium. En 2010, ont été introduits dans notre établissement le rocuronium et son antagoniste, le sugammadex sans restriction. Nous avons voulu déterminer si l’introduction du R/S a eu un impact sur nos pratiques quotidiennes et évaluer le risque de curarisation résiduelle.
- Matériel et méthodes
Étude rétrospective de type avant/après. La sélection des dossiers patients s’est faite par randomisation : 250 en 2009 et 250 en 2013. L’année 2009, période à laquelle le R et le S n’étaient pas disponibles dans notre CHU FG, était comparée à l’année 2013, où l’utilisation du R et S était possible.
- Résultats
Les deux groupes étaient comparables pour l’âge, le poids, le sexe, le type de chirurgie, l’ASA, le nombre d’AG, d’intubation, et de patients curarisés. En 2009, l’A était le seul curare non dépolarisant utilisé dans notre établissement. Environ 11,76 % des patients curarisés ont reçu une antagonisation (P). Un pourcentage de 67,27 des patients ayant reçu un curare non dépolarisant avaient un risque de CR. En 2013, les curares employés sont le R (66,1 %) suivi par l’A (11,86 %) et le C (3,4 %). Environ 48,33 % des patients curarisés ont reçu une antagonisation par P (44,4 %) ou par le S (64,1 %). Environ 22,92 % des patients ayant reçu un curare non dépolarisant ont un risque de CR (Tableau 1).
- Discussion
La mise à disposition du rocuronium/sugammadex dans notre établissement en 2010 a contribué à une diminution par trois du risque de CR : 67,2 % en 2009 vs 22,9 % en 2013 (p < 0,0001). Le monitorage de la curarisation est en nette augmentation : 30,1 % en 2009 vs 87,5 % en 2013 (p < 0,0001) sans être encore systématique. Le recours à l’antagonisation a été multiplié par 4 depuis l’arrivée du R/S : 11,76 % en 2009 vs 48,33 % en 2013 (p < 0,0001). Contrairement à l’étude 2, l’apport du couple R/S a modifié nos pratiques professionnelles qui ont conduit à une large diminution du risque de curarisation résiduelle.
— -
La décurarisation pharmacologique par prostigmine modifie le monitorage de la nociception
Georges Daccache Nathalie Tri Romain Delassus Jennifer Bourgès Kelly Monthé-Sagan Jean-Luc Hanouz
- Introduction
l’Analgesia Nociception Index (ANI) et le Surgical Pleth Index (SPI) sont deux indices récemment proposés pour le monitorage de la balance analgésie/nociception. Ils sont plus sensibles que la fréquence cardiaque et la pression artérielle pour ajuster les morphiniques peropératoires [1]. La prostigmine (PG) à la dose de 20 μg/kg est un anticholinestérasique recommandé pour accélérer la levée d’un bloc neuromusculaire peu profond [2]. Nous avons émis l’hypothèse que les effets parasympathomimétques de la PG pourraient influencer le calcul de l’ANI et du SPI.
- Matériel et méthodes
Dans cette étude monocentrique observationnelle, 64 patients opérés de chirurgie vasculaire sous propofol ajusté à l’entropie (40-60) et rémifentanil ajusté sur l’ANI (50–70) et curarisés par atracurium ont été inclus. L’ANI, l’énergie spectrale totale (EST), le SPI et la fréquence cardiaque (FC) ont été enregistrés toutes les minutes pendant 10 minutes après injection de 20 μg/kg de PG pour la réversion d’un bloc peu profond (T4/T1 entre 40 et 60 %). Les patients ayant nécessité une injection d’atropine durant ces 10 minutes ont été exclus. Les données sont exprimées en médiane [IC 95 %] ou moyenne ± DS et comparées par un test de Friedmann (ANOVA). p < 0,05 est significatif.
- Résultats
Au total 49 patients, âgés de 67 ± 13 ans et d’indice de masse corporelle de 27 ± 4 kg/m2 ont été analysés. La FC, l’ANI et le SPI ont diminué de façon significative par rapport aux valeurs avant injection tandis que l’EST a augmenté de façon significative (p < 0,01). Les variations de l’ANI du SPI et de l’EST sont résumées sur la Fig. 1.
- Discussion
L’injection de prostigmine entraîne une diminution de la FC mais aussi des indices de monitorage de la nociception (ANI et SPI) pendant au moins 10 minutes. Ces variations sont à prendre en considération dans l’interprétation de ces paramètres pour l’ajustement des morphiniques.
— -
Comparaison des performances du TOF Watch et du TOF Scan pour évaluation la curarisation résiduelle chez des patients obèses morbides
Arselen Ghribi David Hajage Marylin Smeyers Manuel Sukami Gilles Rubéo-Lisa Catherine Fournier Hawa Keita-Meyer
- Introduction
La curarisation résiduelle est définie par la présence d’une valeur du train de quatre (TdQ) mesuré à l’adducteur du pouce inférieure à 90 %. Elle induit des effets délétères bien identifiés, source d’une majoration de la morbidité et de la mortalité périopératoire en l’absence d’une antagonisation pharmacologique [1]. Les patients obèses morbides sont une population particulièrement à risque de complications respiratoires en cas de curarisation résiduelle. Le but de notre étude était de comparer les performances de 2 moniteurs de la curarisation, l’un nécessitant un calibrage, le TOF Watch® et l’autre non calibré le TOF Scan®, pour estimer le niveau de curarisation résiduelle chez des patients obèses morbides.
- Matériel et méthodes
Étude pilote prospective observationnelle, menée entre janvier et février 2015 dans un centre universitaire. Les patients inclus bénéficiaient d’une chirurgie bariatrique (by-pass, sleeve gastrectomie) par voie laparoscopique sous anesthésie générale avec intubation oro-trachéale et curarisation pour l’intubation (succynilcholine ou atracurium) et la chirurgie (atracurium). Les données recueillies étaient démographiques, chirurgicales, anesthésiques ainsi que les données de la curarisation résiduelle. Celle-ci était évaluée dès l’obtention de 4 réponses au TdQ par le rapport T4/T1 affiché. La concordance entre les 2 appareils a été analysée par le coefficient de concordance de corrélation (CCC) et un graphique de Bland et Altman avec limites d’agrément (1,96 X écart-type [ET]).
- Résultats
Vingt et un patients ont été inclus dans l’étude. Les caractéristiques de la population sont présentées dans le Tableau 1. La comparaison des performances des 2 moniteurs pour l’évaluation de la curarisation résiduelle a pu être faite pour 12 patients. Le CCC (95 % IC) des rapports T4/T1 était de 0,32 (0,12–0,71). La concordance par graphique de BA est présentée dans la Fig. 1. Le rapport T4/T1 n’était pas significativement différent (biais à -6,25 %) mais avec une large dispersion (limites d’agrément à ± 65,7 %).
- Discussion
Cette étude préliminaire menée sur des patients obèses morbides, montre qu’après curarisation par atracurium, il existe une mauvaise concordance entre le TOF Watch® et le TOF Scan® pour l’estimation de la curarisation résiduelle. Cette variabilité peut influencer de façon plus ou moins appropriée la décision de décurarisation chez cette population à risque. L’absence de biais significatif est en accord avec la littérature dans d’autres contextes [2]. Cependant, l’importance de la dispersion nécessite des études avec des collectifs plus importants pour valider ce résultat et en déterminer les raisons.
— -
Comment améliorer la pertinence du double burst stimulation dans le diagnostic de la curarisation résiduelle ?
Charlotte Dei Svaldi Denis Schmartz Claude Meistelman Thomas Fuchs-Buder
- Introduction
Le monitorage neuromusculaire reste fondamental dans la prévention des complications liées à la curarisation résiduelle, définie par un rapport T4/T1 < 0,9 au train de quatre (Td4) à l’adducteur de pouce [1]. Le double burst stimulation (DBS) est spécifiquement destiné à évaluer la curarisation résiduelle et a une plus grande sensibilité à la dépister que la détection manuelle du rapport T4/T1 au Td4 [2]. Néanmoins, il est généralement accepté que le rapport T4/T1 est seulement autour de 0,6 quand on ne ressent pour la première fois plus de faiblesse au DBS et ceci limite ainsi fortement son utilité. Ce travail avait pour but d’étudier le délai entre la constatation d’un premier DBS sans fatigue et la récupération d’un rapport T4/T1 > 0,9. La considération de ce délai pourrait améliorer la pertinence du DBS.
- Matériel et méthodes
Cette étude prospective et monocentrique, approuvée par le CPP, portait sur des patients majeurs, dont le score ASA évalué en consultation était de 1 à 3, bénéficiant d’une dose unique de 0,6 mg/kg de rocuronium avant intubation. L’induction et l’entretien de l’anesthésie étaient assurés par propofol, rémifentanil et desflurane. La profondeur du bloc neuromusculaire était évaluée à l’adducteur du pouce par accéléromyographie à l’aide du moniteur TOF-Watch SX® avec calibration via le mode 2. La stimulation était débutée de manière continue par Td4. À partir du moment où les quatre réponses réapparaissaient, la stimulation était basculée en mode DBS. L’épuisement des réponses musculaires était alors observé de façon visuelle toutes les minutes. Au moment où les deux contractions étaient pour la première fois visuellement identiques, instant appelé « récupération DBS », la valeur du rapport T4/T1 était notée, un chronomètre était déclenché et la stimulation était à nouveau basculée vers le mode Td4. Le délai entre l’instant « récupération DBS » et le moment où le rapport T4/T1 devenait supérieur à 0,9 était noté. Les valeurs étaient exprimées en médianes (IC95 %).
- Résultats
Vingt patients étaient inclus. La valeur médiane du rapport T4/T1 à l’instant « récupération DBS » était de 0,68 (IC 95 % 0,65–0,72) et le délai médian de récupération complète d’un bloc neuromusculaire induit par rocuronium à partir de cet instant était de 17 minutes (IC 95 % 12–26).
- Discussion
Alors qu’une mesure ponctuelle du DBS à la fin de la chirurgie ne permet en aucun cas d’attester d’une récupération neuromusculaire suffisante, nos données préliminaires suggèrent que mesurer de façon répétée le DBS pour déterminer le moment où l’épuisement musculaire disparaît et par la suite respecter un délai de 20–25 minutes à partir de cet instant pourrait améliorer sa pertinence dans le diagnostic de la curarisation résiduelle. Cette stratégie pourrait s’appliquer dans les cas où la curarisation n’est nécessaire que pour la pratique de l’intubation trachéale, en chirurgie orthopédique par exemple. Ainsi, dans le contexte où la chirurgie devrait se prolonger au-delà de ce délai de 20–25 minutes à partir du moment où disparaît l’épuisement musculaire au DBS, on pourrait être assuré d’une récupération neuromusculaire suffisante à la fin de l’intervention.
Faut-il curariser les grands prématurés avant de les intuber ?
Publié le 16/08/2018
Les intubations trachéales des nouveau-nés gagnent à être faites après une prémédication quand elles ne sont pas urgentes. La prémédication comprend typiquement une sédation-analgésie et une curarisation. Certains néonatologistes se limitent à une sédation-analgésie, notamment chez les grands prématurés (≤32 sem.). Leur argument est que si l’intubation ne se passe pas bien le patient peut aller encore plus mal s’il est paralysé et n’a aucun mouvement respiratoire spontané.
L’intérêt d’un curare dans le cocktail de prémédication est apprécié chez les grands prématurés par une étude observationnelle prospective analysant 237 intubations non urgentes, dont 27 échanges de tube, de nouveau-nés de ≤ 1 500 g hospitalisés entre février 2015 et juin 2017 dans deux Unités de Soins Intensifs Néonatales [USIN] de Seattle (USA).
Le premier opérateur était un médecin en formation ou une infirmière spécialisée dans près de 80 % des cas et il avait droit à deux essais d’intubation au maximum. Avant un essai, le nouveau-né était oxygéné et, entre deux essais, il était ventilé au masque. Les données ont été saisies sur le champ dans un registre électronique.
Les intubations ont eu lieu à 9 jours, au terme de 28 sem. et au poids de 953 g (valeurs médianes).
Dans une USIN la prémédication de 109 intubations a été réduite à une sédation-analgésie (cocktail : atropine + morphine ± une benzodiazépine) ; dans l’autre USIN celle de 50 intubations a compris une curarisation avec un curare non dépolarisant (cocktail : atropine + fentanyl ± une benzodiazépine + rocuronium). Pour 74 intubations (31 %), il n’y a pas eu de prémédication du tout !
Sous curare, les intubations ont été réussies du premier coup une fois sur deux (nombre d’essais médian : 1 ; intervalle interquartile 25-75 : 1-2,25) versus 1 à 2 essais sans curarisation (p < 0,05) et sans prémédication.
Elles ont entraîné moins d’évènements indésirables, hors bradycardies et désaturations, que les intubations sans curarisation et sans prémédication (22 % vs 38,5 % et 43 %, respectivement ; p < 0,001 pour les comparaisons deux à deux). Surtout, elles n’ont provoqué aucun accident grave, à savoir arrêt cardiaque, intubation œsophagienne prolongée, inhalation d’un vomissement, hypotension artérielle à traiter, laryngospasme, hyperthermie maligne, pneumothorax/pneumomédiastin ou traumatisme des voies respiratoires, alors qu’il y a eu 9 accidents graves sans curarisation (p < 0,05) et 5 accidents graves sans prémédication.
Les bradycardies en cours d’intubation ont été moins profondes lors des intubations sous curare (décélération médiane : 20 bpm vs 35 bpm sans curarisation –p < 0,05- et 40 bpm sans prémédication –p < 0,01-). En revanche, les désaturations sévères, définies par une baisse de la Sp02 ≥ 20 % pendant l’intubation, ont été moins fréquentes sans prémédication.
Ainsi, d’après les données du registre des intubations, la prémédication avec un curare augmente la facilité et la sécurité de l’intubation trachéale non urgente des grands prématurés. L’intubation a plus de chances de réussir au 1er essai chez un patient calme et relâché, et un patient vite intubé est plus stable. Cependant, on ne peut exclure le rôle de facteurs inhérents aux USIN : les grands prématurés curarisés ont tous été recrutés dans la même unité.
Une alternative à la prémédication avec un curare est l’anesthésie au propofol, un anesthésique à action rapide. Elle a été testée contre l’association d’un morphinique et d’un curare dans un essai contrôlé et randomisé mené dans six USIN de la région parisienne (2).
En conclusion, il paraît important de récapituler les conditions à remplir pour prémédiquer avec un curare ou le propofol, un nouveau-né à intuber, et ceci quel que soit son terme : une indication non urgente, un accès IV, et les ressources humaines et matérielles d’une USIN, parce que les curares et le propofol suppriment les mouvements respiratoires pendant plusieurs minutes.
Dr Jean-Marc Retbi
– Références
- Krick J et coll. : Premedication with paralysis improves intubation success and decreases adverse events in very low birth weight infants : a prospective cohort study. J Perinatol 2018 ; 38 : 681-686.
- Durrmeyer X et coll. : Effect of atropine with propofol vs atropine with atracurium and sufentanil on oxygen desaturation in neonates requiring nonemergency intubation : a randomized clinical trial. JAMA 2018 ; 319 : 1790-1801.
Copyright jim.fr
NDLR : utiliser du fentanyl sur des grands prématurés... Cela semble un peu dépassé voire inapproprié. Mais ce n’est que mon avis. (AB)
Anesthésie ou prémédication avec curarisation avant d’intuber un nouveau-né ?
Publié le 22/08/2018
Chez un nouveau-né vigile, l’intubation trachéale provoque des réactions physiologiques délétères, telles que bradycardie, hypoxie, hypertension artérielle, hypertension intracrânienne, et des lésions traumatiques de la bouche et du larynx. Sauf urgence, elle ne se conçoit pas sans une prémédication dont l’objectif est d’obtenir un état de sédation avant de débuter l’intubation ou d’administrer un myorelaxant (curare).
L’anesthésie au propofol est évaluée comme alternative à la prémédication avec curarisation dans un essai contrôlé et randomisé, en double aveugle, mené dans six Unités de Soins Intensifs Néonatales [USIN] françaises, et arrêté prématurément en 2016 pour des raisons extra-médicales.
L’essai a été achevé par 171 nouveau-nés de tous termes, au lieu des 200 prévus : 89 (poids et terme médians : 1,31 kg, 30 sem.) dans le bras « propofol », 82 (poids et terme médians : 1,13 kg, 29 sem.) dans le bras « atracurium + sufentanil », le curare et l’opioïde choisis. En cas de sédation insuffisante, du propofol ou de l’atracurium ont été réinjectés (Tableau). Toutes les intubations ont été réalisées par voie nasale.
Tableau. Séquences médicamenteuses, hors placébos
Les résultats sont analysés en intention de traiter.
Avec le propofol, la procédure d’intubation –de l’injection d’atropine à la réussite de l’intubation- a demandé un peu plus de temps qu’avec l’atracurium et le sufentanil (moyennes : 6,6 min vs 4,9 min ; Différence Absolue ajustée [DAa] : 1,7 min ; p < 0,05), mais pas plus d’essais pour réussir l’intubation.
L’anesthésie au propofol a procuré une sédation de moins bonne qualité et de plus courte durée que la prémédication avec curarisation, avec des temps d’apnée respectifs de 14 min et 33 min (p < 0,01).
Pas moins de désaturations prolongées avec le propofol
Contrairement à ce qui était espéré, les désaturations prolongées (SpO2 < 80 % pendant > 60 sec.), le critère de jugement principal, n’ont pas affecté moins d’enfants sous propofol que sous atracurium + sufentanil (60 % vs 66 % ; p = 0,38). Un poids ≤ 1kg ou > 1kg à l’inclusion n’a pas d’interaction.
Sur les monitorages des constantes vitales, la fréquence cardiaque et la pression artérielle moyenne ont plus baissé avec le propofol qu’avec l’atracurium + le sufentanil (DAa des moyennes de la FC et de la PAm entre les deux bras : - 10 bpm pendant les 10 premières min et – 6 mmHg pendant les 30 premières min) alors que la SpO2 a plus baissé avec la curarisation.
Les échographies cérébrales post-intubation n’ont pas révélé plus d’aggravation des hémorragies intraventriculaires avec le propofol qu’avec la curarisation.
Les évènements indésirables sont survenus à des taux similaires dans les deux bras (30 % sous propofol vs 35 % sous atracurium + sufentanil), les plus fréquents étant les hypotensions artérielles dues au propofol (11/83 patients) et les rigidités de la paroi thoracique dues au sufentanil (11/80 patients), bien que le curare ait été administré avant l’opioïde dans le présent essai. Aucun décès n’est en relation avec les médicaments.
En conclusion, concernant les désaturations prolongées, l’essai n’a pas mis en évidence de différence entre une anesthésie au propofol et une prémédication avec curarisation dans les intubations naso-trachéales non urgentes réalisées dans les USIN. Est-ce dû à un manque de puissance de l’essai ou à l’équivalence véritable des deux stratégies ? Il n’est pas exclu que le bilan du neuro-développement des patients prévu à 2 ans fasse pencher la balance du côté d’une stratégie. Plus fondamentalement on peut aussi se demander si l’association médicamenteuse optimale ne reste pas à déterminer. En attendant, on n’oubliera pas que l’effet bradycardisant et hypotenseur connu du propofol contre-indique son utilisation chez les nouveau-nés qui ont une mauvaise hémodynamique.
Dr Jean-Marc Retbi
RÉFÉRENCE
Durrmeyer X et coll. : Effect of atropine with propofol vs atropine with atracurium and sufentanil on oxygen desaturation in neonates requiring nonemergency intubation. A randomized clinical trial. JAMA 2018 ; 319 : 1790-1801. Doi:10100/jama.2018.3708
source : jim.fr
Moins de réadmissions imprévues avec une décurarisation par sugammadex !
Publié le 08/04/2019
A la différence de la néostigmine (aux effets cholinergiques indésirables et à la forte variabilité d’action inter-individuelle), le recours à l’inversion de la curarisation par le sugammadex permet une curarisation profonde et donc de bonnes conditions chirurgicales avec une moindre curarisation résiduelle. Qui dit meilleures conditions opératoires, dit meilleurs résultats chirurgicaux, moindre taux de réadmissions et moindre coûts. Qui dit moindre curarisation résiduelle dit moindre taux de survenue de complications respiratoires.
Il avait déjà été démontré que l’utilisation du sugammadex est associée à un moindre taux de complications postopératoires, mais son impact sur le taux de réadmissions non prévues à J30 n’était pas connu.
Lacune qu’une étude sud-coréenne monocentrique, rétrospective et observationnelle de patients ayant bénéficié d’une chirurgie abdominale majeure entre 2010 et 2017, au cours de laquelle le rocuronuim a été le seul curare utilisé, s’est proposée de lever. La chirurgie abdominale majeure a été définie comme une intervention ayant duré plus de deux heures avec une perte sanguine supérieure à 500 mL.
L’objectif primaire était la recherche d’une différence dans les taux de réadmission imprévues à J30 entre les réversions par sugammadex (≥ 2 mg kg−1) ou néostigmine (0,03–0,05 mg kg−1). Les objectifs secondaires étaient les mesures des durées d’hospitalisation après la chirurgie et des dépenses hospitalières (exclusions faites de celles liée à l’anesthésie et à la chirurgie).
Parmi les 3 464 patients inclus dans l’étude, 461 (13,3 %) patients avaient été réadmis à J30 pour les motifs suivants : douleur (156/461, 33,8 %) ; symptômes gastro-intestinaux (74/461, 16,1 %) ; fièvre (70/461, 15,2 %).
Néostigmine n’est plus ma copine
L’analyse en régression logistique de 1 479 patients âgés de plus de 19 ans (sugammadex : 355 ; néostigmine : 1 124) a montré que dans le groupe sugammadex, le taux d’incidence à J30 des réadmissions imprévues a été de 34 % inférieur (Odds ratio OR : 0,66, intervalle de confiance à 95 % IC 95 % : 0,46–0,96, p = 0,031), la durée d’hospitalisation de 20 % plus courte (coefficient exponentiel de régression : 0,80, IC 95 % : 0,77–0,83, p < 0,001), et les dépenses hospitalières réduites de 24 % (coefficient exponentiel de régression : 0,76, IC 95 % : 0,67–0,87, p < 0,001).
Fait étrange, chez les patients habitant à plus de 50 km de l’hôpital, le taux d’incidence des réadmissions imprévues a été de 68 % inférieur dans le groupe sugammadex (OR : 0,32, IC 95 % : 0,13–0,79, p=0,014) par rapport au groupe néostigmine, alors qu’il n’y avait pas de différence significative chez les patients vivant à moins de 50 km de l’hôpital (p = 0,319). Comprenne qui pourra !
Sous réserve d’une confirmation par des études prospectives monocentriques, et bien que le recours à la vieille néostigmine n’ait plus les faveurs de la plupart des anesthésistes, voici quelques arguments solides de plus pour tourner la page définitivement.
Dr Bernard-Alex Gaüzère
RÉFÉRENCE
Oh TK, Oh AY, Ryu JH, Koo BW, Song IA, Nam SW, Jee HJ. : Retrospective analysis of 30-day unplanned readmission after major abdominal surgery with reversal by sugammadex or neostigmine. Br J Anaesth., 2019 ; 122(3) : 370-378. doi : 10.1016/j.bja.2018.11.028.
Source : jim.fr
Quelques articles en anglais (la SOFIA a décidé de se plier à cette injonction obligatoire pour les publications, et l’anglais est incontournable).
Reversal of rocuronium-induced neuromuscular block : is it time for sugammadex to replace neostigmine ?
Br J Anaesth. 2019 Aug ; 123(2) : e157–e159.
Published online 2019 May 16. doi : 10.1016/j.bja.2019.04.045
PMCID : PMC6676226
PMID : 31104759
M. Carron,∗ A. De Cassai, and G. Ieppariello
Author information Article notes Copyright and License information Disclaimer
Editor—It was with great interest that we read the recent paper by Oh and colleagues1 in the British Journal of Anaesthesia, which compared sugammadex with neostigmine for the reversal of rocuronium-induced neuromuscular block (NMB), focusing on the impact of these agents on 30-day unplanned readmission after major abdominal surgery. Oh and colleagues1 performed a mixed-effects logistic regression analysis of 1479 patients (sugammadex : 355 ; neostigmine : 1124), and found that the incidence of 30-day unplanned readmission was 34% lower in patients receiving sugammadex compared with those receiving neostigmine (odds ratio : 0.66, P=0.031).1
Sugammadex has been found to be superior to neostigmine for the reversal of rocuronium-induced NMB, with a lower risk of adverse postoperative events.2 Use of sugammadex may also increase operating room efficiency by accelerating NMB reversal and reducing the risk of residual NMB, thereby producing potential economic benefits.3, 4, 5, 6 However, it remains unclear whether sugammadex has a positive effect on healthcare expenditures during the postoperative period compared with neostigmine.7, 8 Recently, postoperative residual curarisation (PORC) was not found to be independently associated with increased hospital costs (adjusted incidence rate ratio, 1.04 ; P=0.22),7 despite an increased risk of unplanned ICU admission.5, 7, 9 Neostigmine, particularly if not used at the appropriate dose or time,9 may predispose to an increased risk of 30-day unplanned readmission.10 Conversely, sugammadex has the potential to reduce the risk of 30-day unplanned readmission.1 Therefore, the study by Oh and colleagues1 may represent an opportunity to further evaluate the potential benefits of sugammadex on postoperative healthcare expenditures.
Oh and colleagues1 reported a readmission rate after major abdominal surgery of 13.3% for their entire study population. This rate seems a little high, especially as 41.0% of their patients underwent urologic or gynaecologic procedures, which often have low readmission rates.1 The American College of Surgeons National Surgical Quality Improvement Program, for example, reported 30-day readmission rates of 3.8% among 25 119 women undergoing hysterectomy11 and 5.8% among 23 108 patients undergoing inpatient urologic surgery.12 However, Oh and colleagues1 provided no information about the specific types of operations, and 30-day unplanned readmission rates tend to increase with increasing surgical complexity. Wilbur and colleagues13 reported a 30-day readmission rate of 11.0% among 1605 women at an academic gynaecologic oncology service. Damle and colleagues14 found that readmission occurred in 13.7% of 70 484 patients after colorectal surgery. Ejaz and colleagues15 reported readmission in 17.2% of 4114 patients undergoing colorectal (42.8%), pancreatic (40.4%), or hepatic resection (16.9%) surgeries.
Unfortunately, Oh and colleagues1 did not provide data regarding the cost of readmission, which could be used in a cost-benefit analysis of sugammadex compared with neostigmine in their tertiary teaching hospital. However, at another tertiary care hospital, Ejaz and colleagues15 reported that readmission increased the total index hospitalisation costs by nearly $5000 ($29 312 vs $24 321 ; P<0.001) after abdominal surgery. Damle and colleagues14 examined data from the University Health System Consortium and found that readmission may increase the total index hospitalisation costs by nearly $13 000 ($26 917 vs $13 817 ; P<0.001). Both readmission costs are consistent with the second ($6493) and third ($11 514) readmission cost quartiles reported for readmission costs after major abdominal surgeries (i.e. abdominal aortic aneurysm repair, cystectomy, oesophagectomy, and pancreatectomy), based on analyses of inpatient databases for NY, IA, NC, and WA states in USA.16 Furthermore, Wilbur and colleagues13 reported a mean cost of $25 416 per readmission (total readmission-related costs during the study period were $4 523 959). Based on these reports, sugammadex may yield considerable economic benefits despite the higher direct costs of reversing moderate rocuronium-induced NMB with sugammadex compared with neostigmine.4, 5, 17 However, whether sugammadex results in potential cost savings4, 5 will depend on readmission costs and the effective reduction in 30-day unplanned readmission rates (Fig. 1).
(cliquez sur l’image)
Example of cost-saving analysis of reversal of moderate rocuronium-induced neuromuscular block. We performed a cost-benefit analysis based on the assumptions that use of sugammadex, compared with neostigmine, reduced the incidence of 30-day unplanned readmission by 34%,1 and that neostigmine did not affect the 30-day unplanned readmission rate.9, 10 Data from the study by Ejaz and colleagues15 were used for the total population number, baseline readmission number and rate, and readmission cost in our analysis. The total costs for reversal of moderate rocuronium-induced NMB using sugammadex or neostigmine were evaluated. On the basis of the potential costs of reversal drugs,4, 5 the difference in direct NMB reversal costs between sugammadex and neostigmine was assumed to be $80. Considering the total cost of readmissions and the total cost of NMB reversal for the total population, the model shows that sugammadex becomes a cost-effective treatment as the 30-day readmission rate decreases from baseline to 34% below baseline (data below the x-axis). The corresponding reduction in number of readmissions can also be determined (data above the x-axis). A treatment was considered cost-saving if the gain obtained by reducing the 30-day unplanned readmission rate was greater than the total NMB reversal cost necessary for treatment. In our model, sugammadex appears to be cost saving compared with neostigmine when it reduces the 30-day unplanned readmission rate by at least 10% (orange line) or 5% (grey dotted line) from baseline for readmission costs. NMB, neuromuscular block.
Although the statistical analysis represents an important strength of their study, it is not an RCT and thereby has the drawbacks of all retrospective observational studies.1 It is unclear whether all patients were controlled for the level of recovery of neuromuscular function after reversal drug administration. If not, the effects of PORC may not have been completely excluded.1 Kotake and colleagues18 found that after antagonism of rocuronium-induced NMB in the absence of neuromuscular monitoring (objective or subjective), a train-of-four ratio <0.9 was present with both reversal drugs, although it was less frequent with sugammadex (five of 117 patients [4.3%]) than with neostigmine (26 of 109 patients [23.9%]) (P<0.001). PORC may predispose to an increased risk of unplanned ICU or hospital admission.9, 10 In a controlled setting (e.g. train-of-four ratio ≥0.9 via accelomyographic monitoring), reduction of the rate of 30-day unplanned readmission after major abdominal surgery with sugammadex compared with neostigmine may be less than that reported by Oh and colleagues.1 Hence, in an uncontrolled setting, sugammadex may have a favourable economic impact1 ; however, in a controlled setting with correct dosing of reversal drugs to obtain complete reversal of NMB based on the level of measured NMB, this benefit may be less relevant.
In a recent retrospective evaluation, after propensity matching patients undergoing colorectal surgery, no significant difference was found between 30-day readmission rates after sugammadex or neostigmine.19 Oh and colleagues1 found that sugammadex not only reduced 30-day unplanned readmission rates by 34%, but also shortened hospital length of stay by 20% and reduced related hospital charges by 24%, compared with neostigmine. Taken together, these results provide further support for the potential economic benefits of sugammadex. While their findings also suggest that sugammadex potentially improves patient care and healthcare expenditures, these findings require confirmation by additional, controlled studies.
Declarations of interest
The authors are supported only by departmental funds. MC has received payments for lectures from Merck Sharp & Dohme (MSD), Italy. ADC and GI have no interests to disclose.
References
- 1. Oh T.K., Oh A.Y., Ryu J.H. Retrospective analysis of 30-day unplanned readmission after major abdominal surgery with reversal by sugammadex or neostigmine. Br J Anaesth. 2019 ;122:370–378. [PubMed] [Google Scholar]
- 2. Hristovska A.M., Duch P., Allingstrup M., Afshari A. Efficacy and safety of sugammadex versus neostigmine in reversing neuromuscular blockade in adults. Cochrane Database Syst Rev. 2017 ;8:CD012763. [PMC free article] [PubMed] [Google Scholar]
- 3. Brueckmann B., Sasaki N., Grobara P. Effects of sugammadex on incidence of postoperative residual neuromuscular blockade : a randomized, controlled study. Br J Anaesth. 2015 ;115:743–751. [PubMed] [Google Scholar]
- 4. Paton F., Paulden M., Chambers D. Sugammadex compared with neostigmine/glycopyrrolate for routine reversal of neuromuscular block : a systematic review and economic evaluation. Br J Anaesth. 2010 ;105:558–567. [PMC free article] [PubMed] [Google Scholar]
- 5. Carron M., Baratto F., Zarantonello F., Ori C. Sugammadex for reversal of neuromuscular blockade : a retrospective analysis of clinical outcomes and cost-effectiveness in a single center. Clinicoecon Outcome Res. 2016 ;8:43–52. [PMC free article] [PubMed] [Google Scholar]
- 6. Insinga R.P., Joyal C., Goyette A., Galarneau A. A discrete event simulation model of clinical and operating room efficiency outcomes of sugammadex versus neostigmine for neuromuscular block reversal in Canada. BMC Anesthesiol. 2016 ;16:114. [PMC free article] [PubMed] [Google Scholar]
- 7. Grabitz S.D., Rajaratnam N., Changani K. The effects of postoperative residual neuromuscular blockade on hospital costs and intensive care unit admission : a population-based cohort study. Anesth Analg Adv Access Published January. 2019 ;8 [PubMed] [Google Scholar]
- 8. Ünal D.Y., Baran İ., Mutlu M., Ural G., Akkaya T., Özlü O. Comparison of sugammadex versus neostigmine costs and respiratory complications in patients with obstructive sleep apnoea. Turk J Anaesthesiol Reanim. 2015 ;43:387–395. [PMC free article] [PubMed] [Google Scholar]
- 9. Bose S., Xu X., Eikermann M. Does reversal of neuromuscular block with sugammadex reduce readmission rate after surgery ? Br J Anaesth. 2019 ;122:294–298. [PubMed] [Google Scholar]
- 10. Thevathasan T., Shih S.L., Safavi K.C. Association between intraoperative non-depolarising neuromuscular blocking agent dose and 30-day readmission after abdominal surgery. Br J Anaesth. 2017 ;119:595–605. [PubMed] [Google Scholar]
- 11. Merkow R.P., Ju M.H., Chung J.W. Underlying reasons associated with hospital readmission following surgery in the United States. JAMA. 2015 ;313:483–495. [PubMed] [Google Scholar]
- 12. Stone B.V., Cohn M.R., Donin N.M. Evaluation of unplanned hospital readmissions after major urologic inpatient surgery in the era of accountable care. Urology. 2017 ;109:94–100. [PubMed] [Google Scholar]
- 13. Wilbur M.B., Mannschreck D.B., Angarita A.M. Unplanned 30-day hospital readmission as a quality measure in gynecologic oncology. Gynecol Oncol. 2016 ;143:604–610. [PubMed] [Google Scholar]
- 14. Damle R.N., Cherng N.B., Flahive J.M. Clinical and financial impact of hospital readmissions after colorectal resection : predictors, outcomes, and costs. Dis Colon Rectum. 2014 ;57:1421–1429. [PubMed] [Google Scholar]
- 15. Ejaz A., Gonzalez A.A., Gani F., Pawlik T.M. Effect of index hospitalization costs on readmission among patients undergoing major abdominal surgery. JAMA Surg. 2016 ;151:718–724. [PubMed] [Google Scholar]
- 16. Jacobs B.L., He C., Li B.Y. Variation in readmission expenditures after high-risk surgery. J Surg Res. 2017 ;213:60–68. [PMC free article] [PubMed] [Google Scholar]
- 17. Zaouter C., Mion S., Palomba A., Hemmerling T.M. A short update on sugammadex with a special focus on economic assessment of its use in North America. J Anesth Clin Res. 2017 ;8:740. [Google Scholar]
- 18. Kotake Y., Ochiai R., Suzuki T. Reversal with sugammadex in the absence of monitoring did not preclude residual neuromuscular block. Anesth Analg. 2013 ;117:345–351. [PubMed] [Google Scholar]
- 19. Chae Y.J., Joe H.B., Oh J., Lee E., Yi I.K. Thirty-day postoperative outcomes following sugammadex use in colorectal surgery patients ; retrospective study. J Clin Med. 2019 ;8:97. [PMC free article] [PubMed] [Google Scholar]
Articles from BJA : British Journal of Anaesthesia are provided here courtesy of Elsevier
Quelques articles en anglais (la SOFIA a décidé de se plier à cette injonction obligatoire pour les publications, et l’anglais est incontournable).
Incidence of hypersensitivity and anaphylaxis with sugammadex
Author links open overlay panelK. Chris Min MD, PhD
Tiffany Woo MS Christopher Assaid PhD Jacqueline Mc Crea Pharm D Deborah M.GurnerMD, PhD Christine McCrary Sisk BS Franklin Adkinson MD W. Joseph Herring MD, PhD
https://doi.org/10.1016/j.jclinane.2018.03.018
- Sugammadex is indicated for reversal of moderate and deep neuromuscular blockade.
- The incidence of hypersensitivity with sugammadex was assessed.
- No increase in hypersensitivity was observed with sugammadex vs. placebo/neostigmine.
- There were no confirmed cases of anaphylaxis in the pooled studies.
- Reports of anaphylaxis during post-marketing use of sugammadex were rare.
Abstract
Study objective
To evaluate the incidence of hypersensitivity and anaphylaxis after administration of sugammadex.
Design
Retrospective analysis.
Setting
Sugammadex clinical development program and post-marketing experience.
Patients
Surgical patients and healthy volunteers who received sugammadex or placebo/comparator with anesthesia and/or neuromuscular blockade (NMB).
Interventions
Sugammadex administered as 2.0 mg/kg at reappearance of the second twitch, 4.0 mg/kg at 1–2 post-tetanic count, or 16.0 mg/kg at 3 min after rocuronium 1.2 mg/kg.
Measurements
Three analytical methods were used : 1) automated MedDRA queries ; 2) searches of adverse events (AEs) consistent with treatment-related hypersensitivity reactions as diagnosed by the investigator ; and 3) a retrospective adjudication of AEs suggestive of hypersensitivity by a blinded, independent adjudication committee (AC). In addition, a search of all post-marketing reports of events of hypersensitivity was performed, and events were retrospectively adjudicated by an independent AC. Anaphylaxis was determined according to Sampson Criterion 1.
Main results
The pooled dataset included 3519 unique subjects who received sugammadex and 544 who received placebo. The automated MedDRA query method showed no apparent increase in hypersensitivity or anaphylaxis with sugammadex as compared to placebo or neostigmine. Similarly, there was a low overall incidence of AEs of treatment-related hypersensitivity (<1%), with no differences between sugammadex and placebo or neostigmine. Finally, the retrospective adjudication of AEs suggestive of hypersensitivity showed a low incidence of hypersensitivity (0.56% and 0.21% for sugammadex 2 mg/kg and 4 mg/kg, respectively), with an incidence similar to subjects who received placebo (0.55%). There were no confirmed cases of anaphylaxis in the pooled studies. During post-marketing use, spontaneous reports of anaphylaxis occurred with approximately 0.01% of sugammadex doses.
Conclusions
Subjects who received sugammadex with general anesthesia and/or NMB had a low overall incidence of hypersensitivity, with no apparent increase in hypersensitivity or anaphylaxis with sugammadex as compared to placebo or neostigmine.
© 2018 Elsevier Inc. All rights reserved.
Anaphylaxie cliniquement suspectée induite par le sugammadex chez un patient atteint du syndrome de Weaver subissant une chirurgie de mammoplastie restrictive : un rapport de cas avec la revue de la littérature
La revue Médecine (Baltimore), 97 (3), e9661 Janv.2018
Nurdan Bedirli , Berrin Işık , Mehrnoosh Bashiri , Kutluk Pampal , Ömer Kurtipek
PMID : 29505006 PMCID : PMC5779775 DOI : 10.1097 / MD.0000000000009661
Abstrait
- Justification : Le sugammadex est un dérivé de la cyclodextrine qui encapsule des bloqueurs neuromusculaires stéroïdiens et est signalé comme un médicament sûr et bien toléré. Dans ce rapport de cas, nous présentons un patient qui a développé une anaphylaxie de grade 3 juste après l’administration de sugammadex.
- Préoccupations des patientes : une femme de 22 ans diagnostiquée d’un syndrome de Weaver devait subir une mammoplastie bilatérale et une résection d’une résection unilatérale du tissu mammaire accessoire. L’anesthésie a été induite et maintenue par le propofol, le rocuronium et le rémifentanil. À la fin de l’opération, du sugammadex a été administré et a entraîné initialement une hypotension et une bradycardie, puis la situation s’est aggravée par une contraction ventriculaire prématurée et une bigémine avec tachycardie, bronchospasme et hypoxie.
- Diagnostic : La réaction anaphylactique de grade 3 de l’échelle de gravité clinique Ring et Messmer s’est produite juste après l’injection de sugammadex et le patient a développé une hypotension prolongée avec des arythmies cardiaques récurrentes en 12 heures postopératoires.
- Interventions : Le traitement a commencé par des injections en bolus d’éphédrine, d’épinéphrine, de lidocaïne, de stéroïdes et d’antihistaminiques et s’est poursuivi avec des doses de bolus de lidocaïne et une perfusion de norépinéphrine pendant la période postopératoire.
- Résultats : L’état général de la patiente s’est amélioré à la normale 3 heures après l’injection de sugammadex, et elle a été transférée à l’unité de soins intensifs. Aux 2e et 8e heures de suivi en unité de soins intensifs, elle a développé une contraction ventriculaire prématurée et une bigémine avec une fréquence cardiaque de 130 à 135 battements / min, qui est revenue au rythme sinusal avec 50 mg de lidocaïne. Après cela, aucun symptôme n’a été observé et le patient a été renvoyé à la clinique de chirurgie plastique le lendemain.
- Leçons : Le Sugammadex peut entraîner une réaction anaphylactique potentiellement mortelle, même chez un patient qui n’a jamais été exposé au médicament. De plus, un effondrement cardiovasculaire prolongé et des arythmies cardiaques peuvent survenir.
Copyright © 2017 Les auteurs. Publié par Wolters Kluwer Health, Inc. Tous droits réservés.
Choc anaphylactique après administration de Sugammadex, induit par la formation d’un complexe Sugammadex-Rocuronium - Rapport de cas
Coréen J Anesthesiol, 72 (5), 495-499 Oct.2019
Gunn Hee Kim 1 , Won Seop Choi 1 , Ji Eun Kim 1 , Mi Jung Yun 1 , Min Seok Koo 1 , Miyoung Kwon 1 , Hyungseok Seo 2
Affiliations développer
PMID : 30481948 PMCID : PMC6781209 DOI : 10.4097 / kja.d.18.00232
- Abstrait
Contexte : Sugammadex est un agent d’inversion des bloqueurs neuromusculaires non dépolarisants et largement utilisé dans le monde en raison de son inversion rapide et efficace du blocage neuromusculaire, malgré ses avantages, plusieurs cas de choc anaphylactique induit par le sugammadex ont été signalés.
- Cas : Un homme de 42 ans a développé un choc anaphylactique dans l’unité de soins postanesthésiques. Initialement, le sugammadex était suspecté d’être l’agent causal, mais un test cutané intradermique a révélé des résultats négatifs. Un autre test cutané a été réalisé avec le complexe sugammadex-rocuronium qui a donné des résultats positifs.
- Conclusions : Les anesthésiologistes et les professionnels de la santé doivent être conscients de la possibilité d’anaphylaxie à partir du complexe sugammadex-rocuronium, ainsi qu’à partir du sugammadex ou du rocuronium seuls.
Mots-clés : choc anaphylactique ; Cyclodextrine ; Épinéphrine ; Hypersensibilité ; Rocuronium ; Sugammadex.
Skin test after anaphylaxis to sugammadex
Sung Jin Hong, Ji Yung Lee
Department of Anesthesiology and Pain Medicine, College of Medicine, The Catholic University of Korea, Seoul, Korea
Korean Journal of Anesthesiology 2020 ;73(1):83-84.
Published online : October 22, 2019
DOI : https://doi.org/10.4097/kja.19408
Corresponding author : Ji Yung Lee, M.D., PhD. Department of Anesthesiology and Pain Medicine, Yeouido St. Mary’s Hospital, College of Medicine, The Catholic University of Korea, 10 63-ro, Yeoungdeungpo-gu, Seoul 07345, Korea
Tel : +82-2-3779-1268, Fax : +82-2-783-0368, Email : anesthalee@naver.com
Received August 16, 2019 Accepted October 21, 2019
Copyright © The Korean Society of Anesthesiologists, 2020
This is an open-access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
We read the case report titled ‘Anaphylactic shock after sugammadex administration, induced by formation of a sugammadex-rocuronium complex by Kim et al. [1] with great interest. As a result of their effective treatment, the patient fortunately, recovered. To find the causative agent of anaphylactic shock, the authors performed skin tests four days after anaphylaxis. However, it is recommended that skin testing is conducted at least four to six weeks after the occurrence of a suspected perioperative allergic reaction [2]. This time interval allows for the resolution of clinical symptoms and clearance of the suspected drugs and anti-allergic medications [3]. Skin tests performed earlier than this can result in a negative reaction due to mediator depletion after anaphylaxis. When tests are performed earlier than four weeks, only positive skin test results are useful and a negative skin test needs to be interpreted with caution. Therefore, the authors’ skin test was done too early and there is doubt about its reliability.
Generally, appropriate positive and negative controls are always necessary in skin tests for suspected hypersensitivity reactions to confirm skin reactivity [4]. Usually, histamine is used as a positive control and saline as a negative control. Unfortunately, the authors did not include a positive control in their test. If the patient had shown a negative response to histamine, the patient’s negative response to sugammadex should be a false result.
Certain drugs also decrease skin test responses and must be discontinued prior to a skin test. Antihistamines and glucocorticoids fall into this category. Five days of drug-free intervals after H1-antihistamines and three days after less than 50 mg of short-term prednisolone equivalent are recommended because those drugs can decrease skin test reactivity [4]. Whether short and long-term systemic corticosteroids need to be stopped prior to testing is controversial [5]. The authors administered 60 μg/kg of dexamethasone and 50 μg/kg of chlorpheniramine after anaphylaxis. In addition to the skin test performed too early, drugs decreasing skin reactivity might have contributed to the negative response to all drugs.
If testing is performed earlier than four to six weeks, repeat testing after four to six weeks may be considered. In the case of negative skin test results, a second evaluation is advisable. The authors performed a skin test to sugammadex-rocuronium complex after a month. If the authors performed a skin test for sugammadex again with the sugammadex-rocuronium complex, the results would have been very clear. In our opinion, the interpretation of skin tests in this report was not complete because the skin tests did not meet the conditions of adequate timing after anaphylaxis and the appropriate use of positive and negative controls.
Presently, there are no established guidelines for skin testing for anaphylaxis to sugammadex. The reported allergenic epitopes were sugammadex, gamma-cyclodextrin, or sugammadex-rocuronium complex. Accurate skin tests using positive and negative controls at the right time will be helpful to identify the allergenic epitopes of sugammadex.
NOTES
No potential conflict of interest relevant to this article was reported.
Author Contributions
Sung Jin Hong (Conceptualization ; Investigation ; Supervision)
Ji Yung Lee (Writing – original draft, review & editing)
Go to : Goto
References
1. Kim GH, Choi WS, Kim JE, Yun MJ, Koo MS, Kwon M, et al. Anaphylactic shock after sugammadex administration, induced by formation of a sugammadex-rocuronium complex -a case report. Korean J Anesthesiol 2019 ; 72 : 495–9.
crossref pmid pdf
2. Soetens F, Rose M, Fisher M. Timing of skin testing after a suspected anaphylactic reaction during anaesthesia. Acta Anaesthesiol Scand 2012 ; 56 : 1042–6.
crossref pmid
3. Brockow K, Romano A. Skin tests in the diagnosis of drug hypersensitivity reactions. Curr Pharm Des 2008 ; 14 : 2778–91.
crossref pmid
4. Turkalj M, Erceg D, Martinuš M, Babić E, Karin M, Bevanda M. Diagnosis of perioperative anaphylaxis. Psychiatr Danub 2019 ; 31 : S50–9.
pmid pdf
5. Scolaro RJ, Crilly HM, Maycock EJ, McAleer PT, Nicholls KA, Rose MA, et al. Australian and New Zealand anaesthetic allergy group perioperative anaphylaxis investigation guidelines. Anaesth Intensive Care 2017 ; 45 : 543–5.
Anaphylaxie au sugammadex : faut-il se préoccuper de l’expérience japonaise ?
Louise Savic 1, Sinisa Savic 2 , 3, Philip M. Hopkins 1 , 4 , ∗ , Correspondance information about the author Philip M. HopkinsEnvoyer un e-mail à l’auteur Philip M. Hopkins"
DOI : https://doi.org/10.1016/j.bja.2020.01.003
Publié en ligne:22 janvier 2020
Accepté:2 janvier 2020
Abstrait
Le sugammadex, une γ-cyclodextrine modifiée, est efficace pour inverser les effets des bloqueurs neuromusculaires aminostéroïdes (NMBA), même chez les patients présentant un blocage neuromusculaire profond. 1 , 2 Cette capacité a conduit à promouvoir la combinaison rocuronium / sugammadex comme alternative à la succinylcholine pour un début rapide et une courte durée d’effet, les effets indésirables du médicament à la succinylcholine étant considérés comme une raison importante de la nécessité d’un remplacement. Une étude observationnelle multicentrique de l’incidence de l’anaphylaxie au sugammadex au Japon publiée dans cette édition du British Journal of Anesthesia , 3 cependant, soulève la possibilité que l’incidence de l’anaphylaxie au sugammadex soit si élevée qu’elle fasse de l’association rocuronium / sugammadex la combinaison NMBA / agent d’inversion la plus risquée en termes d’effets indésirables du médicament.
Hypersensibilité au Sugammadex et mécanismes sous-jacents : une étude randomisée de volontaires sains non anesthésiés
P J. de Kam 1 , †, H. Nolte 1, Bon 1, M. Yunan 1, DE Williams-Herman 1, J. Burggraaf 2, C. Kluft 3, NF Adkinson 4, C. Cullen 1, PS Skov 5, JH Levy 6 , ‡, DJ van den Dobbelsteen 7 , ¶, ELGM van Heumen 7, FCM van Meel 7, D. Glassner 1, T. Woo 1, KC Min 1
Sugammadex : la piqûre dans la queue ?
L. Savic 1, S. Savic 2 , 3, PM Hopkins 1 , 4 ,
DOI : https://doi.org/10.1016/j.bja.2018.07.014
Publié en ligne:14 août 2018
Le sugammadex, une molécule de cyclodextrine modifiée, encapsule le rocuronium et d’autres agents de blocage neuromusculaire aminostéroïde (NMBA) pour fournir une inversion rapide et fiable du bloc neuromusculaire. Par rapport à l’agent d’inversion standard, la néostigmine, la qualité et la vitesse d’inversion sont impressionnantes, inversant le bloc modéré environ 17 fois plus rapidement 1 et avec moins d’épisodes d’inversion partielle de la récupération. 2 , 3 En outre, il peut fournir une inversion du blocus profond, 3 , 4 une caractéristique impossible avec la néostigmine. On peut soutenir que le sugammadex est l’agent d’inversion idéal chaque fois qu’un NMBA aminostéroïde est utilisé, car il peut potentiellement accélérer la récupération et améliorer le délai d’exécution dans les listes chirurgicales. 5Le sugammadex a également été proposé comme agent pour traiter l’anaphylaxie induite par le rocuronium, avec des rapports de cas isolés dans la littérature suggérant une inversion presque immédiate de la cascade d’anaphylaxie lorsque le sugammadex a été administré. 6 , 7
Le principal obstacle à l’utilisation du sugammadex, dans la majorité des pays, est le coût. Elle est jusqu’à 20 fois plus chère que la néostigmine à une dose de 2 à 4 mg kg -1 (pour l’inversion d’un bloc modéré), et clairement encore plus chère avec la dose de 16 mg kg -1 (pour l’inversion d’un bloc profond). Au Japon, cependant, le système national d’assurance maladie subventionne les soins aux patients et le coût des médicaments ne semble qu’une considération mineure pour les anesthésistes. Ici, le sugammadex est utilisé en routine, et environ 10% de la population a reçu du sugammadex pendant une période de 8 ans de 2010 à 2018 8.
Une autre préoccupation concernant l’utilisation du sugammadex est le risque d’hypersensibilité. En effet, le sugammadex n’a été approuvé aux États-Unis qu’en 2015 (par rapport à 2008 en Europe et en Australie) en raison de préoccupations concernant l’hypersensibilité. Il est ironique de constater que, comme le sugammadex a été approuvé par la Food and Drug Administration des États-Unis (FDA), les preuves de l’hypersensibilité au médicament en milieu clinique semblent se renforcer : au Japon, le sugammadex est désormais la principale cause d’anaphylaxie périopératoire. 8
Deux articles dans ce numéro du British Journal of Anesthesia rapportent des enquêtes sur l’hypersensibilité au sugammadex. 9 , 10 Ces essais cliniques entrepris avant l’approbation de la FDA et financés par le fabricant de sugammadex ont vraisemblablement été effectués en vue de dissiper les inquiétudes concernant l’incidence d’hypersensibilité, alors qu’ils peuvent avoir eu l’effet inverse. Les deux essais consistaient à administrer du sugammadex à des doses de 4 ou 16 mg kg -1ou placebo, répété deux fois à des intervalles hebdomadaires, à des sujets sains non anesthésiés. L’objectif était d’établir le taux d’hypersensibilité et de déterminer si l’hypersensibilité devenait plus probable après des administrations répétées. Ils ont également cherché à déterminer le mécanisme sous-jacent d’hypersensibilité, et en particulier s’il s’agissait d’un processus à médiation immunoglobuline (Ig) E ou IgG. Après l’achèvement de la collecte des données dans la première étude, 9 écarts de protocole avec le potentiel d’introduire un biais dans l’évaluation de l’hypersensibilité ont été identifiés, ce qui a conduit à la répétition de l’étude. dix
Les événements indésirables pouvant représenter une hypersensibilité ont été évalués par un comité indépendant et aveugle. Les auteurs ont défini l’hypersensibilité comme « des symptômes et des signes de maladie allergique objectivement reproductibles déclenchés par l’exposition à un stimulus défini à une dose tolérée par des personnes non hypersensibles ». L’anaphylaxie a également été définie comme « l’apparition aiguë de symptômes cutanés +/- muqueux, avec au moins un compromis respiratoire, cardiovasculaire ou neurologique ».
Dans la première étude 9, l’incidence d’hypersensibilité confirmée a été établie à 0,7% dans le groupe 4 mg kg -1 , 4,7% dans le groupe 16 mg kg -1 et 0% dans le groupe placebo. Un des sujets d’hypersensibilité du groupe de 16 mg kg -1 a été jugé pour avoir souffert d’anaphylaxie. Dans la deuxième étude, 6,6% du groupe 4 mg kg -1 ont été jugés comme ayant présenté une hypersensibilité, 9,5% du groupe 16 mg kg -1 et 1,3% du groupe placebo. Encore une fois, il y a eu un seul cas d’anaphylaxie dans le groupe à 16 mg kg -1 .
Dans l’ensemble, entre les deux études, parmi les sujets ayant reçu au moins une dose de sugammadex à l’une ou l’autre dose, il y avait une incidence d’hypersensibilité confirmée de 5% (32/597). L’incidence de l’anaphylaxie chez tous les sujets recevant du sugammadex était de 0,3% (2/597). Les deux cas d’anaphylaxie sont survenus dans le groupe de 16 mg kg -1 , ce qui a donné une incidence d’anaphylaxie à cette dose plus élevée de 0,7% (2/298).
Chez six sujets (trois dans chaque étude), une hypersensibilité s’est produite lors de la première dose de sugammadex ; les six sujets étaient dans les groupes de 16 mg kg -1 . Deux ont été autorisés à poursuivre l’étude ; le reste a interrompu l’étude. Dans les deux qui ont continué, l’un avait connu une toux et une urticaire généralisée, tandis que l’autre présentait des bouffées vasomotrices, de l’urticaire et des signes thoraciques. Bien que les symptômes se soient résolus en quelques heures sans traitement, il y avait un risque évident de réaction plus sévère lors de la réexposition, qui n’a pas pu être exclu par les enquêteurs. La façon dont ce risque a été communiqué aux sujets n’est pas claire.
Sur la base de ces travaux, une incidence de réactions d’hypersensibilité légères ou modérées de 1:20 pourrait être attendue pour chaque exposition au sugammadex, et une incidence d’anaphylaxie d’environ 1 : 150 lorsqu’elle est utilisée à une dose de 16 mg kg -1 . Ce sont des taux alarmants pour les anesthésistes. Comparé aux médicaments déjà largement utilisés au cours de la période périopératoire, le risque accru d’anaphylaxie semble injustifiable. Par exemple, la succinylcholine et la teicoplanine, largement reconnues comme des causes d’allergie relativement courantes, ont une incidence d’anaphylaxie de 11/100 000 et 16/100 000, respectivement. 11Cependant, ces taux élevés d’hypersensibilité au sugammadex ne semblent pas se traduire dans la pratique clinique. Au Japon, l’incidence de l’hypersensibilité a été calculée à partir d’un audit de la base de données nationale et d’une étude monocentrique, à 1 : 34–40 000 et 1 : 2500, respectivement. 8 Sur la base des taux d’anaphylaxie confirmés décrits dans les documents par de Kam et ses collègues 9 et Min et ses collègues, 10 on aurait pu attendre des dizaines de milliers de cas au Japon seul, mais seulement 284 cas ont été signalés au total. Dans une étude d’un an sur l’anaphylaxie périopératoire au Royaume-Uni, un seul cas confirmé d’anaphylaxie au sugammadex a été signalé par environ 64 000 administrations. 11
Une explication de l’écart apparent entre ces résultats est la sous-déclaration de l’anaphylaxie périopératoire, un problème qui a déjà été souligné. 12 , 13 Cependant, lorsque de nouveaux médicaments sont mis sur le marché, il y a une tendance à surdéclarer les effets indésirables. Cela a été noté avec le rocuronium, qui semblait initialement plus allergène que les autres NMBA 14, mais dont il a récemment été démontré qu’il était à peu près égal à l’atracurium dans sa propension à provoquer des allergies. 11 Il est peu probable que des épisodes fréquents de réactions allergiques graves disparaissent largement pendant plusieurs années.
Une autre explication est que les cas d’hypersensibilité légers ou modérés ne sont pas considérés comme cliniquement pertinents pendant la période périopératoire, ou pas suffisamment graves pour être reconnus. L’hypersensibilité n’est pas une réponse tout ou rien, mais affiche un spectre de gravité. Des cas plus légers peuvent se manifester chez le patient éveillé comme une sensation de malaise, de démangeaisons ou d’anxiété ; ces symptômes seront ignorés chez les patients anesthésiés. Des signes objectifs, tels que la tachycardie, des bouffées vasomotrices ou un bronchospasme léger, peuvent être attribués aux effets de l’anesthésie et de la manipulation des voies respiratoires, ou être physiquement masqués par des champs opératoires. Il est également possible que l’utilisation désormais systématique de la dexaméthasone en tant qu’antiémétique réduise davantage la gravité de l’hypersensibilité. Cependant, l’anesthésie générale fournit un grand nombre des cofacteurs, qui pourraient aggraver ou précipiter l’anaphylaxie (et, notamment anaphylaxie non allergique). La co-administration de plusieurs molécules grandes et complexes, les effets du stress chirurgical et émotionnel, de la chaleur et des infections concomitantes peuvent tous agir pour déstabiliser les mastocytes et produire une libération systémique d’histamine. Il serait raisonnable de penser que la toux observée chez un sujet éveillé avec du sugammadex peut se manifester chez le patient anesthésié sous la forme d’une profonde irritation des voies respiratoires et est susceptible d’être exacerbée par une manipulation des voies aériennes. Cela signifierait que l’anesthésie générale augmenterait, et non diminuerait, le risque d’hypersensibilité. La gravité des réactions d’hypersensibilité est essentiellement imprévisible, et la probabilité de réactions, qui sont apparemment légères dans un contexte de recherche, se traduisant par des réactions graves sur le plan clinique, est inconnue.15 , 16 , 17
Nous ne devons être ni faussement rassurés par la douceur apparente de la plupart des réactions ni trop alarmés par le taux de réactions dans ces deux études, car on ne sait pas comment cela se traduit dans la pratique clinique. Nous avons toutefois du mal à accepter l’implication selon laquelle le plus grand risque d’anaphylaxie lorsque des doses plus élevées sont utilisées est atténué par la disponibilité immédiate d’un anesthésiste et d’un équipement de réanimation. dix L’apparition de l’anaphylaxie pendant toute anesthésie est un événement critique avec une morbidité et une mortalité associées. Le besoin de doses plus élevées de sugammadex est plus susceptible de survenir dans des scénarios cliniques déjà difficiles (par exemple l’induction de séquence rapide échouée) ; L’anaphylaxie en tant qu’événement critique supplémentaire pourrait être écrasante pour le patient et l’anesthésiste, quelle que soit la proximité du personnel clé et de l’équipement.
Notre compréhension de la probabilité de réactions d’hypersensibilité nocives pourrait être facilitée par l’élucidation des mécanismes sous-jacents, et de Kam et ses collègues 9 et Min et ses collègues 10ont effectué un travail exploratoire à ce sujet. À notre connaissance, il n’y a pas d’autre travail mécanique dans ce domaine. Tout d’abord, ils ont recherché des preuves de dégranulation des mastocytes, grâce à des mesures en série des mastocytes-tryptases sériques (MCT). Aucun des sujets n’a démontré de changement dynamique du TCM, y compris les deux avec une anaphylaxie confirmée. Cela soulève la possibilité d’un mécanisme pour le tableau clinique de l’anaphylaxie n’impliquant pas la dégranulation des mastocytes. Les possibilités comprennent des mécanismes médiés par le complément ou les basophiles, ou d’autres mécanismes non élucidés. Alternativement, une augmentation du MCT n’a pas été observée parce que la réaction n’était pas suffisamment sévère pour générer cela, ou les résultats du MCT étaient faussement négatifs. Le TCM n’est pas sensible à 100% 18 et les résultats négatifs n’excluent pas un diagnostic d’anaphylaxie.
Des preuves de sensibilisation aux IgE (ou IgG) chez les sujets avec et sans preuve clinique d’hypersensibilité ont également été recherchées par de Kam et ses collègues 9 et Min et ses collègues 10 à l’ aide de tests pour les anticorps IgE ou IgG spécifiques au sugammadex, et des tests cutanés. Les tests cutanés, en présence de témoins négatifs et positifs appropriés, suggèrent un effet spécifique à médiation IgE contre le composé testé. Ni les preuves sériques ni les tests cutanés d’anticorps anti-sugammadex ne prouvent l’allergie, car tous les patients présentant des anticorps spécifiques ne présenteront pas de tableau clinique d’allergie lors de l’exposition. 19Les deux modalités de test manquent de reproductibilité et aucune n’a une spécificité ou une sensibilité à 100%. Pour de nombreux médicaments, la valeur prédictive négative de ces tests est faible et la valeur prédictive positive n’est pas de 100%. 20 Des travaux supplémentaires sont nécessaires pour valider les tests cutanés et sériques pour les anticorps sugammadex avant de tirer des conclusions sur ces résultats. Les articles de de Kam et ses collègues 9 et Min et ses collègues 10 décrivent également les tests d’activation des basophiles (MTD) comme un marqueur d’hypersensibilité et des études pour déterminer si une activation du complément ou du contact s’est produite. Ce sont en grande partie des outils de recherche, bien qu’il existe certaines preuves au Japon pour l’utilité clinique des MTD. 21
En conclusion, le travail présenté par de Kam et ses collègues 9 et Min et ses collègues 10 nous laisse peut-être plus de questions que de réponses. L’écart entre leurs constatations de taux élevés d’hypersensibilité et les preuves cliniques d’hypersensibilité périopératoire reste difficile à rationaliser. Il existe des preuves incontestées d’un risque d’allergie au sugammadex, mais il est trop tôt pour quantifier précisément ce risque. Cependant, sur la base des connaissances actuelles, il serait au moins prudent d’éviter l’utilisation de sugammadex dans le traitement d’une allergie suspectée au rocuronium. L’administration d’un médicament potentiellement hautement allergène, pour traiter une anaphylaxie en cours, semble au mieux être un triomphe d’espoir sur les preuves.
À mesure que la structure des prix du sugammadex change, nous prévoyons probablement une expansion importante de son utilisation. Avec cela, il est prévisible, sera une augmentation des effets indésirables graves. Ce qui reste inconnu est de savoir si ce sera aux taux prévus par de Kam et ses collègues 9 et Min et ses collègues.10
en version anglaise
Comparaison de l’incidence de l’anaphylaxie entre le sugammadex et la néostigmine : une étude observationnelle multicentrique rétrospective
Masaki Orihara 1, Tomonori Takazawa 2 , ∗ , Information de correspondance sur l’auteur Tomonori TakazawaEnvoyezuncourriel à l’auteur Tomonori Takazawa", Tatsuo Horiuchi 1, Shinya Sakamoto 1, Kazuhiro Nagumo 1, Yukinari Tomita 3, Akihiro Tomioka 4, Nagahide Yoshida 5, Akihiko Yokohama 6, Shigeru Saito 1 , 2
Rédacteur en chef : Hugh C Hemmings Jr
DOI : https://doi.org/10.1016/j.bja.2019.10.016
Publié en ligne:29 novembre 2019
Abstrait
Contexte
Bien que des cas d’anaphylaxie causée par le sugammadex aient été signalés, son incidence reste incertaine. À l’inverse, aucune étude n’a évalué l’incidence de l’anaphylaxie à la néostigmine.
Les méthodes
Il s’agissait d’une étude observationnelle multicentrique rétrospective de patients ayant subi une intervention chirurgicale sous anesthésie générale entre 2012 et 2016 pour comparer l’incidence de l’anaphylaxie avec le sugammadex avec celle de la néostigmine dans quatre hôpitaux tertiaires au Japon. Pour garantir la qualité du diagnostic, seuls les cas ayant des antécédents cliniques suggérant une anaphylaxie, ainsi que des résultats positifs issus de tests in vitro ou in vivo , ont été évalués.
Résultats
Sur un total de 49 532 patients ayant reçu une anesthésie générale inclus dans cette étude, 18 cas d’anaphylaxie ont été signalés, dont six étaient attribuables au sugammadex et aucun à la néostigmine. Il n’y a eu aucun décès attribuable à l’anaphylaxie. L’incidence de l’anaphylaxie causée par tous les médicaments ou par le sugammadex a été calculée comme 0,036% (intervalle de confiance à 95% [IC] : 0,022–0,057%) et 0,02% (du nombre de cas de sugammadex) (IC à 95% : 0,007–0,044% ), respectivement.
Conclusions
Les résultats suggèrent que la néostigmine pourrait être plus sûre que le sugammadex lors de l’évaluation uniquement de l’incidence de l’anaphylaxie. Nous pensons que tous les anesthésistes peuvent reconsidérer le choix de l’agent d’inversion des bloqueurs neuromusculaires.
Points clés de l’éditeur
•L’incidence de l’anaphylaxie au sugammadex n’a pas été bien définie.
•Une analyse rétrospective multicentrique de patients sous anesthésie générale sur une période de 4 ans au Japon a été réalisée pour évaluer l’anaphylaxie au sugammadex et à la néostigmine.
•Sur les 49 532 cas d’anesthésie générale analysés, il y a eu 18 cas d’anaphylaxie (0,036%), dont six réactions au sugammadex (0,02%) et aucune à la néostigmine.
•L’incidence de l’anaphylaxie confirmée en laboratoire était plus élevée pour le sugammadex que pour la néostigmine, qui doit être prise en compte avec d’autres facteurs dans le choix des agents d’inversion.
Le sugammadex est un dérivé synthétique de la cyclodextrine qui encapsule les agents de blocage neuromusculaire amino-stéroïdes (NMBA), en particulier le rocuronium, pour inverser leur effet. 1 Sugammadex a été développé pour surmonter les problèmes liés à la néostigmine, notamment l’inversion incomplète occasionnelle du bloc neuromusculaire et la nécessité d’une utilisation concomitante d’un médicament anticholinergique. Depuis le lancement du sugammadex, plusieurs études comparatives entre le sugammadex et la néostigmine ont été menées. 2 , 3 , 4 , 5 Une méta-analyse a révélé les avantages du sugammadex par rapport à la néostigmine en termes de temps de récupération à la fois du bloc neuromusculaire modéré et profond. 4De plus, il y avait significativement moins d’événements indésirables composites avec le sugammadex par rapport à la néostigmine, y compris la bradycardie, les nausées et vomissements postopératoires et les signes globaux de paralysie résiduelle postopératoire. 4 Bien que cette méta-analyse soit basée sur des données à grande échelle impliquant 4206 sujets de 41 études, les réactions d’hypersensibilité n’ont pas été évaluées de manière adéquate. L’incidence de l’hypersensibilité périopératoire étant très faible, entre un cas pour mille et des dizaines de milliers, 6 , 7 études plus approfondies sont nécessaires pour estimer l’incidence de l’hypersensibilité aux médicaments individuels, y compris le sugammadex et la néostigmine.
Un nombre important de cas d’anaphylaxie induite par le sugammadex ont été signalés. 8 , 9 Selon la base de données de sécurité post-commercialisation, environ 11,5 millions de patients aux États-Unis avaient reçu du sugammadex au 31 mars 2015. Sur la base de 273 cas d’anaphylaxie signalés avec 11,5 millions de doses, l’incidence de l’anaphylaxie était estimée à environ 24 pour 100 000 doses de sugammadex (0,024%), en supposant que 10% des cas ont été signalés. 10 Dans une récente étude japonaise monocentrique, six cas d’anaphylaxie étaient soupçonnés d’être causés par le sugammadex au cours d’une période d’étude de 3 ans. Cette étude a estimé l’incidence de l’anaphylaxie induite par le sugammadex à un cas sur 2500 (0,039%) sur la base d’une population d’étude de 15 479 patients. 11Dans une étude d’un an sur l’anaphylaxie périopératoire au Royaume-Uni, un seul cas confirmé d’anaphylaxie au sugammadex a été signalé parmi environ 64 000 administrations (0,0016%). 7 En revanche, l’incidence de l’ anaphylaxie induite par néostigmine est inconnue, bien qu’il y ait peu de rapports de cas d’anaphylaxie attribuable à la néostigmine. 12 , 13
Alors que le sugammadex ne semble être utilisé que dans un nombre limité de cas dans de nombreux pays en raison de son coût élevé, il est couramment utilisé au Japon, et on estime que 10% de la population a reçu du sugammadex pendant une période de 8 ans de 2010 à 2018 14. Cependant, il n’est pas clair comment l’utilisation du sugammadex a progressé au Japon pendant cette période, et pourquoi l’utilisation du sugammadex est plus fréquente que dans d’autres pays.
Dans cette étude, nous avons étudié rétrospectivement l’incidence de l’anaphylaxie périopératoire au Japon sur une période de 5 ans. Pour garantir la qualité du diagnostic, seuls les cas ayant des antécédents cliniques suggérant une anaphylaxie, ainsi que des résultats positifs issus de tests in vitro ou in vivo , ont été évalués. 15 Nous avons comparé l’incidence de l’anaphylaxie causée par le sugammadex et la néostigmine directement, l’hypothèse nulle étant que l’incidence de l’anaphylaxie causée par le sugammadex est plus élevée que celle de la néostigmine. Nous avons également étudié les changements dans l’utilisation du sugammadex et de la néostigmine au fil du temps en obtenant des données sur les ventes de ces médicaments sur une période de 8 ans, et nous avons mené une enquête en ligne auprès des anesthésistes du Japon pour déterminer les raisons de la popularité du sugammadex.
La dexaméthasone produit une inhibition dose-dépendante de l’inversion du sugammadex dans des cellules musculaires humaines primaires innervées in vitro
Rezonja, Katja MD, PhD * ; Sostaric, Maja MD, PhD * ; Vidmar, Gaj PhD † ; Mars, Tomaz MD, Ph. D. ‡
Anesthésie & Analgésie : Avril 2014 - Volume 118 - Numéro 4 - p 755-763
doi : 10.1213/ANE.0000000000000108
Abstrait
- Contexte : Les corticostéroïdes sont fréquemment utilisés pendant l’anesthésie pour fournir un traitement de substitution chez les patients souffrant d’insuffisance surrénalienne, comme traitement de première intention de plusieurs affections potentiellement mortelles, pour prévenir les nausées et les vomissements postopératoires et comme composant de l’analgésie multimodale. Pour ces 2 dernières indications, la dexaméthasone est la plus fréquemment utilisée. En raison de la ressemblance structurelle entre les relaxants musculaires aminostéroïdes et la dexaméthasone, des inquiétudes ont été soulevées quant à une éventuelle inhibition des corticostéroïdes dans l’inversion du bloc neuromusculaire par le sugammadex. Nous avons donc étudié l’influence de la dexaméthasone sur l’inversion par le sugammadex du bloc neuromusculaire induit par le rocuronium, ce qui pourrait être pertinent dans certaines situations cliniques.
- Méthodes : Le modèle unique de co-culture de cellules musculaires humaines innervées in vitro avec des explants de moelle épinière embryonnaire de rat pour former des jonctions neuromusculaires fonctionnelles a d’abord été utilisé pour explorer les effets du rocuronium 4 et 10 μM sur les contractions musculaires, évalués quantitativement en comptant les unités de contraction dans des co-cultures d’explants à contraction positive. Ensuite, du sugammadex équimolaire et 3 fois équimolaire a été utilisé pour étudier la récupération des contractions à partir d’un bloc de rocuronium de 4 et 10 μM. Enfin, 1, 100 et 10 μM de dexaméthasone (niveaux cliniques normaux, élevés et élevés) ont été utilisés pour évaluer tout effet sur l’inversion du bloc neuromusculaire induit par le rocuronium par le sugammadex.
- Résultats : Soixante-dix-huit co-cultures d’explants de 3 expériences indépendantes du temps ont été incluses, où le nombre de contractions a augmenté à 10 jours de co-culture. Le rocuronium a montré un effet dépendant du temps sur la profondeur du bloc neuromusculaire (rocuronium 4 μM : administration initiale, 10, 20 minutes ; P < 0,0001), tandis que l’effet dépendant de la dose était proche de la signification statistique nominale (4, 10 μM ; P = 0,080). Cela a été inversé par des concentrations équimolaires de sugammadex, avec une récupération supplémentaire et pratiquement complète des contractions avec du sugammadex équimolaire triple (P < 0,0001). La dexaméthasone a diminué la récupération induite par le sugammadex 10 μM des contractions du bloc neuromusculaire induit par le rocuronium de manière dose-dépendante (P = 0. 026) avec une concentration de sugammadex plus élevée (30 μM) étant proche d’une amélioration statistiquement significative de la récupération (P = 0,065). La concentration la plus élevée de dexaméthasone a diminué de 26 % la récupération des contractions par le sugammadex équimolaire ; cet effet était plus prononcé lorsque le sugammadex 3 fois équimolaire (30 μM) était utilisé pour l’inversion (48 %).
- Conclusions : Il s’agit du premier rapport dans lequel les effets des interactions du rocuronium et du sugammadex avec la dexaméthasone ont été étudiés dans un modèle expérimental in vitro hautement accessible de cellules musculaires humaines fonctionnellement innervées. Le sugammadex inverse le bloc neuromusculaire induit par le rocuronium ; cependant, l’ajout concomitant de concentrations élevées de dexaméthasone diminue l’efficacité du sugammadex. D’autres études sont nécessaires pour déterminer la pertinence clinique de ces interactions.
Le sugammadex supprime-t-il l’inflammation allergique due au rocuronium chez le modèle animal du rat ?
Serdar Yeşiltaş
Faculté de médecine de l’Université Bezmialem Vakıf Département d’anesthésiologie et de réanimation, Istanbul, Turquie.
Zeynep Nour Orhon
Faculté de médecine de l’Université Medeniyet Département d’anesthésiologie et de réanimation, Istanbul, Turquie.
Hasan Cakir
Hôpital Ozel Yasam, Département d’anesthésiologie et de réanimation, Batman, Turquie.
Mahmut Dogru
Hôpital Memorial Sisli, Département d’allergie pédiatrique-immunologie, Istanbul, Turquie.
Melek Güra Çelik
Faculté de médecine de l’Université Medeniyet Département d’anesthésiologie et de réanimation, Istanbul, Turquie.
Abstrait
- Introduction et objectifs : Il existe quelques rapports dans la littérature sur l’utilisation réussie du sugammadex dans le traitement des réactions d’hypersensibilité causées par le rocuronium ; cependant, le mécanisme physiopathologique est encore inconnu. Cette étude vise à étudier les changements causés par le rocuronium dans les poumons et l’effet du sugammadex sur ces changements avec des paramètres biochimiques, microscopiques optiques et immunohistochimiques sur un modèle de rat.
- Matériels et méthodes : Pour l’étude, 28 rats mâles Sprague-Dawley ont été divisés au hasard, sept de chaque, en quatre groupes. Le groupe C (témoin) a reçu seulement 0,9 % de NaCl sans aucun médicament. Le groupe R a reçu du rocuronium seul 1mg/kg. Le groupe S a reçu du sugammadex seul 96 mg/kg. Le groupe RS a reçu du rocuronium 1 mg/kg et du sugammadex 96 mg/kg. Après 24 h plus tard, les animaux ont été sacrifiés et leurs tissus ont été prélevés. Les résultats biochimiques (IgE/CRP), microscopiques optiques et immunohistochimiques ont été enregistrés.
- Résultats : les taux d’immunoglobuline E et de CRP, l’infiltration lymphocytaire septale péribronchique et alvéolaire, l’épaississement des membranes alvéolaires et les sites de saignement dans le groupe R étaient significativement plus élevés que dans tous les autres groupes. Dans le groupe RS, alors que ces paramètres étaient significativement inférieurs à ceux du groupe R et du groupe S, ils étaient significativement supérieurs à ceux du groupe C. Le nombre total de mastocytes et de mastocytes tryptase-positifs était significativement plus élevé dans le groupe R que dans tous les autres groupes. . Dans le groupe RS, ces paramètres étaient statistiquement inférieurs à ceux du groupe R et du groupe S, mais supérieurs à ceux du groupe C.
- Conclusions : Cette étude montre que les changements inflammatoires allergiques dus au rocuronium dans les poumons des rats sont réduits avec le sugammadex. Ces résultats appuient les cas d’anaphylaxie due au rocuronium qui se sont améliorés avec le sugammadex.
Références
1. Michavila Gomez AV, Belver Gonzalez MT, Alvarez NC, Giner Muñoz MT, Hernando Sastre V, Porto Arceo JA, Induráin BV. Groupe de travail sur les allergies médicamenteuses de la Société Espagnole d’Allergie Pédiatrique, Immunologie (SEICAP) Réactions anaphylactiques périopératoires : révision et protocole de procédure en pédiatrie. Allergol Immunopathol (Madr). 2015 ;43(2):203-14. 10.1016/j.aller.2013.07.012.
2. Kemp HI, CookTM, Thomas M, Harper NJN. Points de vue et expériences des anesthésistes britanniques sur l’anaphylaxie périopératoire grave : enquête de référence NAP6. Frère J Anaesth. 2017 ;119(1):132-9. 10.1093/bja/aex124
3. Savic LC, Kaura V, Yusaf M, Hammond-Jones AM, Jackson R, Howell S, et al. Audit anesthésique et matrice de recherche du Yorkshire. Incidence de l’anaphylaxie périopératoire suspectée : une étude instantanée multicentrique. J Allergy Clin Immunol Pract. 2015 ;3(3):454-5. 10.1016/j.jaip.2014.12.016
4. Dong SW, Mertes PM, Petitpain N, Hasdenteufel F, Malinovsky JM. GÉRAP. Réactions d’hypersensibilité pendant l’anesthésie. Résultats de la neuvième enquête française (2005-2007). Minerva Anestesiol. 2012 ;78(8):868-78.
5. Florvaag E, Johansson SG, Oman H, Venemalm L, Degerbeck F, Dybendal T, et al. Prévalence des anticorps IgE contre la morphine. Relation avec les incidences élevées et faibles d’anaphylaxie NMBA en Norvège et en Suède, respectivement. Acta Anesthésiol Scand. 2005 ;49(4):437-44. 10.1111/j.1399-6576.2004.00591.x
6. Mirakhur RK. Aspects de sécurité des agents bloquants neuromusculaires non dépolarisants avec une référence particulière au bromure de rocuronium. Eur J Anesthésiol Suppl. 1994 ;9:133-40.
7. Bevan DR. Agents bloquants neuromusculaires plus récents. Pharmaco Toxicol. 1994 ;74(1):3-9. 10.1111/j.1600-0773.1994.tb01065.x
8. Sadleir PH, Clarke RC, Bunning DL, Platt PR. Anaphylaxie aux médicaments bloquants neuromusculaires : incidence et réactivité croisée en Australie occidentale de 2002 à 2011. Br J Anaesth. 2013 ;110(6):981-7. 10.1093/bja/aes506
9. Schaller SJ, Fink H. Sugammadex en tant qu’agent d’inversion du bloc neuromusculaire : une revue fondée sur des preuves. Noyau Evid. 2013 ;8:57-67. 10.2147/CE.S35675
10. Czarnetzki C, Tassonyi E, Lysakowski C, Elia N, Tramèr MR. Efficacité du sugammadex pour l’inversion du bloc neuromusculaire modéré et profond induit par le rocuronium chez les patients prétraités avec du magnésium intraveineux : un essai contrôlé randomisé. Anesthésiologie. 2014 ;121(1):59-67. 10.1097/ALN.0000000000000204
11. McDonnell NJ, Pavy TJ, Green LK, Platt PR. Sugammadex dans la prise en charge de l’anaphylaxie induite par le rocuronium. Frère J Anaesth. 2011 ;106(2):199-201. 10.1093/bja/aeq366
12. De La Cruz I, Errando C, Calaforra S. Traitement de l’anaphylaxie au rocuronium avec sugammadex : rapport de cas avec bronchospasme comme seul symptôme. Turk J Anaesthesiol Reanim. 2019 ;47(1):69-72. 10.5152/TJAR.2019.21298
13. Kawano T, Tamura T, Hamaguchi M, Yatabe T, Yamashita K, Yokoyama M. Gestion réussie des réactions anaphylactiques induites par le rocuronium avec le sugammadex : rapport de cas. J Clin Anesth. 2012 ;24(1):62-4. 10.1016/j.jclinane.2011.04.015
14. Takazawa T, Tomita Y, Yoshida N, Tomioka A, Horiuchi T, Nagata C, Orihara M, et al. Trois cas suspects de choc anaphylactique induit par le sugammadex. BMC Anesthésiol. 2014 ;14:92. 10.1186/1471-2253-14-92
15. Min KC, Woo T, Assaid C, McCrea J, Gurner DM, Sisk CM, et al. Incidence de l’hypersensibilité et de l’anaphylaxie avec le sugammadex. J Clin Anesth. 2018 ;47:67-73.10.1016/j.jclinane.2018.03.018
16. Ho G, Clarke RC, Sadleir PH, Platt PR. Le premier rapport de cas d’anaphylaxie causée par le complexe d’inclusion de rocuronium et de sugammadex. AA Case Rep. 20161 ;7(9):190-2. 10.1213/XAA.0000000000000382
17. Ebo DG, Baldo BA, Van Gasse AL, Mertens C, Elst J, Sermeus L, et al. Anaphylaxie au complexe d’inclusion sugammadex-rocuronium : une réaction médiée par les IgE due à des changements allergéniques au niveau du rebord primaire du sugammadex. J Allergy Clin Immunol Pract. 2020 ;8(4):1410-5. 10.1016/j.jaip.2019.11.018.
18. Tomak Y, Yılmaz A, Bostan H, Tümkaya L, Altuner D, Kalkan Y, et al. Effets du nombre et de la dégranulation des mastocytes du sugammadex et du rocuronium dans le foie du rat. Anesthésie. 2012 ;67(10):1101-4. 10.1111/j.1365-2044.2012.07264.x
19. Kalkan Y, Tumkaya L, Bostan H, Tomak Y, Altuner D, Yilmaz A, et al. Effet du sugammadex sur les changements induits par le rocuronium dans les mastocytes pancréatiques. Toxicol Ind Santé. 2015 ;31(8):738-46. 10.1177/0748233713484654
20. Elieh Ali Komi D, Wöhrl S, Bielory L. Biologie des mastocytes au niveau moléculaire : une revue complète. Clin Rev Allergie Immunol. 2020 ;58(3):342-65. 10.1007/s12016-019-08769-2.
21. McNeil HP, Gotis-Graham I. Sous-ensembles de mastocytes humains - fonctions distinctes dans l’inflammation ? Inflamm Res. 2000 ;49(1):3-7. 10.1007/PL00012386
22. Schwartz LB. Les mastocytes et leur rôle dans l’urticaire. J Am Acad Dermatol. 1991 ;25:190-203 ; 203-4. 10.1016/S0190-9622(08)80468-9
23. Baronos S, Selvaraj BJ, Liang M, Ahmed K, Yarmush J. Bronchospasme induit par le sugammadex pendant l’anesthésie au desflurane. Frère J Anaesth. 2019 ;123(1):e155-6. 10.1016/j.bja.2019.04.001
24. Clarke RC, Sadleir PH, Platt PR. Le rôle du sugammadex dans le développement et la modification d’une réponse allergique au rocuronium : preuves à partir d’un modèle cutané. Anesthésie. 2012 ;67(3):266-73. 10.1111/j.1365-2044.2011.06995.x
25. Leysen J, Bridts CH, De Clerck LS, Ebo DG. L’anaphylaxie induite par le rocuronium n’est probablement pas atténuée par le sugammadex : preuve d’une expérience in vitro. Anesthésie. 2011 ;66(6):526-7. 10.1111/j.1365-2044.2011.06729.x
26. Hakozaki T, Murakawa M. Anaphylaxie induite par le rocuronium non améliorée par le sugammadex à faible dose : à propos d’un cas. Soins intensifs d’Anaesth. 2016 ;44(4):522. 10.1177/0310057X1604400411
27. Barthel F, Stojeba N, Lyons G, Biermann C, Diemunsch P. Sugammadex in rocuroniumanaphylaxis : dosematters. Frère J Anaesth. 2012 ;109(4):646-7. 10.1093/bja/aes332
28. Platt PR, Clarke RC, Johnson GH, Sadleir PH. Efficacité du sugammadex dans l’anaphylaxie induite par le rocuronium ou induite par les antibiotiques. Une étude cas-témoins. Anesthésie. 2015 ;70(11):1264-7. 10.1111/anae.13178
29. Baldo BA. Anaphylaxie causée par le complexe d’inclusion sugammadex-rocuronium : quelle est la base de la reconnaissance allergénique ? J Clin Anesth. 2019 ;54:48-9. 10.1016/j.jclinane.2018.10.017
Effect of Remifentanil vs Neuromuscular Blockers During Rapid Sequence Intubation on Successful Intubation Without Major Complications Among Patients at Risk of Aspiration : A Randomized Clinical Trial
Randomized Controlled Trial
JAMA. 2023 Jan 3 ; 329(1):28-38.
doi : 10.1001/jama.2022.23550.
Nicolas Grillot 1 , Gilles Lebuffe 2 , Olivier Huet 3 , Sigismond Lasocki 4 , Xavier Pichon 5 , Mathieu Oudot 6 , Nathalie Bruneau 7 , Jean-Stéphane David 8 , Pierre Bouzat 9 , Alexandra Jobert 10 11 , Martine Tching-Sin 12 , Fanny Feuillet 11 12 13 , Raphael Cinotti 1 , Karim Asehnoune 1 , Antoine Roquilly 1 ; Atlanrea Study GroupSociété Française d’Anesthésie Réanimation (SFAR) Research Network
Collaborators, Affiliations
PMID : 36594947 DOI : 10.1001/jama.2022.23550
Abstract
- Importance : It is uncertain whether a rapid-onset opioid is noninferior to a rapid-onset neuromuscular blocker during rapid sequence intubation when used in conjunction with a hypnotic agent.
- Objective : To determine whether remifentanil is noninferior to rapid-onset neuromuscular blockers for rapid sequence intubation.
- Design, setting, and participants : Multicenter, randomized, open-label, noninferiority trial among 1150 adults at risk of aspiration (fasting for <6 hours, bowel occlusion, recent trauma, or severe gastroesophageal reflux) who underwent tracheal intubation in the operating room at 15 hospitals in France from October 2019 to April 2021. Follow-up was completed on May 15, 2021.
- Interventions : Patients were randomized to receive neuromuscular blockers (1 mg/kg of succinylcholine or rocuronium ; n = 575) or remifentanil (3 to 4 μg/kg ; n = 575) immediately after injection of a hypnotic.
- Main outcomes and measures : The primary outcome was assessed in all randomized patients (as-randomized population) and in all eligible patients who received assigned treatment (per-protocol population). The primary outcome was successful tracheal intubation on the first attempt without major complications, defined as lung aspiration of digestive content, oxygen desaturation, major hemodynamic instability, sustained arrhythmia, cardiac arrest, and severe anaphylactic reaction. The prespecified noninferiority margin was 7.0%.
- Results : Among 1150 randomized patients (mean age, 50.7 [SD, 17.4] years ; 573 [50%] women), 1130 (98.3%) completed the trial. In the as-randomized population, tracheal intubation on the first attempt without major complications occurred in 374 of 575 patients (66.1%) in the remifentanil group and 408 of 575 (71.6%) in the neuromuscular blocker group (between-group difference adjusted for randomization strata and center, -6.1% ; 95% CI, -11.6% to -0.5% ; P = .37 for noninferiority), demonstrating inferiority. In the per-protocol population, 374 of 565 patients (66.2%) in the remifentanil group and 403 of 565 (71.3%) in the neuromuscular blocker group had successful intubation without major complications (adjusted difference, -5.7% ; 2-sided 95% CI, -11.3% to -0.1% ; P = .32 for noninferiority). An adverse event of hemodynamic instability was recorded in 19 of 575 patients (3.3%) with remifentanil and 3 of 575 (0.5%) with neuromuscular blockers (adjusted difference, 2.8% ; 95% CI, 1.2%-4.4%).
- Conclusions and relevance : Among adults at risk of aspiration during rapid sequence intubation in the operating room, remifentanil, compared with neuromuscular blockers, did not meet the criterion for noninferiority with regard to successful intubation on first attempt without major complications. Although remifentanil was statistically inferior to neuromuscular blockers, the wide confidence interval around the effect estimate remains compatible with noninferiority and limits conclusions about the clinical relevance of the difference.
Trial registration : ClinicalTrials.gov Identifier : NCT03960801.
§§§
Le même article traduit
Effet du rémifentanil par rapport aux bloqueurs neuromusculaires pendant l’intubation à séquence rapide sur une intubation réussie sans complications majeures chez les patients à risque d’aspiration
Un essai clinique randomisé
Nicolas Grillot, MD1 ; Gilles Lebuffe, MD, PhD2 ; Olivier Huet, MD, PhD3 ; et alSigismond Lasocki, M.D., Ph.D.4 ; Xavier Pichon, M.D.5 ; Mathieu Oudot, M.D.6 ; Nathalie Bruneau, M.D.7 ; Jean-Stéphane David, MD, PhD8 ; Pierre Bouzat, M.D., Ph.D.9 ; Alexandra Jobert, MSc10,11 ; Martine Tching-Sin, PharmD12 ; Fanny Feuillet, PhD11,12,13 ; Raphaël Cinotti, MD, PhD1 ; Karim Asehnoune, MD, PhD1 ; Antoine Roquilly, MD, PhD1 ; pour le groupe d’étude AtlanreaRéseau de recherche de la Société Française d’Anesthésie Réanimation (SFAR)
Affiliations d’auteurs
JAMA. 2023 ;329(1):28-38. doi:10.1001/jama.2022.23550
Rémifentanil vs bloqueurs neuromusculaires et intubation sans complications majeures chez les patients à risque d’aspiration
- Question
Les opioïdes d’action rapide sont-ils non inférieurs aux bloqueurs neuromusculaires d’action rapide pour l’intubation en séquence rapide au bloc opératoire chez l’adulte à risque d’aspiration ?
- Résultats
Dans cet essai clinique randomisé de non-infériorité qui a inclus 1150 participants, le taux d’intubation trachéale à la première tentative sans complications majeures était de 66,1 % dans le groupe rémifentanil et de 71,6 % dans le groupe bloqueur neuromusculaire, une différence qui n’a pas atteint la marge de non-infériorité prédéfinie de −7 % et correspondait à une infériorité statistique du rémifentanil.
- Signification
Chez les adultes à risque d’aspiration lors d’une intubation en séquence rapide au bloc opératoire, le rémifentanil ne remplissait pas le critère de non-infériorité et était statistiquement inférieur aux bloqueurs neuromusculaires sur le taux de réussite d’une intubation trachéale sans complications majeures, bien que l’intervalle de confiance large limite conclusions sur la différence.
- Résumé
Importance Il n’est pas certain qu’un opioïde à action rapide soit non inférieur à un bloqueur neuromusculaire à action rapide pendant l’intubation à séquence rapide lorsqu’il est utilisé en conjonction avec un agent hypnotique.
- Objectif
Déterminer si le rémifentanil est non inférieur aux bloqueurs neuromusculaires à action rapide pour l’intubation à séquence rapide.
- Conception, cadre et participants
Essai multicentrique, randomisé, ouvert, de non-infériorité auprès de 1150 adultes à risque d’aspiration (jeûne < 6 heures, occlusion intestinale, traumatisme récent ou reflux gastro-œsophagien sévère) ayant subi une intubation trachéale en salle d’opération à 15 hôpitaux en France d’octobre 2019 à avril 2021. Le suivi s’est terminé le 15 mai 2021.
- Interventions
Les patients ont été randomisés pour recevoir des bloqueurs neuromusculaires (1 mg/kg de succinylcholine ou de rocuronium ; n = 575) ou du rémifentanil (3 à 4 μg/kg ; n = 575) immédiatement après l’injection d’un hypnotique.
- Principaux critères de jugement et mesures
Le critère de jugement principal a été évalué chez tous les patients randomisés (population randomisée) et chez tous les patients éligibles ayant reçu le traitement assigné (population per protocole). Le résultat principal était une intubation trachéale réussie à la première tentative sans complications majeures, définie comme une aspiration pulmonaire du contenu digestif, une désaturation en oxygène, une instabilité hémodynamique majeure, une arythmie soutenue, un arrêt cardiaque et une réaction anaphylactique sévère. La marge de non-infériorité prédéfinie était de 7,0 %.
- Résultats
Parmi 1150 patients randomisés (âge moyen, 50,7 [ET, 17,4] ans ; 573 [50 %] femmes), 1130 (98,3 %) ont terminé l’essai. Dans la population randomisée, une intubation trachéale à la première tentative sans complications majeures est survenue chez 374 des 575 patients (66,1%) du groupe rémifentanil et 408 des 575 (71,6%) du groupe bloqueur neuromusculaire (différence intergroupe ajustée pour strates de randomisation et centre, -6,1 % ; IC à 95 %, -11,6 % à -0,5 % ; P = 0,37 pour la non-infériorité), démontrant l’infériorité. Dans la population per protocole, 374 des 565 patients (66,2%) du groupe rémifentanil et 403 des 565 (71,3%) du groupe bloqueur neuromusculaire ont eu une intubation réussie sans complications majeures (différence ajustée, -5,7% ; 95 % IC, -11,3 % à -0,1 % ; P = 0,32 pour la non-infériorité). Un événement indésirable d’instabilité hémodynamique a été enregistré chez 19 des 575 patients (3,3 %) avec le rémifentanil et 3 sur 575 (0,5 %) avec les bloqueurs neuromusculaires (différence ajustée, 2,8 % ; IC à 95 %, 1,2 %-4,4 %).
- Conclusions et pertinence
Chez l’adulte à risque d’aspiration lors d’une intubation en séquence rapide au bloc opératoire, le rémifentanil, comparé aux bloqueurs neuromusculaires, n’a pas rempli le critère de non-infériorité de réussite d’une intubation au premier essai sans complications majeures. Bien que le rémifentanil ait été statistiquement inférieur aux bloqueurs neuromusculaires, le large intervalle de confiance autour de l’estimation de l’effet reste compatible avec la non-infériorité et limite les conclusions sur la pertinence clinique de la différence.
Enregistrement de l’essai Identifiant ClinicalTrials.gov : NCT03960801
L’étude ALPHO siffle la fin de partie pour la pholcodine
Publié le 19/05/2023
Parmi les actualités en allergologie, le Dr Bianca Chiriac a choisi de mettre à l’honneur la publication de l’étude ALPHO. Cette étude avait été demandée par l’Agence Européenne du Médicament (EMA) en 2011. En effet, des informations remontaient depuis 2000 de plusieurs études, suggérant que la pholcodine pouvait être un sensibilisant vis-à-vis d’un ammonium quaternaire ou de sa variante tertiaire, épitope principal des curares c’est-à-dire la partie vers laquelle se dirige la réponse allergique.
L’étude a été mise en place en 2014 et pilotée par une équipe de Strasbourg, et le GERAP (groupe d’étude des réactions anaphylactoïdes peranesthésiques) qui recense depuis plus de 40 ans les réactions peropératoires en France.
Au total, 167 personnes allergiques aux curares
Il s’agit d’une étude cas-témoin, menée entre 2014 et 2020 dans 24 centres. Au total, 167 personnes allergiques aux curares ont été incluses. Toutes avaient présenté une réaction anaphylactique, et un collapsus cardio-vasculaire était signalé dans 80 % des cas. Ces patients ont été appariés à 334 sujets. Les données concernant la prise de pholcodine dans les 12 mois précédant l’anesthésie générale ont été récupérées, par auto-questionnaires et en interrogeant les pharmaciens. Le délai médian entre la réaction et les tests était de 9 semaines.
Le résultat majeur de cette étude est que l’exposition à la pholcodine dans les 12 mois précédant une anesthésie générale impliquant un curare augmente le risque d’anaphylaxie IgE dépendante aux curares (Odds ratio OR = 4,5 ; IC 95 % 2,8 à 7,3 ; p < 0,01). Ce résultat n’est pas modifié par l’analyse multivariée (OR = 4,2 ; IC 95 % 2,5 à 7,0 ; p < 0,01), signifiant que l’exposition à la pholcodine est un facteur indépendant de la réaction allergique.
D’autres facteurs de risque sont mis en évidence par cette étude. Il s’agit de l’exposition professionnelle aux ammoniums quaternaires, déjà démontrée auparavant (OR = 6,0 ; IC 95 % 2,9 à 12,8 ; p < 0,01) et, dans une moindre mesure, des antécédents de pathologie hépato-gastro-intestinale (1,5 ; 1,0 à 2,3 ; p < 0,01).
A la suite de cette étude, l’Agence Nationale de Sécurité du Médicament (ANSM) a suspendu en septembre 2022 l’autorisation de mise sur le marché (AMM) des sirops contenant de la pholcodine, avec une lettre et une fiche pratique adressées aux professionnels de santé. Cela a été actualisé en avril 2023, avec le retrait complet de l’AMM. L’agence européenne du médicament a suivi la même voie. Notons que la vigilance reste nécessaire, car certains patients peuvent garder encore chez eux des antitussifs contenant de la pholcodine.
Dr Roseline Péluchon
RÉFÉRENCE
A. Chiriac Actualités en Allergologie. Quoi de neuf ? 18ème Congrès Francophone d’Allergologie (Paris. Du 25 au 28 avril 2023).
jim.fr
Prise en charge périopératoire du bloc neuromusculaire : lignes directrices de la Société européenne d’anesthésiologie et de soins intensifs
Eur J Anesthésiol
.1er février 2023 ;40(2):82-94. est ce que je : 10.1097/EJA.0000000000001769. Publication en ligne le 15 novembre 2022.
Thomas Fuchs Buder 1, Caroline S Romero , Heidrun Lewald , Massimo Lamperti , Arash Afshari , Ana-Marjia Hristovska , Denis Schmartz , Jochen Hinkelbein , Dan Longrois , Maria Popp , Hans D. de Boer , Massimiliano Sorbello , Radmilo Janković , Peter Kranke
Affiliations développer
PMID : 36377554 DOI : 10.1097/EJA.0000000000001769
Source pub med https://pubmed.ncbi.nlm.nih.gov/36377554/
Abstrait
Des données récentes ont indiqué une incidence élevée de prise en charge inappropriée du bloc neuromusculaire, avec un taux élevé de paralysie résiduelle et de complications postopératoires associées aux relaxants. Ces données sont alarmantes dans la mesure où la surveillance neuromusculaire disponible, ainsi que les myorelaxants et leurs antagonistes, permettent fondamentalement une gestion bien tolérée du bloc neuromusculaire. Dans cette première ligne directrice de la Société européenne d’anesthésiologie et de soins intensifs (ESAIC) sur la prise en charge périopératoire du bloc neuromusculaire, nous visons à présenter des recommandations agrégées et fondées sur des preuves pour aider les cliniciens à fournir les meilleurs soins médicaux et à garantir la sécurité des patients. Nous avons identifié trois questions cliniques principales : Les myorelaxants sont-ils nécessaires pour faciliter l’intubation trachéale chez l’adulte ? L’intensité du bloc neuromusculaire influence-t-elle le résultat d’un patient en chirurgie abdominale ? Quelles sont les stratégies de diagnostic et de traitement de la paralysie résiduelle ?
Sur cette base, des questions PICO (patient, intervention, comparateur, résultat) ont été dérivées et ont guidé une recherche documentaire structurée. Une approche par étapes a été utilisée pour réduire le nombre d’essais de la recherche initiale (n = 24 000) aux études cliniques finalement pertinentes (n = 88). La méthodologie GRADE (Grading of Recommendations, Assessment, Development and Evaluation) a été utilisée pour formuler les recommandations sur la base des résultats des études incluses en conjonction avec leur qualité méthodologique.
Un processus Delphi en deux étapes a été utilisé pour déterminer l’accord des membres du panel avec les recommandations :
- R1 Nous recommandons l’utilisation d’un relaxant musculaire pour faciliter l’intubation trachéale (1A).
- R2 Nous recommandons l’utilisation de relaxants musculaires pour réduire les lésions pharyngées et/ou laryngées suite à une intubation endotrachéale (1C).
- R3 Nous recommandons l’utilisation d’un relaxant musculaire à action rapide pour l’intubation par induction à séquence rapide (RSII) tel que la succinylcholine 1 mg kg -1 ou le rocuronium 0,9 à 1,2 mg kg -1 (1B). R4 Nous recommandons d’approfondir le bloc neuromusculaire si les conditions chirurgicales doivent être améliorées (1B).
- R5 Il n’existe pas suffisamment de preuves pour recommander un bloc neuromusculaire profond en général afin de réduire la douleur postopératoire ou de diminuer l’incidence des complications périopératoires. (2C).
- R6 Nous recommandons l’utilisation d’une stimulation du nerf cubital et d’une surveillance neuromusculaire quantitative au niveau du muscle adducteur du pouce pour exclure une paralysie résiduelle (1B).
- R7 Nous recommandons d’utiliser le sugammadex pour contrarier le blocage neuromusculaire profond, modéré et superficiel induit par les agents aminostéroïdiens (rocuronium, vécuronium) (1A).
- R8 Nous recommandons une récupération spontanée avancée (c’est-à-dire rapport TOF > 0,2) avant de commencer l’inversion basée sur la néostigmine et de poursuivre la surveillance quantitative du bloc neuromusculaire jusqu’à ce qu’un rapport TOF supérieur à 0,9 soit atteint. (1C). rapport TOF > 0,2) avant de commencer l’inversion basée sur la néostigmine et de poursuivre la surveillance quantitative du bloc neuromusculaire jusqu’à ce qu’un rapport TOF supérieur à 0,9 soit atteint. (1C). rapport TOF > 0,2) avant de commencer l’inversion basée sur la néostigmine et de poursuivre la surveillance quantitative du bloc neuromusculaire jusqu’à ce qu’un rapport TOF supérieur à 0,9 soit atteint. (1C).
Copyright © 2022 Société européenne d’anesthésiologie et de soins intensifs.
— -
ça c’est uniquement par fierté : un échange entre une américaine et une anglaise qui renvoie sur le site sofia pour un article sur les curares.
§§§
Arnaud BASSEZ
Infirmier anesthésiste-formateur AFGSU/NRBC
Administrateur