Les nouvelles RFE corrigées 2024, sont disponibles dans les documents PDF
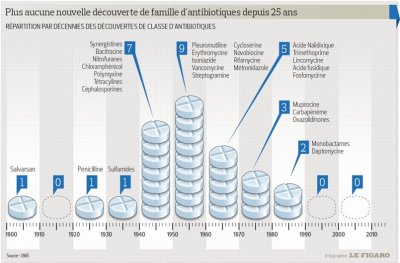
Utilisés "larga manu", les antibiotiques montrent leurs limites. Les recommandations tendent à harmoniser les prescriptions. Ainsi, il n’est plus rare de ne pas administrer d’antibiothérapie sur des actes de chirurgie sans facteurs de risques.
– Pharmacodynamie
Par pharmacodynamie, on entend l’effet de la substance sur l’organisme. Une inter action de ce type peut se produire en cas d’association de deux substances avec les mêmes propriétés ou effets indésirables. Ceci peut être un effet recherché, par exemple en associant deux antihypertenseurs, mais peut être délétère, telle par exemple l’association de la ciprofloxacine et du méthotrexate : le premier augmente les concentrations plasmatiques du second par inhibition compétitive de la sécrétion tubulaire rénale, augmentant ainsi le risque de réaction toxique sur méthotrexate.
– Pharmacocinétique
Par pharmacocinétique, on entend l’effet de l’organisme sur la substance administrée.
Une interaction peut survenir au niveau de l’absorption, de la distribution, de la métabolisation et de l’excrétion.
– Absorption
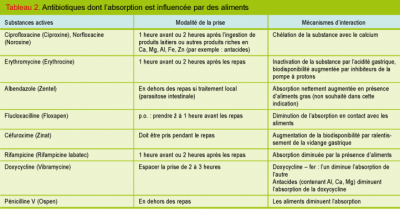
La prise alimentaire, des changements du pH ou de la motilité gastrique, une compétition au niveau des transporteurs dans la paroi gastrique ou intestinale, peuvent, entre autres, influencer la vitesse d’absorption et/ou la quantité absorbée. La présence de calcium dans l’estomac, par ingestion de produits laitiers par exemple, diminue considérablement l’absorption des quinolones comme la ciprofloxacine et la norfloxacine. Ces deux substances doivent être prises une heure avant ou deux heures après l’ingestion de produits riches en calcium.
– Distribution
La liaison aux protéines plasmatiques et la compétition entre deux substances fortement liées peuvent influencer l’exposition à un médicament. Les antibiotiques sont peu touchés par ce problème.
– Métabolisme
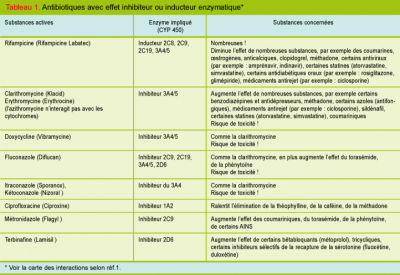
L’exemple le plus connu est probablement le système enzymatique des cytochromes p450, présents surtout dans le foie, mais aussi dans la paroi intestinale. Ces enzymes métabolisent d’innombrables substances que nous absorbons tous les jours, mais également une multitude de médicaments, en les rendant hydrosolubles pour permettre leur élimination par voie rénale principalement. Si plusieurs substances sont métabolisées par le même cytochrome, il peut y avoir compétition pour un même substrat. Certaines substances sont des inhibiteurs, d’autres des inducteurs enzymatiques, diminuant ou augmentant ainsi le métabolisme d’autres médicaments. Les antibiotiques qui influencent les cytochromes sont listés dans le tableau 1.
Pour grossir les images, cliquez dessus.
La rifampicine, inducteur enzymatique puissant, peut accélérer considérablement l’élimination de certaines substances, telles les coumariniques (Sintrom), les anticalciques, les inhibiteurs de la pompe à protons, entre autres. Une augmentation de la posologie, parfois considérable, peut être nécessaire, sans oublier de réadapter cette posologie à l’arrêt de la rifampicine pour éviter des effets toxiques.
Parfois, l’introduction d’un inhibiteur enzymatique puissant nécessite l’arrêt d’une autre substance : la clarithromycine (Klacid) peut, par exemple, augmenter la toxicité de certaines statines substrats du 3A4 par effet inhibiteur sur cet enzyme, (tableau 1). Il est recommandé dès lors de suspendre certaines statines (atorvastatine, simvastatine) durant le traitement de clarithromycine.
Le jus de grapefruit est un inhibiteur du 3A4. Il diminue la biodisponibilité de la clarithromycine et de l’itraconazole , probablement via un effet sur l’absorption.
Il existe d’autres enzymes impliqués dans le métabolisme médicamenteux, comme la glucuronyl-transférase. Ces enzymes sont moins sujets aux interactions avec les antibiotiques, à l’exception de la rifampicine (inducteur).
Une autre forme de métabolisation accrue est l’inactiva tion de l’érythromycine par l’acidité gastrique. Ce médicament doit être pris avec de l’eau (pour neutraliser le liquide gastrique) une heure avant ou deux heures après les repas.
– Elimination
L’élimination des substances se fait avant tout par voies rénale et fécale. Une altération de la fonction rénale peut évidemment ralentir l’élimination d’un médicament et induire une toxicité par accumulation. Certains antibiotiques (par exemple : aminoglycosides) ont un potentiel néphrotoxique et nécessitent des contrôles de la fonction rénale.
Dans le rein existent des systèmes de transporteurs qui excrètent certaines substances activement, comme par exemple la p-glycoprotéine qui excrète la digoxine. La clarithromycine inhibe cette protéine et peut donc provoquer une intoxication à la digoxine.
– Aliments et médicaments
L’acidité gastrique, la vidange gastrique, le contenu en graisse de la nourriture, l’utilisation de transporteurs en commun entre médicament et éléments nutritifs, des réactions chimiques entre éléments et médicaments, peuvent influencer la cinétique de certains médicaments et aussi des antibiotiques. Le tableau 2 résume les interactions les plus importantes.
– Alcool et antibiotiques
Si l’effet « antabuse » du métronidazole a été décrit dans les années 70 déjà, il persistait néanmoins un doute quant au mécanisme. Un travail expérimental récent apporte une nouvelle explication : le métronidazole n’influence pas, comme supposé auparavant, l’acétaldéhyde déshydrogénase mais augmente le taux de sérotonine dans le cerveau, effet déjà connu de l’alcool. Selon les auteurs, les symptômes désagréables déclenchés par l’association de métronidazole et d’alcool pourraient être l’expression d’un syndrome sérotoninergique. L’intolérance à l’alcool provoquée par le kétoconazole, non testée dans cette étude, passerait-elle par le même mécanisme ?
L’érythromycine augmente la vitesse d’absorption et la biodisponibilité de l’éthanol en accélérant la vidange gastrique. La dégradation de l’alcool dans l’estomac, par l’alcool déshydrogénase, est donc diminuée, avec un pic d’alcoolémie plus précoce et une exposition accrue.
Certaines céphalosporines administrées par voie parentérale (ceftriaxone = Rocéphine, céfamandole = Mandokef, céfazoline = Kefzol) peuvent provoquer un effet « antabuse » en raison de leur ressemblance structurelle avec le disulfirame (Antabus).
Un effet additif sur le système nerveux central est théoriquement possible, bien que l’évidence clinique demeure incertaine, entre l’éthanol et la ciprofloxacine, la norfloxacine, la méfloquine et la chloroquine.
Les auteurs de l’article de 1996 dans Médecine et Hygiène concluent que la fréquence des interactions entre éthanol et antibiotiques est probablement sous-estimée, mais laissent au prescripteur la décision de déconseiller la consommation d’alcool durant le traitement d’antibiotiques ou une attitude plus libre, mais en évitant les substances considérées à risque d’interactions.
– Anticoagulation orale et antibiotiques
Un nombre considérable de patients bénéficie d’une anti coagulation orale. Les substances utilisées en Suisse pour l’anticoagulation orale thérapeutique sont pour l’instant les coumariniques : l’acénocoumarol (Sintrom) et la phen procoumone (Marcoumar). Métabolisées via les cytochromes, ces deux substances sont à risque d’interactions multiples, notamment à cause de leur marge thérapeutique étroite.
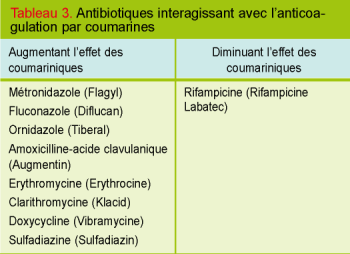
Le tableau 3 énumère les interactions les plus fréquentes avec les antibiotiques oraux.
La plupart se font par une inhibition enzymatique (d’où augmentation de l’effet anticoagulant) ou, plus rarement, par une induction enzymatique (avec diminution, voire perte de l’effet anticoagulant). L’amoxicilline/acide clavulanique (Augmentin) peut augmenter l’effet anticoagulant, probablement par une diminution de l’absorption de la vitamine K. La clarithromycine (et l’érythromycine) augmente l’INR par un mécanisme pas encore clair : la voie des cytochromes est probable, mais il y a également des exemples de potentialisation de la warfarine (coumarine non commercialisée en Suisse) par l’azithromycine (un autre macrolide) qui n’inhibe pas les cytochromes.
Une prédiction précise de l’effet d’une substance sur l’anticoagulation par les coumarines n’est malheureusement souvent pas possible. De ce fait, un contrôle étroit de l’INR lors de l’introduction ou de l’arrêt d’un traitement est nécessaire, tout en s’efforçant d’anticiper la posologie de la coumarine.
– Antibiotiques et contraception orale
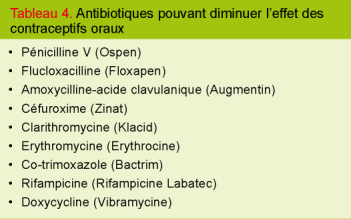
C’est un sujet délicat ! Même si l’évidence scientifique n’est pas toujours solide, les fabricants conseillent souvent de considérer une contraception autre qu’hormonale en cours de traitement par antibiotiques. Il faut probablement y voir une certaine peur de devoir assumer la paternité... Des rapports de diminution de l’effet de la contraception orale sous antibiotiques existent néanmoins. Un mécanisme suspecté est la perturbation de la flore intestinale par les antibiotiques qui influencerait l’absorption hormonale ; une implication des cytochromes est également possible avec certains antibiotiques.
Selon le Compendium suisse des médicaments, le co-trimoxazole pourrait diminuer l’efficacité de la contraception orale. Une étude a pourtant montré qu’un traitement court de co-trimoxazole n’a probablement pas d’influence.
– Que penser ?
Dans une étude rétrospective Helms et coll. ont montré en 1997 qu’une antibiothérapie par tétracyclines, pénicillines et céphalosporines chez des femmes sous contraception orale, n’augmente pas le nombre de grossesses de ma nière significative par comparaison à des femmes sous contraception orale sans antibiothérapie. Une revue de la littérature de 2001 arrive aux mêmes conclusions (la rifampicine mise à part, qui diminue clairement l’effet des contraceptifs oraux), mais suggère néanmoins la prudence, car il existe des différences individuelles non prévisibles.
Le tableau 4 énumère, de manière prudente, les antibiotiques sensés diminuer l’efficacité d’une contraception orale.
La ciprofloxacine ne semble pas avoir d’influence sur la contraception orale.
La prescription de médicaments contre-indiqués pendant la grossesse (doxycycline, clarithromycine, érythro my cine, métronidazole, fluconazole) pose moins de problèmes puisqu’il faut, dans ces cas, s’assurer d’une contraception efficace, soit de mesures contraceptives additionnelles.
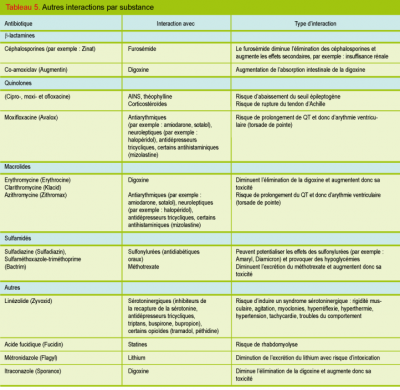
– Autres interactions significatives
Toutes les interactions théoriquement possibles ne sont pas forcément cliniquement significatives. Une substance avec une marge thérapeutique étroite comme la digoxine ou le lithium nécessite néanmoins une attention particulière. L’Augmentin et les macrolides, très fréquemment prescrits, augmentent la digoxinémie par des mécanismes différents et peuvent ainsi provoquer une toxicité digitalique. Le prescripteur doit demeurer attentif.
Les sulfamidés (par exemple : Bactrim) peuvent induire des hypoglycémies qui sont clairement aggravées sous anti diabétiques oraux. Le risque de rhabdomyolyse secondaire à la prise d’une statine est augmenté en l’associant avec un macrolide ou l’acide fucidique. Durant une telle antibiothérapie, la statine devrait être arrêtée temporairement. D’autres interactions sont listées dans le tableau 5.
– Conclusion
Prescrire un antibiotique n’est jamais un geste anodin. Outre l’indication, le bon choix de la substance, la posologie et la durée du traitement, il faut également se poser la question des éventuelles interactions médicamenteuses ou alimentaires, qui sont nombreuses. En respectant certaines règles et en utilisant intelligemment les outils à sa disposition, le praticien peut néanmoins éviter certains pièges et assurer une prise en charge adéquate.
Tous les noms de marque, indiqués entre parenthèses dans le texte et les tableaux, sont donnés à titre d’exemple et ne sont pas exclusifs.
source :revmed.ch
Cet article en pdf
— -

- Les recommandations
Cette page liste les conférences de consensus, conférences d’experts et recommandations sur l’utilisation des anti-infectieux issues de sociétés savantes et d’agences de l’état.
- Nosobase sur les BMR et BHRe Fermeture du site NosoBase à compter du 23/04/2019. Consulter désormais la base documentaire du RéPias. (Les CClin et Arlin deviennent les CPias, 17 centres régionaux d’appui pour la prévention des infections associées aux soins. Le site nosobase renvoie sur cpias.fr)
- Infectiologie.com . Cette page liste les conférences de consensus, conférences d’experts et recommandations sur l’utilisation des anti-infectieux issues de sociétés savantes et d’agences de l’État.
— -
BMR, BHRe, SARM, E-BLSE, PARC, ABRI, ERG
– Définitions
BMR : Bactérie Multi Résistante
Bactéries sensibles qu’à un petit nombre d’antibiotiques, par des mécanismes de résistance acquis.
– Principales bactéries concernées
- SARM : Staphylococcus Aureus Résistant à la Méticilline
- E-BLSE : Entérobactérie productrice de Béta Lactamase à Spectre Etendu
- PARC : Pseudomonas Aeruginosa Résistant à la Ceftazidime
- ABRI : Acinetobacter Baumanii Résistant à l’Imipenem (et à l’ensemble des β lactamines)
- ERG : Enterococcus faecalis Résistant aux Glycopeptides
BHRe : Bactérie Hautement Résistante émergente (« nouvelle BMR »)
Bactéries commensales du tube digestif et résistantes à de nombreux antibiotiques. Leurs mécanismes de résistance aux antibiotiques sont transférables entre bactéries, et peut conduire à des impasses thérapeutiques.
– Principales bactéries concernées
- EPC : Entérobactéries Productrices de Carbapénémases. En France, ce sont les espèces Klebsiella pneumoniae et Escherichia coli qui prédominent pour la plupart avec un seul mécanisme de résistance. Les génotypes type OXA 48 et OXA 48 like sont majoritaires mais d’autres peuvent circuler en France comme : NDM, KPC et VIM.
- ERG : Enterococcus faecium Résistant aux Glycopeptides soit génotype VAN A ou soit génotype VAN B.
– Conséquences pour le patient
Les BMR/BHRe peuvent être à l’origine d’infection, de colonisation ou de portage sain.
Dans cette dernière situation, elles peuvent persister plusieurs mois sous forme d’un portage sain digestif ou nasal, ne justifiant pas de traitement antibiotique.
[...]
source : cerballiance.fr
Dr Krystel DECRUCQ - Biologiste médical
Cerballiance Hauts-de-France

USA : une bactérie résistante à un antibiotique de dernier recours
Une bactérie ultrarésistante, responsable d’une infection urinaire chez une patiente américaine, s’est révélée insensible à l’action de la colistine, un antibiotique de dernier recours, d’après une étude publiée le 25 mai 2016 dans une revue médicale américaine. Cette découverte renforce l’inquiétude concernant l’antibiorésistance, véritable problème mondial de santé publique.
Une femme de 49 ans s’est présentée dans un hôpital américain avec une infection urinaire. L’analyse du prélèvement d’urine a révélé une souche bactérienne d’Escherichia coli (E. coli) résistante à un grand nombre d’antibiotiques, y compris à la colistine, antibiotique de dernier recours dans ce genre de cas, selon une étude publiée dans la revue médicale Antimicrobial Agents and Chemotherapy, jeudi 26 mai 2016. Les chercheurs n’ont pas identifié comment la pateinte avait pu être contaminée par cette souche.
E. Coli est une bactérie du tube digestif très commune, qui peut facilement contaminer le conduit urinaire à cause de la proximité entre l’anus et l’urètre et déclencher des infections. Ici la souche de la bactérie s’est révélée être mutante, c’est-à-dire qu’elle possèdait différents gènes de résistance lui permettant de déjouer un grand nombre des stratégies d’attaque de différentes classes d’antibiotiques. Parmi eux figurait, pour la première fois aux Etats-Unis, le gène de la résistance à la colistine (gène mcr-1), un des antibiotiques utilisés en dernier recours . La bactérie restait néanmoins sensible aux carbapénèmes, une autre famille d’antibiotiques utilisée en cas de multirésistance.
Le recours à la colistine inefficace
La colistine est un vieil antibiotique. Commercialisé en 1959, il avait été abandonné dans les années 1980 car jugé trop toxique pour les reins. Depuis peu, il est à nouveau utilisé, en dernier recours, pour combattre les infections à bactéries multi-résistantes. La raison de son efficacité : sa faible utilisation n’a pas permis un contact régulier avec les bactéries et donc le développement de résistance (voir encadré).
Cet antibiotique avait cependant continué à être utilisé pour le bétail et certaines bactéries ont tout de même pu développer des résistances. La gène mcr-1 avait déjé été repéré en Europe et en Chine, le scénario se répète à présent aux USA.
La détection de cet agent pathogène présentant le gène mcr-1 "est un signe avant coureur de l’émergence d’une bactérie résistante à tous les antibiotiques" alertent les auteurs de l’étude. En effet, les bactéries s’adaptent à leur environnement et peuvent acquérir facilement des gènes de résistance en s’échangeant des plasmides, petits morceaux d’ADN circulaire potentiellement porteurs des ces gènes (voir encadré).
Si l’une d’elles acquiert tous les gènes de résistance aux antibiotiques, y compris celui de la colistine, un scénario catastrophe dans lequel n’existerait plus aucune molécule pour traiter l’infection se profile. Avec un taux de mortalité pouvant aller jusqu’à 50 %, ce type de bactérie est considérée par les Centres de contrôle et de prévention des maladies comme l’une des plus grandes menaces de santé publique.
"Une personne mourra toutes les 3 secondes si l’on ne fait rien"
"En 2050, une personne mourra toutes les 3 secondes dans le monde à cause d’une infection à bactéries multirésistantes si l’on ne fait rien", prévient Jim O’Neill dans un récent rapport sur la conduite à tenir face à l’antibiorésistance en Grande-Bretagne.
En France, depuis 2001, les campagnes de sensibillisation contre la surconsommation et le mésusage des antibiotiques ont permis de faire baisser la consommation. Mais, depuis 5 ans, elle repart à la hausse et la prescription reste innapropriée dans 60% des cas en ville et dans 40% des cas à l’hôpital.
"Il faut utiliser les antibiotiques de manière raisonnée que ce soit à l’hôpital ou en ville", explique le Dr Béatrice Demoré, pharmacien hospitalier au CHU Brabois de Nancy. "Et uniquement contre les infections bactériennes, poursuit-elle, contre les virus ils n’ont aucune action à part participer à la sélection des bactéries résistantes". Pour ne pas se retrouver sans armes contre les infections, il est nécessaire de continuer à éduquer les médecins et les patients mais il faut aussi miser sur la recherche. "Il est crucial de développer de nouvelles classes d’antibiotiques, d’explorer d’autres stratégies antibactériennes comme la phagothérapie ou de développer d’autres technologies capables de s’attaquer à ces bactéries multirésistantes."
Source : Patrick McGann, Erik Snesrud, Rosslyn Maybank, Brendan Corey, Ana C. Ong, Robert Clifford, Mary Hinkle, Timothy Whitman, Emil Lesho and Kurt E. Schaecher. Escherichia coli Harboring mcr-1 and blaCTX-M on a Novel IncF Plasmid : First report of mcr-1 in the USA. Antimicrobial Agents and Chemotherapy, 2016 ; DOI : 10.1128/AAC.01103-16
Qu’est ce que l’antibiorésistance ?
L’antibiorésistance est la capacité des bactéries à résister à l’action des antibiotiques. Alexander Fleming, lors de la remise de son Prix Nobel en 1945 pour la découverte de la pénicilline, prévenait déjà du danger de développement de résistances par les bactéries.
Ces micro-organismes sont capables de s’adapter à leur environnement et de se défendre contre des agresseurs potentiels et les antibiotiques en font partie. En effet, les bactéries peuvent posséder des gènes qui les rendent résistantes au mode d’action des antibiotiques. Ces gènes peuvent être présents de manière innée ou être acquise grâce à des mutations spontanées de leur ADN. Ils entraînent, par exemple, la modification de la structure des parois des bactéries qui les rend en quelque sorte "imperméables" aux antibiotiques.
Il existe toutefois bien d’autres stratégies qui sont susceptibles d’empêcher les antibiotiques d’agir. Comme ces transformations génétiques sont favorables à leur survie, elles les conservent. Elles peuvent aussi s’échanger facilement ces gènes de résistance grâce à des petits bouts d’ADN appelés plasmides.
source : francetvinfo.fr
Qui sont ces bactéries résistantes aux antibiotiques ?
source figaro.fr
AVIS D’EXPERT- Le problème des bactéries résistantes aux antibiotiques a pris une ampleur significative en France depuis les années 2010-2011, explique le Dr Christian Cattoen*.
La montée en puissance des bactéries résistantes aux antibiotiques de dernière génération constitue un problème de santé publique à l’échelle de la planète. Les bactéries mutent en permanence pour tenter d’échapper à l’action des antibiotiques, développés pour les combattre. Plus on utilise des molécules puissantes, dites « à large spectre », plus le risque augmente de voir apparaître des bactéries qui leur résistent. Repérer ces germes de façon aussi rapide que fiable pour limiter les risques d’épidémie est le rôle des biologistes médicaux. Dans cette véritable course contre la montre, les nouvelles techniques de biologie moléculaire jouent un rôle clé.
Dans les années 1980 sont apparus les premiers germes producteurs de bêta-lactamases à spectre étendu (BLSE), des enzymes qui rendent les bactéries insensibles à l’action des antibiotiques de la famille des bêta-lactamines (comme les pénicillines et les céphalosporines de première, deuxième et troisième générations). On recense aujourd’hui des centaines de BLSE différentes, apparues au fil de mutations successives. Elles sont toutes produites par des entérobactéries, des microbes présents pour l’essentiel au niveau du tube digestif.
Ce sont les premiers responsables d’infections à l’hôpital, mais aussi en ville où l’on voit émerger depuis quelques années des souches d’Escherichia coli, qui font partie des entérobactéries, productrices de BLSE. Cette résistance croissante pousse à utiliser des antibiotiques à plus large spectre, ce qui augmente le risque de sélectionner des souches encore plus résistantes.
Des possibilités de traitement réduites
Pour surmonter cet écueil, les chercheurs ont commencé à développer, il y a une vingtaine d’années, une nouvelle famille d’antibiotiques : les carbapénèmes. Il s’agit en quelque sorte d’antibiotiques de dernier recours, pour faire face aux entérobactéries productrices des BLSE. Sans surprise, la réponse bactérienne ne s’est pas fait attendre : dès les années 2000, les microbiologistes découvraient les premières entérobactéries productrices de carbapénèmases (EPC). Elles sont résistantes à l’ensemble des carbapénèmes, à des niveaux différents (inefficacité totale ou partielle). Elles le sont aussi très souvent à d’autres antibiotiques parmi les plus puissants, comme les céphalosporines de troisième génération. Autant dire qu’une infection à EPC réduit drastiquement les possibilités de traitement.
En France, le premier épisode impliquant des EPC a été signalé à l’Institut de veille sanitaire (InVS) en 2004. À l’époque, le problème était vraiment mineur, mais il a pris une ampleur significative en 2010-2011. Fin 2015, l’InVS avait enregistré un total de 2 026 épisodes impliquant des EPC, avec une forte augmentation en 2014 (650 signalements) et 2015 (582 à la fin de l’été). Un épisode peut recouvrir des situations très diverses : une personne simplement porteuse de la bactérie, une personne infectée par la bactérie ou une véritable épidémie de personnes infectées. En France, la plus grande épidémie recensée à ce jour a concerné plus de 180 patients.
Dans la plupart des cas, les EPC signalées dans l’Hexagone ont été contractées lors d’un voyage ou d’une hospitalisation dans un autre pays, où la présence de ces super-bactéries est beaucoup plus forte. La prévalence des EPC est très importante dans tout le pourtour méditerranéen, au Maroc, en Algérie, en Tunisie et en Égypte, mais aussi en Turquie, en Grèce et en Italie.
Enquête
Rechercher une bactérie multirésistante n’est cependant pas si simple. Deux méthodes coexistent en effet pour rechercher les EPC. La première repose sur la mise en culture d’un prélèvement rectal, réalisé chez le patient. Le résultat est obtenu en 48 heures. La seconde utilise la biologie moléculaire et consiste à rechercher les gènes qui codent pour les différentes carbapénèmases. Elle peut être réalisée directement à partir du prélèvement rectal, et son résultat obtenu dans la journée.
La mobilisation des biologistes ne s’arrête pas là, puisque repérer une EPC chez un patient déclenche une véritable enquête, afin d’identifier tous les patients qui ont été en contact avec lui. Cela peut représenter plusieurs centaines de personnes. Les biologistes médicaux hospitaliers qui exercent dans un laboratoire dépourvu d’équipement de biologie moléculaire peuvent bénéficier, outre le soutien de leurs confrères, de l’expertise d’un Centre national de référence (CNR).
La bataille contre les super-bactéries s’organise également sur le terrain de la prévention. Pour réussir, nous devons impérativement remporter deux victoires. La première, c’est une hygiène rigoureuse des mains. La seconde, c’est le bon usage des antibiotiques, dans l’espèce humaine mais aussi chez les animaux d’élevage. Administrer larga manu des antibiotiques à des poules ou à des vaches, c’est risquer de sélectionner des bactéries multirésistantes dans leur flore intestinale et de retrouver ces mêmes bactéries dans notre assiette ! C’est ainsi que les BLSE ont émergé.
* Christian Cattoen est chef du service de microbiologie du centre hospitalier de Valenciennes, président du collège de bactériologie, de virologie et d’hygiène des hôpitaux
Piperacilline/tazobactam vs carbapénèmes dans les infections graves, match nul sans certitude…
Publié le 26/07/2023
Un traitement antimicrobien empirique à large spectre est recommandé pour les patients atteints de sepsis ou de choc septique dans la campagne Surviving Sepsis. C’est ainsi que les inhibiteurs de β-lactamines/β-lactamases dont l’association pipéracilline/tazobactam (PI/TA) ou les carbapénèmes (CBP) dont le méropénème (MRP) sont utilisés. La résistance aux antimicrobiens est une menace majeure pour la santé mondiale selon l’OMS, en particulier l’émergence d’entérobactéries résistantes aux carbapénèmes. PI/TA peut être proposée comme agent d’épargne des CBP afin de limiter la propagation des bactéries multirésistantes et des surinfections.
PI/TA a été comparée au MRP lors de bactériémies à E. coli ou Klebsiella non sensibles à la ceftriaxone dans le cadre de l’essai de non-infériorité MERINO : la une mortalité à 30 jours y a été plus élevée chez les patients sous PI/TA (12,3 %) que chez ceux sous MRP (3,7 %). Cependant, la différence de mortalité était moins prononcée après exclusion des isolats non sensibles à l’association PI/TA. Des études systématiques antérieures comparant le traitement empirique ou définitif par des inhibiteurs de β-lactamines/β-lactamases et des carbapénèmes ont démontré des effets similaires sur la mortalité, suggérant que PI/TA et d’autres inhibiteurs de β-lactamines/β-lactamases peuvent représenter des alternatives sûres aux CBP.
En fin de compte, on ne sait toujours pas si PI/TA est inférieur aux CBP pour le traitement empirique ou définitif d’autres infections bactériennes graves.
Cette revue systématique (PubMed, Embase, CENTRAL, Epistemonikos, registres d’essais cliniques randomisés) a comparé les effets souhaitables et indésirables du traitement empirique et/ou définitif par PI/TA par rapport aux CBP chez les patients atteints d’infections bactériennes graves (toute infection bactérienne nécessitant une hospitalisation) en émettant l’hypothèse que l’association PI/TA donne des résultats moins favorables que les CBP dans ce groupe de patients.
Le résultat principal était la mortalité à court terme, toutes causes confondues, dans les 90 jours. Les résultats secondaires étaient la mortalité à long terme toutes causes confondues, les événements indésirables, la qualité de vie, le nombre de jours en vie sans assistance respiratoire ou la durée de l’assistance respiratoire, les infections secondaires, la sélection de champignons ou de bactéries résistantes, et le nombre de jours en vie et hors de l’hôpital ou la durée du séjour à l’hôpital.
De moins bons résultats avec pipéracilline/tazobactam mais les preuves sont faibles !
Trente et un essais (n = 8 790 patients) ont été inclus, tous présentant un risque de biais globalement élevé. Le risque relatif RR pour la mortalité à court terme toutes causes confondues y est de 1,16 (intervalle de confiance à 95 % IC 95 % : 0,94 - 1,43, niveau de preuve de certitude faible), pour les événements indésirables de 1,00 (IC 98 % : 0,96 - 1,04, preuve de certitude modérée), pour les infections secondaires de 1,13 (IC 98 % : 0,76 - 1,68, preuve de certitude très faible) et pour la sélection de champignons ou de bactéries résistantes de 1,61 (IC 98 % : 0,89 - 2,89, preuve de certitude très faible). Il n’y avait pas de données ou des données limitées pour les autres résultats.
Les essais inclus étaient hétérogènes. Tous ont été réalisés chez des patients atteints d’infections graves, mais aucun n’a concerné exclusivement des patients en soins intensifs, d’où une mortalité globale à court terme faible (6,3 %). Dans de nombreux essais, l’association PI/TA n’a été administrée que 2 ou 3 fois par jour, ce qui peut s’avérer insuffisant.
L’analyse du sous-groupe formé selon la stratégie de traitement a démontré que la PI/TA définitive était moins favorable, mais ce sous-groupe ne comprenait que quatre essais (n = 1 196), dont l’un comportait une proportion élevée d’infections à P. aeruginosa et l’autre 6 % de souches non sensibles à cette association, ce qui pourrait expliquer une partie de la différence de mortalité observée entre les sous-groupes.
En attendant, des essais de haute qualité il semble raisonnable de considérer la PI/TA et les CBP comme des options thérapeutiques efficaces pour les infections bactériennes graves.
Dr Bernard-Alex Gaüzère
Référence
Munch, MW, Granholm, A, Jonsson, AB, et al. : Piperacillin/tazobactam versus carbapenems in patients with severe bacterial infections : A systematic review with meta-analysis. Acta Anaesthesiol Scand. 2023 ; 67( 7) : 853- 868. doi:10.1111/aas.14239
Source : jim.fr
Découverte d’un nouvel antibiotique aux mécanismes d’action inhabituels
Aude Lecrubier
Medsape.com
5 septembre 2023
Alors que la résistance aux antibiotiques est un problème de santé publique majeur et que peu de nouvelles molécules sont en développement, un nouvel antibiotique, nommé clovibactine est porteur d’espoir.
Ce dernier, isolé à partir de bactéries qui n’avaient pas pu être étudiées auparavant, semble capable de combattre les "superbactéries" multirésistantes grâce à des mécanismes d’action inhabituels.
Il a été découvert et étudié par des scientifiques de l’université d’Utrecht, de l’université de Bonn (Allemagne), du Centre allemand de recherche sur les infections (DZIF), de l’université Northeastern de Boston (États-Unis) et de la société NovoBiotic Pharmaceuticals (Cambridge, États-Unis).
Leurs recherches ont été publiées dans la revue Cell[1] .
« Comme la clovibactine a été isolée à partir de bactéries qui jusqu’ici ne pouvaient pas être cultivées, les bactéries pathogènes n’ont jamais vu un tel antibiotique et n’ont pas eu le temps de développer une résistance », explique Markus Weingarth, chercheur au département de chimie de l’université d’Utrecht, dans un communiqué de presse[2].
Découverte à partir de la "matière noire" bactérienne
La clovibactine a pu être isolée d’un sol sablonneux de Caroline du Nord et étudiée grâce au dispositif iCHip, mis au point en 2015, qui permet aux chercheurs de cultiver la "matière noire bactérienne", c’est-à-dire des bactéries jusqu’ici non cultivables et dont 99% des bactéries font partie.
Ce dispositif a aussi permis la découverte de l’antibiotique teixobactine en 2020, actif sur les bactéries Gram positives, un des premiers antibiotiques véritablement nouveau depuis des décennies et qui a une action proche de la clovibactine.
Une action contre un vaste panel des bactéries résistantes
Dans la publication de Cell, les chercheurs montrent que la Clovibactine agit par plusieurs mécanismes et qu’elle a pu traiter avec succès des souris infectées par la superbactérie Staphylococcus aureus.
Plus spécifiquement, la clovibactine a présenté une activité antibactérienne contre un large éventail d’agents pathogènes à Gram positif, y compris des souches de S. aureus résistantes à la méthicilline (SARM), des souches de S. aureus résistantes à la daptomycine et des souches de S. aureus moyennement résistantes à la vancomycine (VISA), ainsi que des entérocoques résistants à la vancomycine difficiles à traiter et E. faecium (entérocoques résistants à la vancomycine [ERV]). Escherichia coli n’a été que marginalement affectée par rapport à une souche WO153 d’E. coli déficiente au niveau de la membrane externe, ce qui reflète probablement une pénétration insuffisante du composé.
Un mécanisme d’action original
La clovibactine n’agit pas sur une, mais trois molécules différentes qui sont toutes essentielles à la construction de la paroi des bactéries : C55PP, lipide II et lipide IIIWTA provenant de différentes voies de biosynthèse de la paroi cellulaire. Plus précisément, la clovibactine se lie à la partie pyrophosphate de ces précurseurs.
Elle s’enroule autour du pyrophosphate « comme un gant étanche, comme une cage qui enferme sa cible », explique Markus Weingarth. C’est ce qui a donné à la clovibactine son nom, dérivé du mot grec "Klouvi", qui signifie cage.
Aussi, elle ne se lie qu’au pyrophosphate immuable (qui ne mute pas) et non pas à la partie variable sucre-peptide des cibles. Les bactéries auront donc beaucoup plus de mal à muter pour développer une résistance à son encontre. « En fait, nous n’avons pas observé de résistance à la clovibactine dans nos études », se réjouit Markus Weingarth.
Pour finir, après avoir fixé les molécules cibles, elle s’auto-assemble en grandes fibrilles à la surface des parois bactériennes. Ces fibrilles sont stables et garantissent ainsi que les molécules cibles restent séquestrées aussi longtemps que nécessaire pour que les bactéries soient tuées.
Probablement peu d’effets secondaires en perspective
Le mécanisme d’action de l’antibiotique laisse présager peu d’effets secondaires. En effet, la clovibactine cible les cellules bactériennes mais pas les cellules humaines.
« Comme ces fibrilles ne se forment que sur les membranes bactériennes et non sur les membranes humaines, c’est probablement la raison pour laquelle la clovibactine endommage sélectivement les cellules bactériennes mais n’est pas toxique pour les cellules humaines », explique Markus Weingarth.
D’autres études, notamment chez l’homme seront nécessaires avant que l’antibiotique ne puisse être envisagé comme traitement. En attendant, les règles de bons usages des antibiotiques doivent continuer à s’appliquer afin de limiter la résistance aux antibiotiques.
En 2019, 4,95 millions de décès dans le monde ont été associés à la multirésistance bactérienne, dont 1,27 million lui ont été directement attribués [3]. Si cette tendance se poursuit sans que de nouveaux médicaments soient disponibles pour traiter les infections bactériennes, on estime que 10 millions de personnes mourront chaque année de ce phénomène d’ici à 2050 [4].
Références
- Shukla R, Peoples AJ, Ludwig KC, et al. A new antibiotic from an uncultured bacterium binds to an immutable target Cell 2023, DOI : 10.1016/j.cell.2023.07.038
- Communiqué Utrecht University. New antibiotic from microbial ‘dark matter’ could be powerful weapon against superbugs. Previously inaccessible source provides unusual antibiotic 22 August 2023
- Murray CJL, Ikuta KS, Sharara F, et al. Global burden of bacterial antimicrobial resistance in 2019 : a systematic analysis. Lancet 2022. 399 : 629–655
- O’Neil J (2014) Antimicrobial resistance : tackling a crisis for the health and wealth of nations.
§§§
Arnaud BASSEZ
IADE/Enseignant CESU
Administrateur