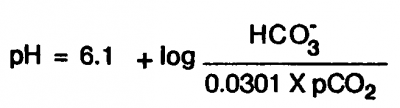Actualisé le 28 octobre 2021
L’ACIDOSE METABOLIQUE
L’acidose métabolique est une accumulation excessive d’acides dans le sang (son pH devient inférieur à 7,38, la norme étant comprise entre 7.38 et 7,42). Elle est due soit à une production excessive d’acides par l’organisme, soit par une élimination insuffisante de ces acides par les reins. Elle intervient principalement en cas de diabète insulinodépendant déséquilibré, d’insuffisance rénale majeure,, de jeûne ou d’intoxication médicamenteuse. L’acidose métabolique entraîne une accélération de la fréquence respiratoire (destinée à faire baisser l’acidité du sang). La recherche de la cause à l’origine de cet excès d’acides et le traitement de celle-ci permet de corriger l’acidose métabolique.
A. Diagnostic des acidoses métaboliques
La présence d’une acidose métabolique peut être suspectée devant :
– un contexte évocateur : insuffisance rénale, diarrhée sévère, etc. ;
– des anomalies biochimiques : baisse des bicarbonates plasmatiques ;
– parfois des manifestations cliniques :
• En cas d’acidose aiguë sévère : le plus souvent simple hyperventilation, détresse respiratoire, bas débit cardiaque, coma,
• En cas d’acidose chronique : lithiases et néphrocalcinose, amyotrophie, retard de croissance, ostéomalacie, fractures pathologiques.
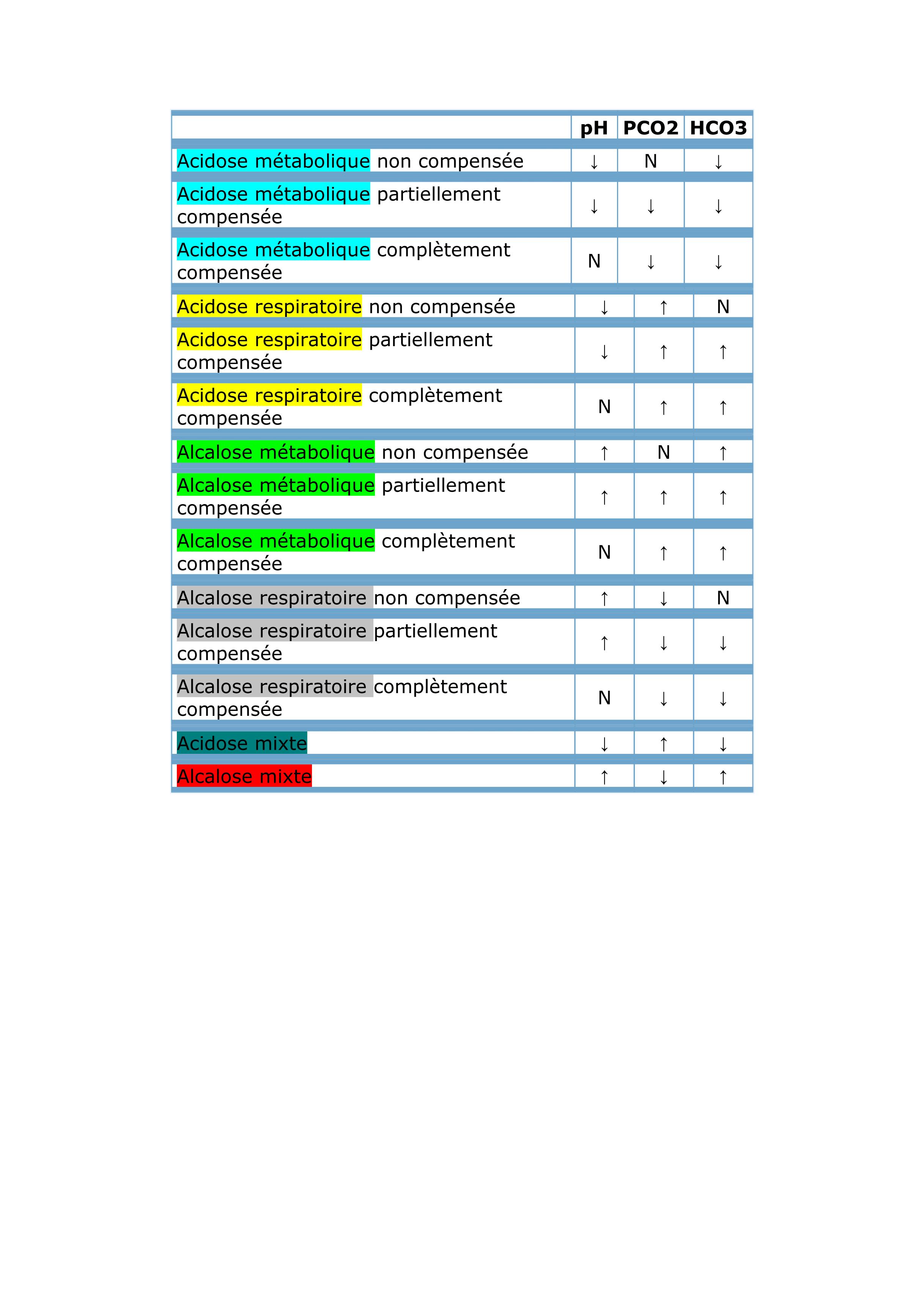
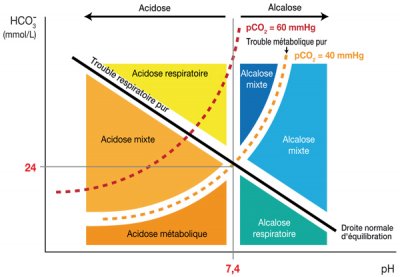
1. PREMIÈRE ÉTAPE : AFFIRMER L’ACIDOSE MÉTABOLIQUE
[(Acidose = pH sanguin artériel < 7,38 (ou veineux < 7,32)
Métabolique = HCO3- < 22 mmol/L (baisse secondaire de PCO2 par compensation ventilatoire))]
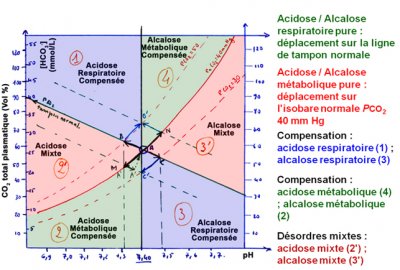
La réponse compensatrice peut être prédite :
• En cas d’acidose métabolique simple, la baisse de la [HCO3–] entraîne une baisse prévisible de PCO2. La baisse de [HCO3–] (mmol/L) multipliée par 1,2 donne approximativement la baisse de PCO2 (en mmHg).
∆ PCO2 (en mmHg) = ∆ [HCO3–] x 1,2.
• Si la PCO2 est plus basse ou plus élevée que la valeur calculée, il faut suspecter un désordre acido-basique complexe, respectivement une alcalose ou une acidose respiratoire associée.
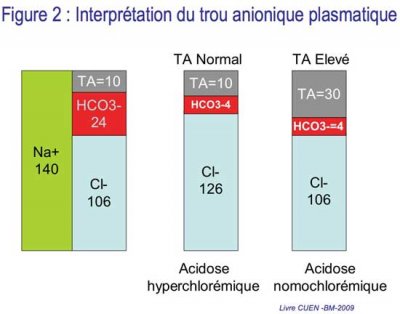
2. DEUXIÈME ÉTAPE : DÉTERMINER LE TROU ANIONIQUE PLASMATIQUE
• La somme des cations (charges positives) et des anions (charges négatives) est égale dans le sang (principe de l’électroneutralité).
• Il existe normalement plus d’anions indosés (protéines plasmatiques, et dans une moindre mesure phosphates, sulfates et autres anions organiques) que de cations indosés (calcium et le magnésium) dans le plasma.
• Cette différence correspond au trou anionique :
TA = [Na+] – [Cl–+HCO3–] = 12 +/- 4 mmol/L
(ou 16±4 si le K+ est pris en compte)
Un TA > 16 mmol/L est considéré comme élevé et traduit la rétention d’anions indosés.
• Acidose avec trou anionique normal : perte rénale ou digestive de HCO3– : baisse du HCO3– compensée par une augmentation proportionnelle du Cl– d’oùacidose métabolique hyperchlorémique.
• Acidose avec trou anionique élevé : addition d’un acide autre que HCl : augmentation du TA car la baisse de [HCO3–] remplacée par un anion non mesuré (par exemple le lactate).
B. Diagnostic physiopathologique et étiologique des acidoses métaboliques
Tableau 3. Principales causes d’acidose métabolique selon le mécanisme
| Mécanisme | Trou anionique augmenté | Trou anionique normal |
|---|---|---|
| Perte de bicarbonate | •Diarrhées
| |
| Excrétion rénale d’acide diminuée | Insuffisance rénale | • Défaut de production de NH4+ : acidose tubulaire distale hyperkaliémique (type 4) : hypoaldostéronisme • Défaut de sécrétion des ions H+ : Acidose tubulaire distale (type 1) |
La principale voie d’élimination rénale des protons (H+) est l’excrétion urinaire d’ammoniaque (NH4+). En cas d’acidose à trou anionique normal, la réponse rénale peut être évaluée par le calcul du trou anionique urinaire qui est le reflet de l’ammoniurie :
TAU : UNa + UK – UCl
TAU < 0 (= concentration de NH4+ urinaire élevée) = réponse rénale adaptée ‡ origine extra-rénale de l’acidose.
TAU > 0 (= concentration de NH4+ urinaire basse) = réponse rénale inadaptée ‡ origine tubulaire rénale
1. ACIDOSES MÉTABOLIQUES AVEC TROU ANIONIQUE AUGMENTÉ
• Production endogène ou surcharge exogène aiguë d’H+ avec un anion indosé.
• Défaut d’élimination des H+ : insuffisance rénale chronique avancée.
Tableau 4. Acidoses métaboliques avec TA augmenté
| Type | Causes | Causes |
|---|---|---|
| Acidocétoses | • Hypoxie tissulaire (choc) • Biguanides • Insuffisance hépatocellulaire |
• Lactate |
| Acidocétoses | • Diabète • Alcool • Jeûne |
• beta hydroxy-butyrate |
| Intoxications | • Aspirine • Éthylène glycol (antigel) • Méthanol |
• Salicylates • Glyoxalate, oxalate • Formate |
| Insuffisance rénale | Insuffisance rénale |
Figure 2. Conduite à tenir devant une acidose métabolique
2. ACIDOSES MÉTABOLIQUES AVEC TROU ANIONIQUE NORMAL (= ACIDOSES HYPERCHLOREMIQUES)
Deux types de mécanismes :
– par perte de bicarbonate de sodium digestive (diarrhée) ou rénale (acidose tubulaire proximale) : trou anionique urinaire négatif ;
– par diminution de l’excrétion acide par le rein (acidose tubulaire dis-tale sans insuffisance rénale sévère) : trou anionique urinaire positif.
Tableau 5. Mécanismes et causes des acidoses tubulaires
| Acidose tubulaire | Proximale (type 2) | Distale (type 1) | Distale hyperkaliémique (type 4) |
|---|---|---|---|
| Défaut | Réabsorption des HCO3– | Anomalie de la pompe à protons apicale | Hypoaldostéronisme |
| Signes associés | Syndrome de Fanconi Ostéomalacie |
Néphrocalcinose Ostéomalacie |
|
| Causes | Myélome Cystinose Acetazolamide Ifosfamide |
Sjögren, Lupus Certaines hypercalciuries Drépanocytose Formes héréditaires |
Uropathie obstructive Hyporéninisme et hypoaldostéronisme (diabète) IEC/ARA 2, AINS Spironolactone, Amiloride Insuffisance surrénale Héparines Anticalcineurines Triméthoprime, Pentamidine |
| Fréquence chez l’adulte | Rare | Rare | Fréquent |
| Kaliémie | Basse, aggravée par l’apport d’alcalins | Basse, corrigée par l’apport d’alcalins | Élevée |
| pH urinaire | variable | > 5,5 | < 5,5 |
C. Traitement des acidoses métaboliques
1. ACIDOSES MÉTABOLIQUES AIGUËS
• Urgence vitale si pH < 7,10 ou bicarbonatémie < 8 mmol/L : diminution des débits cardiaques et tissulaires, résistance aux catécholamines, arythmies ventriculaires, inhibition du métabolisme cellulaire, et coma.
• Moyens thérapeutiques disponibles :
– recherche et traitement de la cause ;
– élimination du CO2 : correction d’un bas débit, ventilation artificielle ;
– alcalinisation :
• discutée dans les acidoses lactiques,
• discutée dans les acidocétoses : insuline et réhydratation,
• indispensable dans les acidoses hyperchlorémiques ou associées à certaines intoxications : bicarbonate de sodium IV pour remonter rapidement le pH > 7,20 et la bicarbonatémie > 10 mmol/L :
quantité HCO3 (mmol) = ∆ [HCO3–] x 0,5 x poids (en kg) ;
– épuration extra-rénale si insuffisance rénale organique associée (pour éviter une surcharge hydrosodée liée à la perfusion de bicarbonate de sodium).
2. ACIDOSES CHRONIQUES D’ORIGINE RÉNALE
Traitement nécessaire pour prévenir la fonte musculaire, la lithiase rénale ou la néphrocalcinose, la déminéralisation osseuse et chez l’enfant le retard de croissance.
• Acidose tubulaire proximale et acidose tubulaire distale de type 1 : sels alcalins (bicarbonate ou citrate) de sodium ou de potassium selon l’anomalie prédominante.
• Acidoses tubulaires hyperkaliémiques : résine échangeuse d’ion (Kayexalate®), furosémide (Lasilix®), et fludrocortisone en cas d’insuffisance surrénale.
• Insuffisance rénale : maintenir le taux de bicarbonate > 25 mmol/L par des apports de bicarbonate de sodium (1 à 6 g par jour en gélules).
ALCALOSE MÉTABOLIQUE
A. Introduction
• La génération d’une alcalose métabolique nécessite l’association de deux processus :
– une augmentation de l’addition d’alcalins au liquide extra-cellulaire ;
– une altération de l’excrétion rénale de bicarbonate (entretien ou main-tien de l’alcalose).
• L’entretien d’une alcalose métabolique est favorisée par :
– une diminution du débit de filtration glomérulaire ;
– une augmentation de la réabsorption des bicarbonates ;
– une contraction du volume circulant (absolu ou efficace) ;
– une déplétion en chlore (++) ou en potassium.
B. Principales causes d’alcalose métabolique
1. ALCALOSE MÉTABOLIQUE DE CONTRACTION
(DU VOLUME EXTRA-CELLULAIRE)
• Contraction volémique d’origine extra-rénale :
– pertes digestives hautes (vomissements, aspiration naso-gastrique) ;
– rare adénome villeux du rectum ou achlorhydrie congénitale.
• Perte en sel d’origine rénale :
– surtout diurétique ;
– tubulopathies congénitales : syndrome de Bartter et de Gitelman ;
– hypomagnésémie, hypercalcémie ;
– élimination urinaire d’anions non réabsorbables (hydroxybutyrate, car-benicillate).
2. ALCALOSE MÉTABOLIQUE AVEC EXPANSION VOLUMIQUE, HYPERTENSION ARTÉRIELLE ET EXCÈS DE MINÉRALOCORTICOÏDES
• Hyperaldostéronisme primaire : HTA, aldostérone élevée, rénine basse :
– adénome de Conn ;
– hyperplasie bilatérale des surrénales ;
– exceptionnelle hyperplasie sensible à la dexaméthasone (autoso-mique dominante), rare cancer des surrénales.
• Syndromes apparentés avec aldostérone et rénine basses :
– surtout glycyrrhizine (réglisse) inhibe la 11betahydroxystéroïde déshy-drogénase ;
– déficits en 17alpha ou 11beta-hydroxylase, ou tumeur sécrétant un précur-seur (desoxycorticostérone) ;
– syndrome de Liddle : augmentation de la sensibilité du tube distal à l’aldostérone, autosomique dominante.
• Hyperaldostéronisme secondaire : HTA, aldostérone et rénine augmentées :
– sténoses uni- ou bilatérales des artères rénales ;
– HTA maligne.
3. ALCALOSE POST-HYPERCAPNIQUE
Au cours de l’hypercapnie chronique (acidose respiratoire chronique) la réab-sorption des bicarbonates est augmentée de façon appropriée limitant ainsi l’élévation du pH artériel. Lors de la mise en route d’une ventilation assistée, la PCO2 s’abaisse rapidement mais le rein élimine plus lentement le bicarbonate accumulé.
4. EXCÈS D’APPORTS ALCALINS
Administration rapide de larges quantités de sels alcalins : bicarbonate de sodium, apports importants de citrate (transfusion massive ou anticoagulation par citrate). Ce risque est aggravé en cas d’insuffisance rénale (diminution de la capacité à excréter une charge alcaline).
C. Évaluation du patient ayant une alcalose métabolique
La présence d’une alcalose métabolique peut être suspectée devant :
– un contexte évocateur : diurétique, abus de laxatif, vomissements, etc. ;
– des anomalies biochimiques : élévation des bicarbonates plasmatiques, hypokaliémie, hypocalcémie, hypomagnésémie, hypophosphatémie ;
– manifestations cliniques peu spécifiques et rares : crise de tétanie, faiblesse musculaire, hypoventilation, arythmies, comitialité, coma.
ÉTAPE 1 : AFFIRMER L’ALCALOSE MÉTABOLIQUE (DIAGNOSTIC POSITIF)
[(Alcalose = pH sanguin artériel > 7,42 (ou veineux 7,38)
Métabolique = bicarbonate > 27 mmol/L (augmentation secondaire de PCO2, compensation ventilatoire))]
La réponse compensatrice peut être prédite.
Le caractère « pur » ou « mixte » de l’alcalose métabolique est évalué à partir des valeurs attendues de la PCO2 (compensation respiratoire adaptée ou non) (PCO2 (mmHg) qui doit normalement augmenter des trois-quarts de la variation des bicarbonates) :
∆PCO2 = 0,75 ∆HCO3-
Si la PCO2 est moins élevée que ne le prédit la formule il faut suspecter un trouble complexe avec alcalose respiratoire surajoutée.
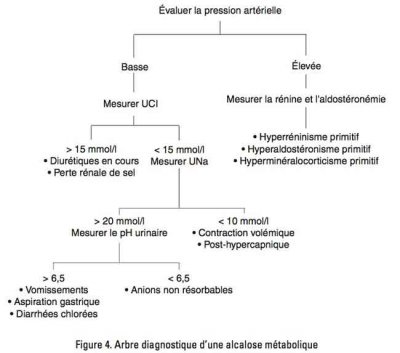
ÉTAPE 2 : RECHERCHER LES FACTEURS D’ENTRETIEN DE L’ALCALOSE
1. Contraction volémique : avec baisse de la pression artérielle, insuffisance rénale fonctionnelle et diminution des concentrations urinaires de chlore et de sodium. Une concentration de chlore urinaire < 25 mmol/L est suggestive de contraction volémique.
2. Hyperminéralocorticisme avec HTA : doser rénine et aldostérone plasmatique.
La conduite diagnostique est résumée dans la figure 4.
D. Traitement de l’alcalose métabolique
Le traitement est étiologique :
– correction de la contraction du volume extra-cellulaire (déshydratation extracellulaire) : administration de chlorure de sodium ;
– corriger une carence en magnésium, une carence sévère en potassium (par du KCl) ;
– supprimer la source de l’excès en minéralocorticoïdes (surrénalectomie ou traitement d’un syndrome de Cushing), ou traitement symptomatique par spironolactone (Aldactone®) qui bloque de façon compétitive le récepteur aux minéralocorticoïdes, ou amiloride (Modamide®) qui bloque le canal sodium épithélial dans le tube collecteur cortical ;
– arrêter un traitement diurétique ou une aspiration naso-gastrique.
Un pH > 7,60 engage le pronostic vital.
– Équation d’Henderson
Le diagnostic de l’équilibre acide-base est souvent enseigné à partir de l’équation de Henderson-Hasselbalch qui nécessite le recours au pH, l’antilogarithme de la concentration de H+ et la capacité de manipuler les logarithmes.
De nombreux cliniciens préfèrent utiliser l’équation simplifiée de Henderson qui permet de se passer des logarithmes et permet d’utiliser la PCO2 non modifiée.
H+ (nmol/L) = 24 x PCO2 (mmHg)/ HCO3– (mmol/L)
La plupart des laboratoires rapportent les résultats sous forme de pH plutôt que de concentration en H+. Il faut donc convertir les pH en H+ mais c’est un faible prix pour éliminer les logarithmes.
Plutôt que de recourir à une table de conversion, on peut utiliser la relation inverse quasi linéaire entre H+ et pH dans les valeurs physiologiques et pathologiques usuelles. Dans la fourchette de pH 7,25 à 7,50, une augmentation du pH de 0,01 unité représente une diminution de H+ d’environ 1 nmol/L par rapport à la normale de 40 nmol/L.
Par exemple, un pH de 7,25 représente une variation de 0,15 unité par rapport à 7,4 (normal). La concentration H+ peut être calculée comme 40 + 15 soit 55 nmol/L.
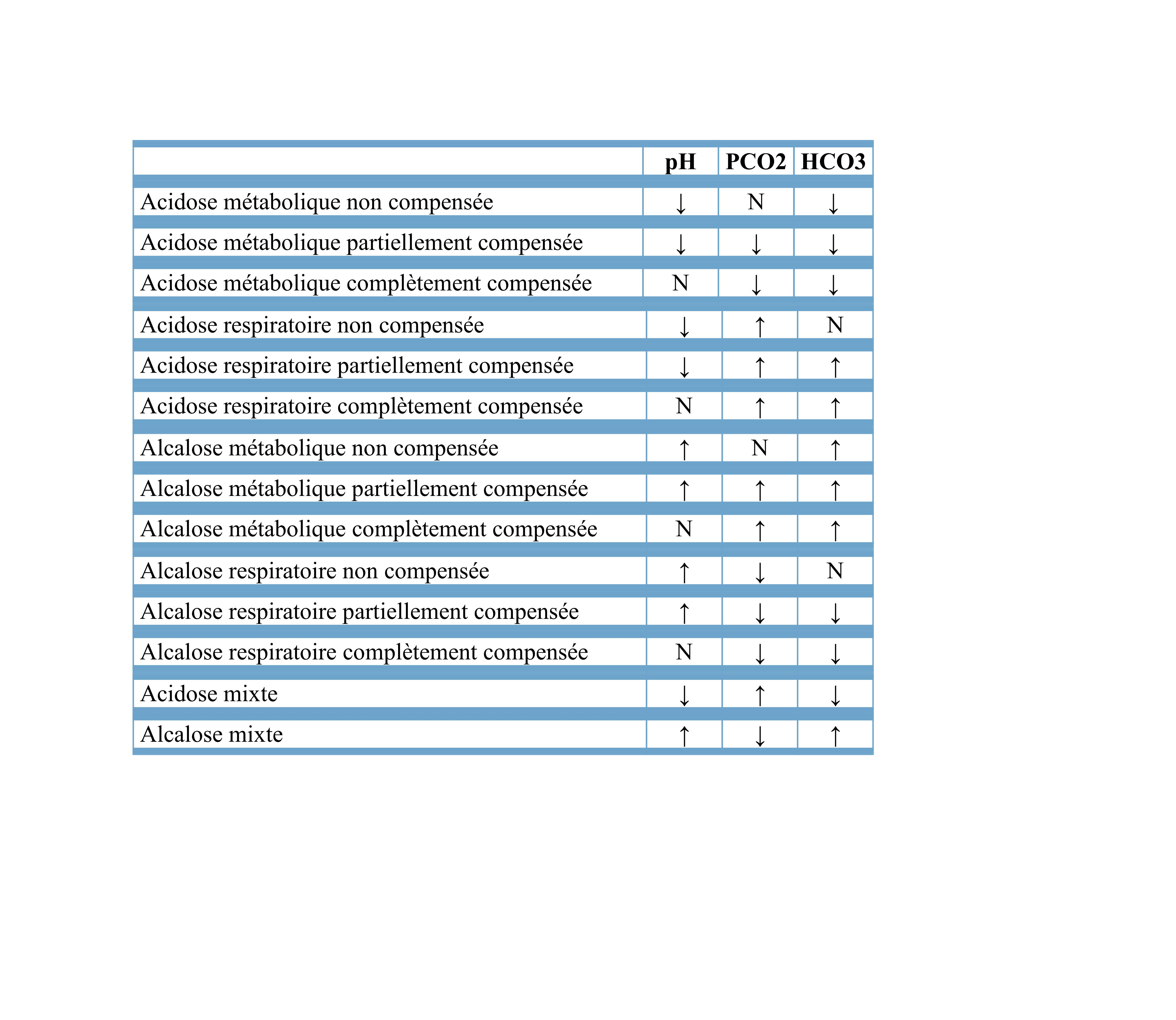
Tableau résumant les variations de paramètres pour les différents déséquilibres acido-basiques :
source : le site du CUEN (collège universitaire enseignant néphrologie)
— -
GAZ DU SANG
GAZ DU SANG : INTERPRÉTATION
I. Conditions
Pour évaluer correctement une anomalie des gaz du sang, il faut connaître :
- 1. Gazométrie artérielle : pH, PaO2, PaCO 2, HCO3, BE
- 2. Comportement ventilatoire : FR, VT, VA
- 3. Réponse à l’oxygénothérapie
- 4. Évaluation oxygénation tissulaire (hypoxie), notamment état cardiovasculaire
II. Règles d’interprétation
A. PaCO2 : état ventilatoire
- < 30 mmHg : hyperventilation alvéolaire (alcalose respiratoire)
- 30-50 mmHg : ventilation alvéolaire acceptable
- > 50 mmHg : hypoventilation alvéolaire (acidose respiratoire)
B. pH : alcalose/acidose aiguë/compensée
1. Hyperventilation alvéolaire :
- aiguë : pH > 7,50
- chronique : pH 7,40 - 7,50
- acidose métabolique compensée : pH 7,30 - 7,40
- acidose métabolique partiellement compensée : pH < 7,30
2. Ventilation alvéolaire acceptable :
- alcalose métabolique : pH > 7,50 (alcalémie)
- situation d’équilibre : pH 7,30 - 7,50
- acidose métabolique : pH < 7,30 (acidémie)
3. Hypoventilation alvéolaire :
- alcalose métabolique partiellement compensée : pH > 7,50
- hypoventilation alvéolaire chronique : pH 7,30 - 7,50 (ou alcalose métabolique compensée)
- hypoventilation alvéolaire aiguë : pH < 7,30
C. PaO2
1. A l’air ambiant
- normal : > 80 mmHg (limite acceptable)
- hypoxémie modérée : < 80 mmHg
- moyenne : < 60 mmHg
- sévère : < 40 mmHg
NB : par année au-delà de 60 ans, retrancher 1 mmHg aux limites indiquées pour les hypoxémies modérées et moyennes (si < 40 mmHg : toujours sévère)
2. Réponse à l’oxygénothérapie de l’hypoxémie
– non corrigée : PaO2 < limites acceptables en air ambiant
– corrigée : PaO2 > limites acceptables an air ambiant mais < 100 mmHg
– surcorrigée : PaO2 > 100 mmHg
D. Etat d’oxygénation tissulaire : critères cliniques
– état cardiaque (DC)
– état de perfusion périphérique
– mécanismes de transport de l’O2 : PaO2, CaO2, taux d’Hb, affinité Hb pour O2
III. Situations cliniques
- 1. acidose métabolique : cf acidose métabolique
- 2. alcalose métabolique : cf alcalose métabolique
- 3. alcalose respiratoire : cf hyperventilation alvéolaire
- 4. acidose respiratoire : cf défaillance ventilatoire
- 5. affections responsables d’une augmentation de l’espace mort : valeurs des gaz du sang dénuées de sens si elles ne sont pas comparées aux données du travail ventilatoire (l’oxygénothérapie ne modifie que peu la ventilation alors qu’elle augmente fortement la PaO2) :
– embolie pulmonaire aiguë
– diminution du débit cardiaque
source oncorea.com
§§§
A lire en complément
pH(a) pH du sang artériel Un excellent site qui explique beaucoup de choses telles que
- pO2
- ctHb
- sO2
- FO2Hb
- FCOHb
- FMetHb
- FHbF
- ctO2
- p50
- pO2(x) et px
- FShunt
- cx
- Qx
- cLactate(P)
- pH(a)
- pCO2(a)
- cHCO3-(aP)
- cHCO3-(aP,st)
- cBase(a)
- cBase(Ecf)
- ctBilirubin
- cGlucose(P)
- cLactate(P)
- cK+(aP)
- cNa+(aP)
- cCl–(aP)
- cCa2+(aP)
- Trou anionique(K+)
Acidose métabolique en soins critiques : bicarbonates ou épuration extra-rénale ?
Publié le 30/09/2021
L’acidose métabolique résulte d’une augmentation des acides faibles (protéines sériques, albumine, phosphates inorganiques) ou d’une diminution du différentiel des ions forts (Na+, K+, Ca2+, Mg2+ et Cl-) qui existent à l’état totalement ionisé dans les fluides corporels. Cette différence résulte de la présence d’un excès de cations forts par rapport aux anions forts, et la valeur normale dans le plasma est de 42 mEq/l. La méthode de quantification de l’acidose métabolique a été introduite par Stewart dans les années 1980 et suscite toujours un débat quant à son application clinique. L’excès de bases plasmatiques est également largement utilisé pour identifier une composante métabolique de l’acidose dans la pratique clinique. Cet article se penche sur l’acidose métabolique aiguë chez les patients des unités de soins critiques (USC) et fait le point sur les études cliniques récemment publiées.
Épidémiologie de l’acidose métabolique en soins critiques
En Australie et en Nouvelle-Zélande, une étude d’observation rétrospective précise l’incidence, les caractéristiques et les évolutions des patients présentant diverses définitions de l’acidose métabolique. L’acidose métabolique sévère définie comme un pH ≤ 7,20, une PaCO2 ≤ 45 mmHg, une HCO3- ≤ 20 mmol/l et un score SOFA ≥ 4 ou une lactatémie ≥ 2 mmol/l, a été retrouvée chez 1,5 % des patients en USC, avec des taux de mortalité en USC et à l’hôpital, respectivement de 43,5 % et 48,3 %. L’acidose métabolique modérée ou sévère définie comme un pH < 7,30, un excès de bases < - 4 mmol/l et une PaCO2 ≤ 45 mmHg, et a été retrouvée chez 8,4 % des patients en USC, avec des taux de mortalité en USC et à l’hôpital respectivement de 17,3 % et 21,5 %. Notons que la mortalité des patients atteints d’acidose métabolique modérée ou sévère était plus élevée que celle des patients atteints de septicémie observée dans la même base de données.
Types courants d’acidose métabolique en soins critiques
L’acido-cétose diabétique (ACD), l’acidose lactique et l’acidose hyperchlorémique sont responsables de la plupart des cas d’acidose métabolique sévère. L’ACD est une urgence médicale en raison d’une carence en insuline. Le métabolisme hépatique des acides gras produit du bêta-hydroxybutyrate et de l’acéto-acétate, des anions puissants.
Comme l’hyperglycémie induit une diurèse osmotique, les patients atteints d’ACD ont un volume de liquide extracellulaire nettement réduit.
Le lactate est un anion fort puisque plus de 99 % du lactate est ionisé. L’acidose lactique est observée en cas de choc cardiogénique ou hypovolémique, d’insuffisance cardiaque sévère, de traumatisme grave et de sepsis, avec des taux de mortalité élevés de 30 à 88 % selon la définition utilisée et la plus élevée (56 %) chez les patients atteints d’acidose métabolique définie par un SBE (standard base excess) < - 2 mEq/l. Récemment, l’acidose hyperchlorémique causée par les perfusions est passée au premier plan, signalée chez 19 % à 45 % des patients de soins critiques. La conséquence la plus critique de l’acidose métabolique porte sur le système cardiovasculaire. La reconnaissance de cet effet remonte aux années 1960, lorsqu’une étude a signalé une réduction de la contractilité cardiaque à un pH < 7,1 lors de l’administration d’acide lactique à des chiens. Cependant, les études cliniques menées chez l’homme n’ont pas encore démontré une relation de cause à effet entre l’acidose métabolique et le dysfonctionnement cardiovasculaire.
Comment nous gérons l’acidose métabolique en USC ?
Chez les patients en état critique, l’acidose métabolique n’est pas une maladie unique mais un syndrome dû à diverses conditions sous-jacentes. Le principe de base est donc de traiter la cause sous-jacente de l’acidose métabolique. Le bicarbonate de sodium peut être administré si l’on s’inquiète de l’altération de la fonction cardiaque consécutive à l’acidose métabolique. La justification de l’utilisation du bicarbonate de sodium est qu’il augmente le pH, améliorant ainsi la fonction cardiaque. Une étude d’observation internationale récente a montré que 18 % des patients présentant une acidose métabolique modérée ou sévère reçoivent actuellement du bicarbonate de sodium, avec une quantité totale de bicarbonate administrée au cours des 24 premières heures d’acidose métabolique de 110 mmol, sans ajustement en fonction du poids corporel ou de l’excès de bases.
La synthèse de 12 études pertinentes a montré que le pH, le bicarbonate sérique, l’excès de base, le sodium sérique et la PaCO2 augmentent pendant et après l’administration intraveineuse de bicarbonate de sodium, mais que le trou anionique et le potassium sérique diminuent. Par contre, l’acidose intracellulaire due à la rétrodiffusion du CO2 et à la diminution du calcium ionisé, pourrait nuire à la contraction cardiaque. Cependant, l’analyse de la littérature n’a pas permis d’établir que l’administration de bicarbonate de sodium est associée à une diminution du calcium ionisé ou du débit cardiaque.
Les effets du bicarbonate de sodium sur les résultats cliniquement pertinents n’ont été évalués que dans deux études randomisées. Hoste et al. (2005) ont comparé l’effet du bicarbonate de sodium et du tris(hydroxyméthyl)aminométhane, THAM, chez 18 patients présentant une acidose métabolique légère, sans résultats cliniquement significatifs, peut-être parce qu’il s’agissait d’un essai pilote. Les effets du THAM n’ont pas été étudiés depuis cet essai, car il est rarement utilisé dans la pratique clinique actuelle.
L’essai BICAR-ICU (2018) a été mené dans 26 USC françaises auprès de 389 patients présentant une acidémie sévère (pH ≤ 7,20, PaCO2 ≤ 45 mmHg, HCO3- ≤ 20 mmol/l, et un score SOFA total ≥ 4 ou lactate ≥ 2 mmol/l), en excluant ceux atteints d’acidocétose ou de maladie rénale chronique. Les patients ont été répartis entre un groupe d’intervention recevant du bicarbonate de sodium à 4,2 % pour maintenir un pH > 7,3 pendant tout le séjour en USC et un groupe témoin recevant les soins habituels. Il n’y a pas eu de différence entre les groupes en ce qui concerne le résultat principal, qui était un composite de décès au jour 28 et d’au moins une défaillance d’organe à J7.
Cependant, le traitement au bicarbonate a été associé à une réduction du besoin en suppléance rénale. En outre, dans le sous-groupe pré-spécifié de patients en insuffisance rénale aiguë (IRA) (score AKIN 2 ou 3), le bicarbonate de sodium a été associé à une amélioration de la survie et à une réduction du besoin de traitement de substitution rénale.
Dans une étude d’observation rétrospective réalisée à partir de la base de données du Medical Information Mart for Intensive Care (MIMIC)-III, l’administration de bicarbonate de sodium n’a pas été associée à une amélioration de la survie chez les patients présentant une acidose métabolique (pH < 7,3, HCO3- < 20 mmol/l et PaCO2 < 50 mmHg) mais a été associée à une amélioration de la survie chez les patients septiques présentant une IRA de stade 2 ou 3 et une acidémie sévère (pH < 7,2) [26].
Bicarbonate de sodium pour les divers types d’acidose métabolique
L’administration de bicarbonate de sodium a été envisagée pour l’ACD non seulement parce que le bicarbonate de sodium contrôle l’acidose, mais aussi parce que l’acidose peut contribuer à la résistance à l’insuline. Toutefois, une étude rétrospective monocentrique menée aux États-Unis a révélé que l’administration de bicarbonate de sodium aux urgences n’était pas associée au délai de résolution de l’acidose chez les patients atteints d’ACD dont le pH était inférieur à 7,0. Il n’y avait pas non plus de différence dans la durée de séjour à l’hôpital.
Deux petits essais randomisés, croisés et monocentriques ont comparé le bicarbonate de sodium à une solution saline dans le traitement de l’acidose lactique. Cooper et al.
ont signalé que l’administration de bicarbonate de sodium augmentait le pH et la PCO2 sans modification de la pression artérielle ou du débit cardiaque. De même, Mathieu et al. ont constaté une augmentation du pH mais aucune modification des paramètres hémodynamiques, y compris de l’index cardiaque.
En cas d’arrêt cardiaque, plusieurs études d’observation ont signalé une augmentation du taux de retour à la circulation spontanée chez les patients recevant du bicarbonate de sodium. Mais, une étude a montré que ce traitement était associé à un taux de survie et à des résultats neurologiques moins bons jusqu’à la sortie de l’hôpital. Un essai pilote randomisé n’a montré aucune amélioration de la mortalité des patients, du taux de retour à la circulation spontanée ou d’un bon état neurologique chez ces patients traités. Actuellement, l’utilisation systématique du bicarbonate de sodium n’est pas recommandée pour la réanimation cardio-pulmonaire.
Traitement de substitution rénale de l’acidose métabolique
Il n’y a pas de consensus clair sur les indications cliniques de l’EER (épuration extra-rénale) ; cependant, l’acidose sévère est une indication communément acceptée. Dans les essais randomisés portant sur le choix du moment de l’EER, à savoir l’essai AKIKI, l’essai IDEAL-ICU et l’essai STARRT-AKI, l’acidose métabolique avec acidémie sévère a été retenue comme l’une des indications absolues.
L’essai AKIKI est un essai randomisé multicentrique français, qui a inclus des patients atteints d’IRA de stade 3, dont 67 % présentaient un choc septique. L’essai a comparé l’initiation précoce de l’EER au stade 3 de l’IRA et l’initiation retardée avec des indications absolues. Les indications absolues pour l’EER comprenaient une acidémie sévère avec un pH < 7,15, soit une acidose métabolique ou une acidose mixte. Il convient de noter que 21 % des participants à l’essai dans le groupe témoin ont reçu une EER pour une acidose métabolique.
L’essai IDEAL-ICU est un autre essai randomisé multicentrique français qui a inclus des patients présentant un choc septique et une IRA de stade 3. Les indications absolues de l’EER comprenaient l’acidose métabolique avec un pH < 7,15 et un déficit en bases > 5 mEq/l ou HCO3- < 18 mEq/l. Parmi les patients qui ont reçu une EER pour l’indication absolue, 13,4 % répondaient aux critères d’acidose métabolique.
L’essai STARRT-AKI est le plus grand essai randomisé international, incluant 3 019 patients de 15 pays. L’objectif principal était d’évaluer si une stratégie accélérée de mise en route d’une EER au stade 2 ou 3 de l’IRA améliorerait les résultats centrés sur le patient par rapport à une mise en route différée avec des indications absolues. Les indications absolues de l’EER comprenaient l’acidémie sévère et l’acidose métabolique, définies par un pH ≤ 7,2 ou une HCO3- < 12 mmol/l. Parmi les patients traités par EER, 16,6 % répondaient aux critères d’acidose métabolique sévère.
D’après l’essai STARRT-AKI et l’essai BICAR-ICU, il faut pour les patients atteints d’IRA de stade 2 ou 3 éviter un recours immédiat à l’EER mais ils peuvent bénéficier de l’administration de bicarbonate de sodium si une acidose métabolique sévère est présente malgré le traitement approprié des affections sous-jacentes.
Conclusion
L’acidose métabolique est fréquente dans les services de soins critiques et même une acidose métabolique modérée entraîne une mortalité plus élevée qu’une septicémie grave. Le bicarbonate de sodium ou l’EER sont utilisés occasionnellement pour corriger le déséquilibre acido-basique dû à l’acidose métabolique ; en dépit de peu de preuves de haute qualité. Les patients présentant une acidose métabolique sévère et une IRA de stade 2 ou 3 pourraient constituer une population cible possible pour l’administration de bicarbonate de sodium. D’autres essais cliniques sont nécessaires pour fournir des informations plus solides dans une population de patients cliniquement pertinente.
Dr Bernard-Alex Gaüzère
Référence
Yagi, K., Fujii, T. : Management of acute metabolic acidosis in the ICU : sodium bicarbonate and renal replacement therapy. Crit Care , 2021 ; 25, 314. doi.org/10.1186/s13054-021-03677-4
Source jim.fr
— -
Arnaud BASSEZ
IADE/Formateur AFGSU
Administrateur