Cliquez sur les images pour les agrandir
Il ne respire plus...il est mort !
Cette remarque nous est très familière. On associe souvent la vie à la respiration ; ne dit-on pas, par exemple : " un souffle de vie". On reconnaît instinctivement que la vie est associée à l’air que l’on respire et que d’en manquer, conduit inévitablement à la mort.
Comment cette affirmation se transpose-t-elle en termes biologiques ?
Le maintien de l’homéostasie implique une composition adéquate du sang qui implique à son tour que ce dernier soit en relation avec l’environnement externe de l’organisme. Or, nous savons que le système cardiovasculaire n’est pas en relation directe avec l’environnement externe. Par ailleurs, certains organes comme les poumons, les reins et les organes du système digestif le sont.
Parmi les besoins physiologiques de l’organisme, nous retrouvons le besoin en oxygène (O2) et le besoin d’éliminer un déchet, en l’occurrence, le gaz carbonique (CO2). Le besoin en oxygène découle du fait que les cellules humaines tirent leur énergie (ATP) de réactions de combustion au cours desquelles la transformation maximale de l’énergie chimique contenue dans les molécules combustibles (glucose, acides gras) ne se réalise qu’en présence d’oxygène. De plus, cette transformation conduit à la production d’un déchet gazeux, le gaz carbonique. C’est donc dire que la transformation de l’énergie par les cellules dépend entre autre du maintien de conditions aérobiques adéquates du milieu interstitiel et de l’élimination continuelle du CO2 produit par les cellules de ce même environnement extracellulaire.
L’air atmosphérique représente à la fois la source de l’O2 et l’endroit où s’élimine le CO2. Comme la majorité des cellules sont enfouies au sein de l’organisme et, par le fait même, sans accès direct sur l’environnement externe (air atmosphérique), on peut comprendre la nécessité de la présence de systèmes anatomiques particuliers qui permettent d’établir le contact entre les différentes cellules et l’air atmosphérique.
Ces systèmes sont le système respiratoire et le système cardio-vasculaire.
La respiration correspond donc à la fonction physiologique qui implique les poumons, les capillaires sanguins ainsi que le cœur et qui permet de maintenir la composition adéquate du sang en oxygène (O2) et en gaz carbonique (CO2). La fonction respiratoire permet donc de satisfaire les besoins physiologiques d’oxygène et d’excrétion de certains déchets fabriqués par nos cellules. De plus, le système respiratoire participe au maintien du pH sanguin. Sans correspondre à l’un des six besoins physiologiques, nous verrons que le maintien de la concentration des ions H+ dans le sang correspond à une variable importante qu’il faut maintenir pour assurer le travail des enzymes cellulaires.
En fait, le système respiratoire constitue une entrée dans l’organisme, pour l’oxygène, et une sortie de l’organisme, pour le CO2, ce qui permet aux capillaires des poumons (l’environnement interne) de communiquer avec son environnement externe (air de l’atmosphère). Dans ce contexte, l’organisation anatomique et fonctionnelle du système respiratoire vise essentiellement à permettre l’entrée d’air frais contenant l’oxygène jusqu’aux poumons, à assurer les échanges gazeux entre les poumons et le sang et à permettre la sortie de l’air vicié contenant le gaz carbonique ; le système cardio-vasculaire assure quant à lui le transport des gaz entre les poumons et les cellules et vice versa, ceci par l’intermédiaire du sang.
En fonction de ce qui vient d’être dit, on peut dire que :
- Le processus de la respiration est un phénomène biologique intégré qui peut, pour fins d’étude, se diviser en plusieurs étapes :
- Le mouvement de l’air entrant et sortant des voies respiratoires
- Les échanges d’O2 et de CO2 entre les poumons et le sang au niveau des capillaires pulmonaires
- Le transport de l’O2 dans le sang à toutes les cellules de l’organisme et le retour du CO2 vers les poumons
- Les échanges d’O2 et de CO2 entre le sang, le milieu interstitiel et les cellules et vice versa
- L’utilisation de l’O2 et la production du CO2 lors de la production d’énergie par la cellule.
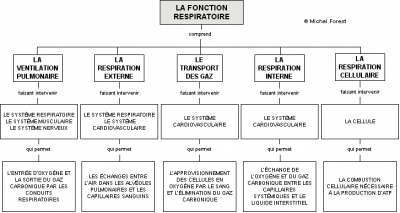
La fonction respiratoire
La majorité des gens pense que la fonction respiratoire implique seulement l’entrée de l’air dans le système respiratoire. Cette attribution est facilement compréhensible, mais elle n’est pas tout à fait exacte. En fait, la fonction respiratoire peut être divisée en 5 étapes.
La première étape correspond à la ventilation pulmonaire ou à l’entrée de l’air dans les conduits et les alvéoles pulmonaires. La ventilation pulmonaire correspond à un débit de gaz, c’est-à-dire au volume de gaz qui entre dans les poumons par unité de temps. Ce débit s’ajuste selon les besoins en approvisionnement en oxygène et en excrétion du CO2 des cellules par rapport aux différentes situations. Cette définition du débit correspond à la même définition que nous avons donné du débit cardiaque sauf qu’elle s’applique au déplacement de l’air plutôt qu’au déplacement du sang. Tout comme le débit cardiaque, le débit respiratoire dépend d’un contrôle nerveux.
La deuxième étape correspond à la respiration externe. Cette étape correspond aux échanges d’O2 et de CO2 entre les alvéoles pulmonaires et le sang des capillaires pulmonaires. Le sang qui arrive du ventricule droit passe dans les capillaires alvéolaires afin de relâcher le CO2 et de prendre l’O2. Après ces échanges, le sang emprunte les veines pulmonaires afin de rejoindre le ventricule gauche. La contraction de ce ventricule permet alors d’éjecter le sang oxygéné dans l’aorte et, par conséquent, vers les capillaires systémiques.
Le transport des gaz constitue la troisième étape de la fonction respiratoire et ne dépend que de la fonction cardiovasculaire. Elle implique donc le cœur, qui génère la pression artérielle, l’hémoglobine des globules rouges qui fixe et transporte l’oxygène et les vaisseaux qui acheminent le sang vers les capillaires systémiques où se font les échanges avec le compartiment interstitiel. Nous reviendrons sur le transport du CO2 qui est principalement assumé par le plasma sanguin et non par l’hémoglobine des globules rouges.
La quatrième étape, la respiration interne implique aussi des échanges capillaires d’O2 et de CO2. Par contre, elle se différencie de la respiration externe dans le sens qu’elle implique des échanges dans l’environnement interne, c’est-à-dire du compartiment vasculaire vers le compartiment interstitiel. Nous savons que ces échanges gazeux entre le compartiment vasculaire et le compartiment interstitiel se font par diffusion simple parce que l’oxygène et le CO2 sont solubles dans les phospholipides. Cette étape dépend du débit sanguin dans les capillaires vrais des organes et, par conséquent, de la pression artérielle systolique ainsi que de la vasomotricité des artérioles. Il importe de réaliser que les volumes de gaz échangés entre les deux compartiments dépendent directement du volume de sang qui passe dans les capillaires des tissus et que les contrôles intrinsèque et extrinsèque du débit peuvent grandement influencer ces échanges.
La dernière étape fait référence à la respiration cellulaire. La fonction cellulaire dépend de la présence d’ATP. De plus, l’énergie potentielle, libérée par la dégradation des combustibles, sert à la synthèse des ATP dans les mitochondries et ces réactions nécessitent la présence d’oxygène dans ces dernières. L’ensemble des réactions biochimiques mitochondriales qui sont responsables de la formation des ATP sont appelées "les réactions de la chaîne respiratoire mitochondriale". Les réactions cataboliques de dégradation sont aussi responsables de la formation du CO2 car ces réactions enzymatiques dégradent les combustibles organiques (composées principalement de carbone) jusqu’à l’obtention de ce gaz.
La respiration et la fonction respiratoire ne sont donc pas des synonymes. La respiration, telle que la majorité des individus la conçoivent, correspond à la première étape de la fonction respiratoire, c’est-à-dire à la ventilation pulmonaire. La fonction respiratoire comprend tous les processus physiologiques qui participent au maintien de la composition adéquate du sang, du liquide interstitiel, du cytoplasme cellulaire en oxygène et en CO2 ainsi que les processus biochimiques qui impliquent l’utilisation de l’oxygène par les mitochondries et la fabrication des molécules d’ATP.
La finalité de la fonction respiratoire est donc d’assurer la composition adéquate du cytoplasme cellulaire en oxygène et en CO2 afin que les cellules produisent les ATP nécessaires à leur participation dans le maintien de l’homéostasie.
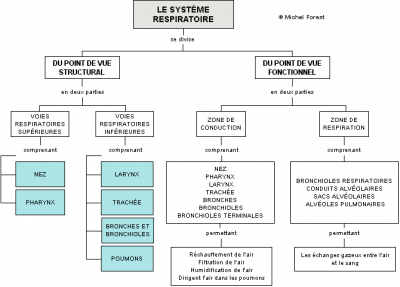
– Organisation anatomique du système respiratoire
Par analogie, on peut se représenter l’aspect général du système respiratoire comme un arbre dont le tronc se ramifie en branches de plus en plus petites lesquelles se terminent par des feuilles. L’arbre bronchique est constitué d’un conduit droit qui se ramifie progressivement au fur et à mesure que l’on descend dans les poumons.
L’organisation anatomique du système respiratoire est donc relativement simple. Du point de vue fonctionnel, les voies respiratoires, constituées essentiellement de tubes droits, dont plusieurs sont maintenus ouverts par des anneaux cartilagineux, offrent peu de résistance à l’écoulement de l’air et permettent la libre circulation de l’air. Un peu comme les vaisseaux capillaires, les nombreuses ramifications qui se terminent par les alvéoles respiratoires permettent d’augmenter la surface d’échange des gaz entre l’air alvéolaire et le sang des capillaires.
On évalue chez l’humain que la surface totale des alvéoles pulmonaires en contact avec les capillaires pulmonaires serait l’équivalent de la surface d’un terrain de tennis. Il s’agit là d’une organisation très efficace pour les échanges entre l’air et le sang afin de maintenir la composition adéquate du sang.
La courbe de dissociation de l’hémoglobine expliquée (pour ceux qui auraient oublié)
– Le traitement de l’air par la muqueuse
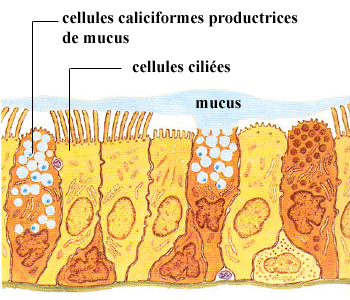
Tout l’intérieur des conduits du système respiratoire est tapissé par la muqueuse respiratoire composée de cellules épithéliales.
(Adapté de la collection d’illustrations médicales CIBA)
Cette muqueuse est essentiellement responsable du traitement de l’air inspiré. Il est nécessaire que cette muqueuse, seul tissu de la paroi bronchique en contact avec l’air inspiré, soit équipée de façon à traiter adéquatement cet air inspiré qui est plus froid que la température corporelle et qui contient des poussières et des microorganismes qui ne doivent pas entrer dans notre environnement interne.
Ce traitement de l’air inspiré implique
- une hydratation à 100%
- un réchauffement à la température du corps
- une filtration des poussières et des microorganismes contenus dans l’air.
Sous ces conditions essentielles, les échanges gazeux au niveau pulmonaire seront efficaces et les microorganismes ne pourront pas atteindre les alvéoles pulmonaires et causer une infection. Les équipements anatomiques impliqués dans le traitement de l’air sont présents tout le long de l’arbre respiratoire mais diffèrent selon que l’on soit dans les voies respiratoires supérieures ou dans les voies respiratoires inférieures.
Étant donné la position stratégique du nez au début du système respiratoire, celui-ci intervient de façon majeure dans le traitement de l’air atmosphérique. Grâce à la présence de poils sur les rebords externes des narines, la majorité des grosses poussières inhalées sont stoppées et filtrées. De plus, la muqueuse est pourvue de nombreuses glandes dont les cellules produisent du mucus qui, un peu à la manière d’un papier tue-mouches, englue et agglomère les poussières et les microorganismes. De petits cils recouvrent la surface des cellules épithéliales de la muqueuse nasale ; leur battement incessant et coordonné dirige le mucus et les microorganismes vers le nasopharynx (gorge) où son accumulation déclenche le réflexe de déglutition et son élimination vers l’estomac. En plus de cette fonction de protection, la présence de ce mucus, contenant de l’eau comme solvant, assure en même temps une certaine humidification de l’air inspiré.
La muqueuse nasale est également richement vascularisée par des capillaires. Ces vaisseaux sanguins dégagent de la chaleur en provenance du sang chaud qui y circule (37°C) et de la vapeur d’eau permettant ainsi au nez de réchauffer et d’humidifier l’air inspiré. Ainsi, l’air inspiré par le nez sera hydraté à 100% lors de son entrée dans la trachée. On sait tous qu’il nous est possible de respirer par la bouche : par ailleurs, cette habitude ne permet pas une hydratation à 100% de l’air tant que celui-ci n’est pas rendu au niveau des voies respiratoires inférieures. Cette situation entraîne un dessèchement de la trachée et des bronches et une diminution de l’efficacité de la filtration mucociliée. On remarque donc généralement chez les personnes qui ont cette habitude une plus grande fragilité aux irritations de la gorge et un risque d’infection plus élevé vue la stagnation plus longue des microorganismes dans les voies irritées.
Vue la position du nez très exposée aux coups et à cause de sa riche vascularisation, on peut maintenant comprendre l’apparition des saignements de nez. Il semble que chez certains individus plusieurs facteurs tels que le stress, la fatigue et certaines émotions fragilisent les capillaires du nez et les font éclater, ce qui entraîne ainsi un saignement.
Au niveau du pharynx, du larynx, de la trachée et des bronches, la présence de cellules ciliées et de mucus assure le traitement de l’air. Le mucus capte les poussières et les microorganismes alors que le mouvement des cils entraîne ces corps étrangers vers le pharynx. Cet escalier mucocilié représente en fait la principale défense naturelle des poumons contre les microorganismes et les particules inhalées. Lorsqu’ils sont englués, la majorité des microorganismes sont détruits par des anticorps sécrétés entre autre par les amygdales dans le mucus et/ou sont évacués hors de l’organisme par des procédés tels que la toux et les éternuements.
Au fur et à mesure que l’on descend dans l’arbre bronchique, c’est-à-dire des bronches vers les bronchioles terminales, le mucus et les cellules ciliées disparaissent. Cette disparition est suppléée par l’apparition progressive de macrophages qui sont des cellules phagocytaires intercalées parmi les cellules épithéliales de la muqueuse. On retrouve aussi plusieurs de ces macrophages dans les alvéoles. Ainsi, toutes les particules inhalées, microorganismes y compris, qui parcourent les conduits et atteignent les alvéoles ne peuvent être éliminées à ce niveau que par la phagocytose des macrophages. Ces macrophages pulmonaires sont munis de pseudopodes et sont donc capables de se déplacer par la suite vers les bronches, s’intégrer au mucus et être éventuellement expulsés vers le pharynx. D’autre part, ces macrophages peuvent aussi se diriger vers les capillaires lymphatiques du tissu pulmonaire et atteindre un ganglion lymphatique. À cet effet, on a noté dans le cas de certains travailleurs, l’accumulation permanente dans leurs ganglions lymphatiques de la région pulmonaire des amas de particules phagocytées comme de la suie ou de la silice.
Le système lymphatique est un réseau vasculaire parallèle au réseau vasculaire du système cardiovasculaire. Ce réseau lymphatique parcourt l’ensemble des organes (sauf le cerveau) du corps et recueille la lymphe dans ses innombrables capillaires. Dans les ganglions lymphatiques que l’on retrouve sur le parcours des vaisseaux lymphatiques, il y a des lymphocytes qui produisent des anticorps lorsqu’ils sont stimulés par un antigène. L’anticorps est fabriqué spécifiquement pour l’antigène ou contre les microorganismes ingérés et transportés par les macrophages. Au niveau pulmonaire, ces anticorps formés au niveau des ganglions lymphatiques pulmonaires peuvent rejoindre la muqueuse respiratoire via la circulation sanguine dans les capillaires, se mélanger au mucus et ainsi détruire les microorganismes qui s’y trouvent. Cette réaction de notre système de défense spécifique nous permet de nous défendre contre les microorganismes présents dans l’air inspiré. Une protection spécifique antimicrobienne est ainsi installée.
L’ensemble des procédés qui permettent le traitement de l’air vise à éviter toute souillure des poumons ; ces mécanismes représentent donc un des moyens de défense de l’organisme contre l’infection microbienne, ceci en autant qu’ils soient efficaces et en bonnes conditions d’opération. Certains gros fumeurs, par exemple, voient leurs voies respiratoires salies par de nombreux produits provenant de la cigarette. Il s’en suit souvent d’une part, une paralysie voire la destruction des cils, n’étant plus en mesure de remplir leur fonction de filtration et, d’autre part, une stimulation excessive de mucus protecteur qui peut à la limite obstruer les voies respiratoires en stagnant sur place et ainsi diminuer la circulation de l’air. Plus gravement, les cellules phagocytaires des alvéoles peuvent aussi être altérées par la fumée de sorte que les poumons se retrouvent dans une situation précaire et très susceptibles d’être envahis par les microorganismes.
(poumon de fumeur)
La dégénérescence de la paroi des alvéoles et son remplacement par du tissu cicatriciel entraînent une grande perte de l’élasticité du tissu pulmonaire ; les alvéoles s’affaissent et ne peuvent que très difficilement se dilater. Très souvent, cette situation dégénère et entraîne l’apparition d’une maladie respiratoire chronique.
– La ventilation pulmonaire
L’objectif premier de la respiration est de satisfaire deux besoins physiologiques fondamentaux, soient
- celui de procurer l’oxygène nécessaire aux cellules et
- celui d’éliminer le gaz carbonique produit au cours du catabolisme cellulaire.
On peut diviser ce processus en cinq étapes : la ventilation pulmonaire, la respiration externe, le transport des gaz, la respiration interne et la respiration cellulaire
L’étude de l’anatomie du système respiratoire permet de constater que les voies d’entrée et de sortie sont les mêmes et que les poumons sont en fait un cul-de-sac. Cette organisation implique donc une différence importante entre le processus responsable de l’entrée de l’air et celui responsable de la sortie.
La ventilation pulmonaire correspond aux processus par lesquels s’effectuent le déplacement de l’air atmosphérique de l’environnement externe vers les alvéoles pulmonaires et des alvéoles vers l’air atmosphérique.
Donc, ce sont deux processus mécaniques distincts qui sont à l’origine du va-et-vient de l’air à travers le circuit de conduits respiratoires. Ces deux processus de la ventilation pulmonaire correspondent respectivement à l’inspiration et l’expiration.
– L’inspiration
L’inspiration est un processus qui fait augmenter le volume des alvéoles pulmonaires. C’est grâce à cette augmentation de volume que l’air pénètre dans les poumons.
« Est-ce que les poumons gonflent parce que l’air y pénètre ou est-ce que l’air pénètre dans les poumons parce qu’ils gonflent ? »
Pour répondre à cette question, jetons un coup d’œil sur ce qui suit :
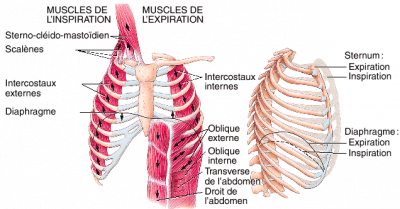
1°) L’initiation des mouvements inspiratoires de la ventilation pulmonaire se fait par une stimulation provenant d’un centre d’intégration nerveux situé dans le bulbe rachidien. Ce centre possède des neurones inspiratoires qui envoient des influx nerveux, à une certaine fréquence, à des muscles situés entre les côtes de la cage thoracique, les muscles intercostaux externes.
2°) Ces influx nerveux sont également acheminés vers le diaphragme, un autre muscle squelettique, qui sépare la cavité thoracique de la cavité abdominale.
3°) Sous l’action de ces influx nerveux inspiratoires, les muscles squelettiques intercostaux externes se contractent et les côtes sont tirées vers le haut.
4°) Cette élévation des côtes a pour effet d’augmenter le diamètre de la cage thoracique et, par conséquent, le volume interne de cette dernière.
5°) Le diaphragme ayant une forme de dôme, sa contraction implique un déplacement vers le bas provoquant une compression des organes de la cavité abdominale ainsi qu’une augmentation du volume interne de la cage thoracique.
En étudiant l’anatomie des poumons on sait que le feuillet viscéral de la plèvre (poumon) adhère au feuillet pariétal (cage thoracique) par l’intermédiaire du liquide pleural. Les poumons sont donc “attachés” à la cage thoracique de telle sorte que tout mouvement de cette dernière entraîne aussi le mouvement des poumons dans le même sens. L’augmentation du volume interne de la cage thoracique implique donc une augmentation du volume des poumons et, par conséquent, du volume des alvéoles pulmonaires.
L’inspiration est donc considérée comme un processus actif parce qu’elle implique la contraction de plusieurs muscles squelettiques, soient les muscles intercostaux externes et le diaphragme.
« Et alors, pourquoi, si les poumons augmentent de volume, l’air peut-il y entrer ? »
Le déplacement de l’air répond à la même loi que nous avons étudiée dans le processus de diffusion, à savoir que
les molécules se déplacent d’un endroit où il y en a beaucoup vers un endroit où il y en a moins.
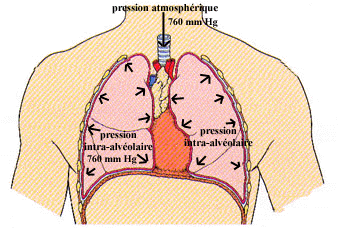
Ainsi, lors de la diffusion, afin de déterminer le déplacement des molécules entre 2 milieux, on tenait compte du gradient de concentration. En ce qui concerne le déplacement de l’air lors de la ventilation pulmonaire, nous tiendrons compte du gradient de pression entre la pression atmosphérique (la pression exercée par l’air autour de l’organisme) et la pression intra-alvéolaire (la pression à l’intérieur des poumons).
(Tiré de Elaine T. Marieb aux éditions ERPI)
Les voies respiratoires inférieures et les alvéoles communiquent avec l’atmosphère par la trachée. Au repos, c’est-à-dire entre une expiration et une inspiration, la pression intra-alvéolaire est en équilibre avec la pression atmosphérique. Au niveau de la mer, la pression atmosphérique est généralement de 760 mm Hg ou 101,325 kPa (kiloPascal). C’est une moyenne qui demeure relativement constante.
Au repos, la pression intra-alvéolaire s’égalise toujours avec la pression atmosphérique de telle sorte que les deux pressions sont identiques et, par conséquent, la variation de pression est égal à 0. C’est pourquoi il n’y a pas de mouvement d’air vers l’intérieur des poumons.
Lors de notre étude du système cardiovasculaire nous avons expliqué que le sang circulait toujours d’une zone de forte pression vers une zone de faible pression permettant à ce dernier de circuler du ventricule gauche, où la pression est de 120 mm de Hg, vers le ventricule droit, où la pression est d’environ 3 mm de Hg. Pour que l’air puisse entrer dans les poumons, il faudra donc créer un gradient de pression entre l’air atmosphérique et l’air alvéolaire, les gaz circulants d’une zone de forte pression vers une zone de faible pression.
En écoutant les nouvelles de la météo, on entend souvent parler de zones de basses et de zones de hautes pressions et des déplacements de l’air selon des points de haute pression vers des points de basse pression. Que l’on parle du processus inspiratoire ou de la météo, le déplacement de l’air obéit à la même loi. Le déplacement d’un volume d’air de l’atmosphère vers les alvéoles pulmonaires est proportionnel à la différence de pression entre ces deux points.
On peut donc dire que plus la différence de pression sera grande, plus le volume d’air déplacé de l’air atmosphérique vers les alvéoles sera important.
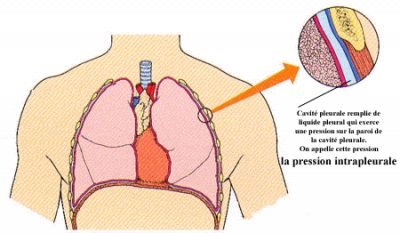
Une autre pression doit par contre être prise en considération, c’est la pression intrapleurale. La pression intrapleurale est la pression qui existe dans la cavité pleurale, c’est-à-dire entre les feuillets de la plèvre qui entourent chacun des poumons. Elle est due à la pression que le liquide pleural présent dans la cavité pleurale exerce sur les plèvres. Au repos, cette pression intrapleurale est égale à 756 mm Hg. Elle est donc inférieure à la pression intra-alvéolaire.
(Tiré de Elaine T. Marieb aux éditions ERPI)
Ainsi, la pression intra-alvéolaire étant supérieure, l’air pousse la paroi des alvéoles vers le tissu conjonctif du poumon créant une légère distension de celles-ci lorsqu’un individu ne fait aucun mouvement respiratoire. Cette distension des alvéoles facilite l’entrée de l’air dans les poumons lors de l’inspiration.
Ainsi donc, l’augmentation du volume interne de la cage thoracique implique une augmentation du volume des poumons et, par conséquent, du volume des alvéoles pulmonaires.
En fonction de la loi de Boyle qui dit :
"La pression d’un gaz dans un contenant fermé est inversement proportionnelle au volume du contenant".
On comprend alors que cette augmentation du volume interne des alvéoles lors de l’inspiration amène une diminution de la pression intra-alvéolaire. Cette diminution de la pression intra-alvéolaire crée alors un gradient de pression entre l’air atmosphérique et l’air alvéolaire. La pression de l’air atmosphérique étant plus élevée que la pression intra-alvéolaire, l’air atmosphérique pénètre dans les voies respiratoires. La différence entre les pressions est de l’ordre de 1 à 2 mm Hg ce qui n’est pas énorme mais amplement suffisant pour faire entrer en moyenne 500 ml d’air dans les poumons lors d’une seule inspiration. L’inspiration cesse lorsque la contraction des muscles inspiratoires arrête et que la pression intra-alvéolaire devient égale à la pression atmosphérique.
– L’expiration
L’expiration est le processus qui consiste à expulser l’air contenant le CO2 des alvéoles pulmonaires et, par conséquent, il est toujours consécutif à l’inspiration. En fait, l’expiration est secondaire au relâchement des muscles intercostaux externes et du diaphragme à l’origine du processus inspiratoire. C’est pourquoi on considère l’expiration comme un processus passif par comparaison au processus inspiratoire.
Après un certain temps, les neurones inspiratoires du centre nerveux cessent d’envoyer des influx nerveux aux muscles inspiratoires. Il en résulte un relâchement musculaire. Les côtes s’abaissent, le diaphragme se soulève et la cage thoracique retrouve progressivement son volume original. Le relâchement des muscles inspiratoires implique que la force qui tirait les poumons vers l’extérieur n’existe plus et les fibres élastiques étirées du tissu pulmonaire tendent à revenir à leur position initiale. La relaxation musculaire entraîne donc la réduction du volume de la cage thoracique alors que l’action des fibres élastiques du tissu pulmonaire implique une diminution du volume des poumons qui reprennent leur volume original.
En fonction de la loi de Boyle, la diminution du volume des poumons et, par conséquent, des alvéoles entraîne l’augmentation de la pression intra-alvéolaire créant un nouveau gradient de pression, mais cette fois-ci, inversé dans le sens où la pression intra-alvéolaire devient supérieure à la pression atmosphérique. Dans ces circonstances, l’air alvéolaire contenant le CO2 se déplace des alvéoles vers l’atmosphère. La différence entre les deux pressions est suffisante pour faire sortir environ 500 ml d’air des poumons, c’est-à-dire le même volume qui était entré lors de l’inspiration. La sortie de l’air s’arrête lorsque le pression de l’air alvéolaire est égale à la pression de l’air atmosphérique.
En résumé, l’inspiration et l’expiration se passent de la façon suivante :
– Les volumes et les capacités respiratoires
Dans notre étude sur le système cardiovasculaire nous avons discuté de l’importance de maintenir la pression artérielle systolique normale afin de maintenir un débit sanguin au niveau des capillaires vrais de tous les tissus compatibles avec les échanges entre le compartiment vasculaire et le compartiment interstitiel. Lors de cette étude, nous avons défini le débit du ventricule gauche comme le volume de sang qui est éjecté de ce ventricule par minute. En utilisant l’équation suivante afin de calculer le débit (Q) ventriculaire, nous avons établi la relation entre le volume d’éjection systolique et la fréquence cardiaque.
- Q = volume d’éjection systolique X fréquence cardiaque
Nous pouvons appliquer cette notion de débit au système respiratoire afin de voir comment les muscles squelettiques reliés à l’inspiration ainsi qu’à l’expiration peuvent contribuer à modifier le débit ventilatoire. Nous savons que la composition adéquate du sang en oxygène et en gaz carbonique constitue une condition essentielle à la production d’énergie par les cellules. Nous savons également que la production d’énergie varie selon les activités de la cellule. Il devient donc primordial de pouvoir accorder le débit de la ventilation pulmonaire avec les besoins de la cellule.
L’équation suivante présente la relation entre les deux paramètres qui peuvent influencer le débit de la ventilation pulmonaire ou le volume d’air atmosphérique qui entre et qui sort des poumons par minute. On représente généralement le débit de la ventilation par la lettre Q.
- Q = volume inspiratoire X fréquence respiratoire
Le premier paramètre correspond au volume inspiratoire, c’est-à-dire le volume d’air inspiré lors d’un mouvement inspiratoire. Il dépend de la durée des influx stimulant la contraction des muscles inspiratoires lors de l’inspiration. Le volume inspiratoire est l’équivalent du volume d’éjection systolique. La fréquence respiratoire, ou le nombre d’inspirations par minute, dépend du nombre des influx nerveux envoyés par le centre de contrôle de l’inspiration durant une minute. La fréquence respiratoire est l’équivalent de la fréquence cardiaque.
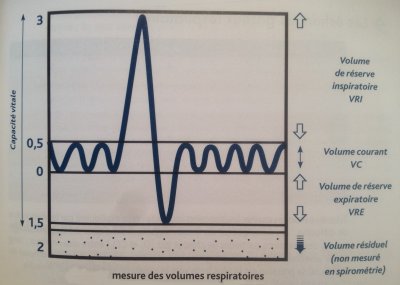
Il peut être utile, dans certaines occasions, de mesurer de façon précise certains volumes respiratoires afin de vérifier l’efficacité du processus de la ventilation pulmonaire. Pour obtenir ces mesures, nous utilisons un appareil nommé spiromètre.
Le spiromètre est un enregistreur à circuit fermé consistant en une cloche équilibrée par un contrepoids capable de se déplacer verticalement. La cloche plonge dans une cuve remplie d’eau de telle sorte qu’elle forme un réservoir d’air de volume variable. Les variations de volume sont enregistrées par une plume sur un papier qui tourne sur un cylindre de métal. Il s’agit de constituer un circuit fermé de circulation d’O2.
D’abord, on pince le nez de l’utilisateur afin de ne pas faire entrer ni sortir d’air par le nez. Puis, on met une pièce buccale dans la bouche à l’aide de laquelle on peut respirer. De cette façon, l’O2 contenu dans les poumons, dans les tubes et dans le spiromètre constituera le système en circuit fermé. Ainsi, quand le volume des poumons augmentera au cours d’une inspiration, le volume de l’O2 diminue dans le spiromètre ce qui fait alors baisser la cloche et quand le volume des poumons diminue au cours d’une expiration, le volume de l’O2 augmente dans le spiromètre et la cloche monte. Ces mouvements de la cloche actionnent une plume qui trace alors, sur un papier installé sur un cylindre qui tourne à une vitesse fixe, un tracé qui permettra de mesurer différents volumes respiratoires.
On introduit dans ce système un absorbant à CO2. Ce dernier empêche l’accumulation du CO2 qui pourrait produire une asphyxie progressive de l’individu. De cette façon, lors des mouvements respiratoires, le CO2 expiré est absorbé et le contenu en O2 du système est progressivement éliminé par les inspirations.
– Le volume de réserve inspiratoire
Par exemple, si lors d’un exercice moyen un individu maintient son volume courant à 500 ml mais qu’il augmente sa fréquence à 24 inspirations par minute, son débit ventilatoire passera de 6 litres/minute à 12 litres/minute. Il est aussi possible de faire varier le volume d’air qui pénètre dans les poumons lors d’une inspiration en augmentant la force de contraction des muscles inspiratoires et en utilisant certains muscles accessoires. Nous parlons alors de la respiration forcée.
Lors d’une inspiration forcée la contraction des muscles inspiratoires accessoires comme les sterno-cléido-mastoïdiens et les scalènes entraîne la cage thoracique vers le haut entraînant une plus grande extension des poumons que lors d’une inspiration normale.
(Tiré de Tortora et Grabowski aux éditions ERPI)
Il faut de se rappeler ici que, d’après la loi de Boyle, la variation de pression est inversement proportionnelle à la variation du volume du contenant. Donc, plus la cage thoracique augmente son volume, plus la pression intra-alvéolaire diminue. Le gradient de pression entre l’air alvéolaire et l’air atmosphérique est alors plus élevé que lors d’une inspiration normale, ce qui permet une entrée d’air qui peut atteindre, dans certains cas, un volume de 3,100 ml (3,1 l).
Ce volume d’air additionnel qui peut entrer dans les poumons est appelé le volume de réserve inspiratoire. Il faut comprendre que ce volume correspond à une capacité du système respiratoire à faire entrer un volume d’air plus important dans les poumons et ne correspond aucunement à un volume d’air qui est toujours dans les poumons.
Les mouvements respiratoires qui impliquent l’entrée ou la sortie de l’air peuvent être normaux ou forcés. L’eupnée correspond à la respiration normale, c’est-à-dire aux mouvements inspiratoires et expiratoires qui permettent l’entrée et la sortie du volume d’air courant (environ 500 ml). Par ailleurs, dans certaines situations, les besoins en oxygène et d’excrétion du CO2 peuvent dépasser les 500 ml d’air atmosphérique du volume courant qui entrent lors de l’inspiration et les 500 ml d’air alvéolaire qui sortent lors de l’expiration. C’est durant ces situations que le centre de contrôle de l’inspiration va adapter ses commandes envoyées aux effecteurs musculaires afin qu’il y ait des respirations forcées. Les mouvements des inspirations et expirations forcées peuvent être perçues comme une adaptation physiologique afin que l’organisme soit en mesure d’adapter l’entrée de l’oxygène et la sortie du CO2 en fonction de l’activité de l’ensemble de ses cellules.
Il faut bien comprendre ici que les inspirations forcées n’impliquent pas toujours l’entrée d’un volume d’air aussi important. Le centre de contrôle bulbaire de l’inspiration va commander une contraction des muscles accessoires proportionnelle au besoin d’augmentation du volume de la cage thoracique en relation avec le besoin d’air. Ainsi, il y a toute une gamme de possibilités entre le volume courant et le volume de réserve inspiratoire maximal de 3,100 ml.
– Le volume courant
L’inspiration est initiée par la décharge de neurones spécialisés situés dans le bulbe rachidien. Ce processus d’inspiration/expiration se répète normalement de 12 à 15 fois par minute. De plus, le nombre de cellules des muscles inspirateurs stimulées par les fibres nerveuses efférentes influence la force de contraction des muscles inspiratoires. Nous pouvons donc affirmer que l’intensité de la contraction des muscles inspiratoires et la fréquence des contractions dépendent du centre de contrôle de la respiration. Ce dernier contrôle donc le débit respiratoire.
Ainsi, lors d’une inspiration normale l’intensité de la contraction des muscles intercostaux et du diaphragme implique la distension des poumons à un volume bien précis. Cette distension occasionne une baisse de la pression intra-alvéolaire particulière permettant le déplacement, en moyenne, de 500 ml d’air de l’environnement externe vers les alvéoles pulmonaires.
Ce volume d’air inspiré lors d’un mouvement normal des muscles inspiratoires correspond au volume courant (volume couramment inspiré).
L’inspiration du volume courant lors d’une inspiration normale dépend donc de l’intensité de la contraction des muscles inspiratoires. Chez un individu au repos, la fréquence respiratoire correspond au nombre d’inspiration par minute, c’est-à-dire 12 inspirations par minute. En plaçant ces chiffres dans l’équation du débit respiratoire nous obtenons, qu’en moyenne, un individu normal respire environ 6,000 ml ou 6 litres d’air atmosphérique par minute.
- Q = volume inspiratoire X fréquence respiratoire soit 6,000 ml = 500 ml X 12 mouvements
Tout comme il est possible de faire varier le débit cardiaque en faisant varier la force de contraction du cœur ou en faisant varier la fréquence des battements cardiaques, il est également possible de faire varier le débit respiratoire en faisant varier la force de contraction des muscles inspiratoires ou en faisant varier la fréquence respiratoire.
– Le volume de réserve expiratoire
Lors d’une expiration forcée, les muscles intercostaux internes ainsi que les muscles abdominaux (muscles obliques et transverses) se contractent. La contraction de ces muscles n’est pas sous le contrôle du centre bulbaire inspiratoire mais plutôt sous le contrôle d’un centre bulbaire expiratoire.
La contraction des muscles intercostaux internes diminue le diamètre de la cage thoracique. La contraction des muscles abdominaux comprime les organes de la cavité abdominale et, plus particulièrement, les organes du système digestif qui remontent vers le haut et poussent sur le diaphragme. Ce mouvement des organes abdominaux vers la cage thoracique a pour conséquence une diminution du volume de la cage thoracique et une compression des poumons. En revenant à la loi de Boyle, cette diminution de volume entraîne obligatoirement une augmentation proportionnelle de la pression de l’air alvéolaire par rapport à la pression atmosphérique. Le gradient de pression étant plus élevé que normalement, la quantité d’air expulsé est beaucoup plus grande qu’au cours d’une expiration normale.
Contrairement à l’expiration normale, l’expiration forcée est donc considérée comme un processus actif, car elle implique la contraction d’effecteurs musculaires squelettiques spécifiques, en l’occurrence, les muscles intercostaux internes et les muscles abdominaux.
Le volume d’air alvéolaire expulsé hors des poumons lors d’une expiration forcée est d’environ 1,200 ml et correspond au volume de réserve expiratoire.
Par ailleurs, le volume de réserve expiratoire correspond à un volume d’air qui reste dans les poumons et non à une possibilité de faire entrer un volume d’air supplémentaire dans les poumons comme c’est le cas pour le volume de réserve inspiratoire.
Ceci revient à dire que le volume de réserve expiratoire de 1,200 ml demeure dans les poumons lors d’une expiration normale (expulsion du volume courant) suivant une inspiration normale.
Un individu peut faire une expiration forcée suite à l’expiration du volume courant. Lors de l’inspiration suivante, il fait alors entrer ce qu’il a expiré lors de son expiration forcée plus le volume courant. Donc, l’inspiration qui suit une expiration forcée fait entrer un volume total qui correspond à la somme du volume de réserve expiratoire (expiration forcée) et du volume courant.
Volume d’air inspiré après une expiration forcée = 1,700 ml
soit : volume de réserve expiratoire (1200 ml)+ volume courant (500 ml)
Autrement dit, un individu qui fait des expirations forcées augmente son débit ventilatoire, car il augmente le volume inspiratoire de l’inspiration qui suit cette expiration forcée. Normalement, le mécanisme de l’expiration forcée est moins important ou, du moins, moins fréquemment utilisé par l’organisme pour augmenter le débit d’air qui entre dans les poumons. Par ailleurs, certains plongeurs et nageurs utilisent ce procédé afin de diminuer la concentration du CO2 sanguin. Cette façon de faire ne sert pas à faire entrer de l’oxygène mais bien à faire sortir du CO2. En étudiant plus tard le mécanisme de contrôle de la respiration nous verrons pourquoi ces individus utilisent couramment ce procédé.
L’inspiration forcée et l’expiration forcée, permettent au système respiratoire de s’adapter aux différents besoins physiologiques de l’ensemble des cellules dans des situations variables. Par exemple, un marathonien qui inspire profondément et utilise complètement sa réserve inspiratoire et la moitié de sa réserve expiratoire voit son volume inspiratoire passer de 500 ml (volume courant) à 4,200 ml. Si sa fréquence respiratoire est de 20 inspirations/minute, son débit ventilatoire est de 84,000 ml/minute ou de 84 litres/minute.
Il faut bien comprendre ici que cette adaptation de la fonction respiratoire est supportée par une adaptation proportionnelle du débit cardiaque et du débit sanguin dans les organes impliqués. Si le débit ventilatoire augmente, il faut augmenter la circulation pulmonaire et, par conséquent, le débit du ventricule droit. Il faut également se rappeler que durant un cycle cardiaque ce sont les deux ventricules qui se contractent en même temps. Donc, en même temps qu’il passe plus de sang dans les capillaires pulmonaires afin que ces derniers se chargent en oxygène et éliminent le CO2 qu’ils transportent, il passe également plus de sang dans les capillaires tissulaires afin d’approvisionner les cellules en oxygène.
– Le volume résiduel
À chaque expiration, même lors d’une expiration forcée, un individu ne peut comprimer sa cage thoracique de façon à expulser tout l’air de ses poumons de telle sorte qu’environ 1,200 ml d’air restent toujours dans les alvéoles et les conduits pulmonaires : c’est le volume résiduel. Ce volume d’air demeure dans les alvéoles à cause de la pression intrapleurale normalement moins élevée que la pression intra-alvéolaire.
NB : le volume résiduel peut augmenter dans les maladies obstructives.
(Tiré de "Premier répondant" aux éditions Mosby Lifeline)
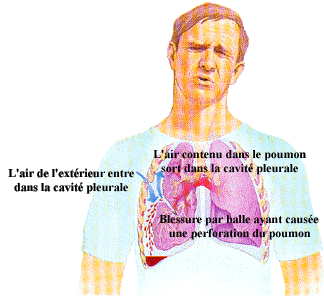
Lors d’un pneumothorax, l’ouverture de la cage thoracique sur l’extérieur provoque une entrée d’air qui équilibre alors la pression intrapleurale avec la pression intra-alvéolaire. C’est la différence de pression entre la pression intrapleurale et la pression intra-alvéolaire qui permet une certaine expansion des poumons. Une fois ces deux pressions équilibrées, les poumons s’affaissent provoquant l’expulsion d’une partie de l’air constituant normalement le volume résiduel. Malgré tout, il demeure un certain volume d’air dans les alvéoles et les voies respiratoires.
Par ailleurs, dans les cas d’emphysème, on observe le contraire, c’est-à-dire que la diminution de l’élasticité du tissu pulmonaire secondaire à une destruction des alvéoles et des fibres élastiques entraînent une difficulté à expulser l’air lors de l’expiration de telle sorte que le volume résiduel augmente anormalement.
– La capacité inspiratoire
La capacité inspiratoire représente la somme du volume courant et du volume de réserve inspiratoire maximal. La capacité inspiratoire d’un individu représente la quantité d’air maximale qui peut entrer dans les deux poumons lors d’une inspiration forcée.
Le mécanisme d’inspiration forcée est un mécanisme d’adaptation par rapport à la satisfaction des besoins physiologiques. Le volume d’air additionnel qu’il permet d’aller chercher correspond à environ 5 à 6 fois le volume courant.
Capacité inspiratoire (3 600 ml) = vol. courant (500 ml) + volume de réserve inspiratoire (3 100 ml)
Ainsi, si nous maintenons la fréquence respiratoire à 12 inspirations / minute et que l’on fait des inspirations forcées, le débit ventilatoire sera :
- Q = volume inspiratoire X fréquence respiratoire
- 43,200 ml/minute = 3,600 ml X 12 mouvements
Sachant le volume d’air qui pénètre dans les poumons lors d’une inspiration forcée peut varier selon les besoins de l’organisme, il faut comprendre ici que la capacité inspiratoire se calcule à partir du volume de réserve inspiratoire maximal.
– La capacité résiduelle fonctionnelle
Correspond à la somme du volume de réserve expiratoire (expiration forcée) et du volume résiduel. Ce volume d’environ 2400 ml correspond à la possibilité qu’a un individu de renouveler l’air qui demeure dans ses poumons lors d’une inspiration et d’une expiration normale.
NB : La capacité résiduelle fonctionnelle peut augmenter dans les troubles obstructifs (bronchopneumonie chronique obstructive) et diminuer dans le syndrome de détresse respiratoire de l’adulte.
– La capacité vitale
Correspond à la quantité maximale d’air pouvant entrer dans les poumons et en sortir lors d’une inspiration forcée suivie d’une expiration forcée. Cette capacité vitale représente la somme de l’air contenu dans la réserve inspiratoire, le volume courant et la réserve expiratoire. Chez les hommes, la capacité vitale est d’environ de 4,800 ml d’air alors que chez la femme, elle est environ de 3,400 ml. Cette différence est due à leur cage thoracique plus petite et à leur capacité pulmonaire plus faible. À noter que la capacité pulmonaire plus faible chez la femme est due au développement moins important de leur musculature squelettique au niveau de la cage thoracique.
NB : On peut constater une diminution de la capacité vitale dans les troubles neuromusculaires, la fatigue corporelle, l’atélectasie (affaissement des poumons), l’œdème pulmonaire et la bronchopneumonie chronique obstructive.
– La capacité pulmonaire totale
Correspond à la somme de la capacité vitale et du volume résiduel qui demeure toujours dans les poumons. En fait, c’est tout le volume d’air que peut contenir un poumon.
NB : La capacité pulmonaire totale peut diminuer dans les troubles restrictifs (atélectasie, pneumonie) et augmenter dans les troubles obstructifs (bronchopneumonie chronique obstructive).
– Facteurs pouvant influencer le débit ventilatoire
Lors de notre étude du système cardiovasculaire nous avons établi que le débit sanguin dans un organe dépend de la pression artérielle systolique ainsi que de la résistance à l’écoulement du sang dans les vaisseaux. De plus, nous avons insisté sur les impacts de la vasomotricité, c’est-à-dire de la vasoconstriction et de la vasodilatation sur la résistance à l’écoulement du sang dans le lit capillaire d’un organe. Lors de cette étude, nous avons utilisé la formule mathématique qui suit afin d’analyser la relation entre le débit cardiaque et la résistance à l’écoulement dans le maintien de la pression artérielle .
- p = q x r
Nous pouvons isoler de cette formule le débit, soit Q = P / R. La même formule s’applique dans le calcul du débit respiratoire où, par contre, la pression se calcule en terme de différence de pression (∆P).
DÉBIT D’AIR = PRESSION / RÉSISTANCE
- q = ∆p / r
Cette relation signifie que le débit d’air (Q) est directement proportionnel à la différence de pression entre l’air atmosphérique et l’air alvéolaire mais inversement proportionnel à la résistance des voies respiratoires par rapport à l’écoulement de l’air. Donc, tous les facteurs qui peuvent influencer le gradient de pression ou la résistance à l’écoulement de l’air dans les voies respiratoires vont influencer le débit de la ventilation alvéolaire et, par conséquent, les échanges gazeux au niveau des alvéoles.
– Les échanges gazeux entre les capillaires et les alvéoles pulmonaires
Nous savons maintenant qu’un individu normal doit inspirer un certain nombre de fois par minute (fréquence respiratoire) et inspirer un certain volume d’air (volume courant) afin que son débit de ventilation alvéolaire corresponde à ses besoins physiologiques en oxygène et en excrétion de CO2. Nous allons maintenant aborder les processus impliqués lors des échanges gazeux entre l’air alvéolaire et le plasma sanguin.
Avant d’aller plus loin, souvenez-vous . . .
À plusieurs reprises nous avons fait référence au principe de la diffusion, un mécanisme de transport passif, c’est-à-dire qui ne requiert aucune dépense d’ATP. Ce principe stipule que les molécules organiques et inorganiques peuvent traverser une membrane cellulaire ou une cellule endothéliale s’il y a un gradient de concentration (différence de concentration) de telle sorte que les échanges vont se faire de la zone ayant une forte concentration moléculaire vers la zone ayant une faible concentration moléculaire. Nous savons que les gaz comme l’oxygène et le CO2 étant solubles dans les lipides, peuvent diffuser librement dans les phospholipides des membranes cytoplasmique cellulaires.
– Les propriétés physiques des gaz
A voir aussi les propriétés physiques des gaz
ou encore
– Le transport des gaz dans les globules rouges et le plasma sanguin
L’oxygène qui pénètre au niveau des poumons est transporté jusqu’aux cellules qui en ont besoin alors que le CO2 que ces mêmes cellules ont produites est transporté jusqu’aux poumons afin d’y être éliminé. On peut facilement comprendre ici qu’il existe un courant où ces deux gaz vont se déplacer simultanément mais en sens inverse.
- Le transport de l’oxygène
Au niveau alvéolaire, la pression partielle de l’oxygène pousse les molécules d’oxygène vers le plasma sanguin. L’oxygène s’y dissout et établit progressivement une pression partielle plasmatique qui finit par s’équilibrer avec la PO2 alvéolaire, soit 105 mmHg.
L’oxygène étant un gaz peu soluble dans le plasma, lorsque les pressions partielles alvéolaire et plasmatique s’égalisent, il y a plus de molécules d’O2 par unité de volume dans l’air que dans le plasma. Autrement dit, à volume égal, le plasma contient beaucoup moins de molécules d’oxygène que l’air.
Dans des conditions normales, 100 ml d’air contiennent 21 ml d’O2 alors que dans les mêmes conditions, 100 ml de plasma n’en contiennent que 0,03 ml.
Cet O2 dissout est transporté par le courant sanguin vers les cellules mais, tout compte fait, cette quantité d’O2 dissout est nettement insuffisante pour satisfaire les besoins cellulaires. Un autre moyen de transport doit donc être envisagé pour combler les besoins cellulaires, et c’est ici qu’interviennent les globules rouges.
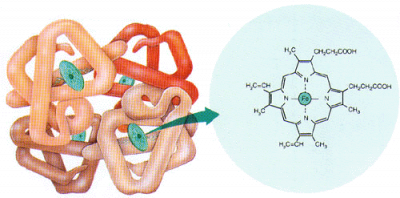
La présence des globules rouges dans le plasma est amplement justifiée par le fait que ces cellules sanguines contiennent une molécule, l’hémoglobine, laquelle est avide d’O2. Lorsque l’O2 pénètre dans le plasma, l’hémoglobine des globules rouges le siphonne littéralement en se liant chimiquement avec pour former de l’oxyhémoglobine.
Hémoglobine + Oxygène = Oxyhémoglobine
- Hb + O2 = HbO2
Les globules rouges prélèvent ainsi l’O2 tant et aussi longtemps que l’hémoglobine peut en capter et arrive à saturation. Dans les faits, l’hémoglobine se sature en O2 en dedans d’une seconde et cette molécule a alors capté assez d’O2 pour que le sang contienne environ 20 ml d’O2 par 100 ml de sang. Grâce aux globules rouges, le plasma peut ainsi transporter une plus grande quantité d’O2 et satisfaire ainsi les besoins cellulaires. Chimiquement, l’O2 se lie au fer contenu dans le groupement hème des molécules d’hémoglobine elles-mêmes contenues dans les globules rouges.
(Tiré de Elaine T. Marieb aus éditions ERPI)
Cette combinaison chimique est facilitée par différents facteurs tels que la présence d’une forte PO2 et d’une faible PCO2, deux facteurs entre autre qui caractérisent très bien le milieu alvéolaire. Il n’est donc pas surprenant de voir que c’est au niveau alvéolaire que l’hémoglobine a le plus d’affinité chimique pour l’oxygène.
Grâce aux globules rouges, la presque totalité de l’O2 en circulation dans le sang est transportée vers les cellules de l’organisme où la situation des pressions partielles est inversée. Les cellules, en consommant l’oxygène présent dans leur milieu interstitiel entraînent l’apparition d’une faible PO2 interstitielle créant ainsi un gradient de concentration entre le milieu interstitiel et le plasma. Il y a alors diffusion de l’oxygène dissout dans le plasma vers le milieu interstitiel ce qui fait diminuer la PO2 plasmatique. La diminution de la PO2 plasmatique entraîne la dissociation de l’oxyhémoglobine : cette réaction chimique de l’oxygène avec l’hémoglobine est donc réversible. L’O2 dissocié de l’oxyhémoglobine quitte le globule rouge, diffuse dans le plasma, puis dans le milieu interstitiel et enfin dans les cellules.
Il faut bien comprendre ici que l’oxygène qui pénètre dans la cellule est celle dissoute dans le sang et que cet oxygène n’est pas suffisante pour satisfaire les besoins physiologiques. Il serait donc intéressant de jeter un coup d’œil sur les différents facteurs qui influencent la dissociation de l’oxyhémoglobine puisque c’est là que se trouve l’oxygène transportée.
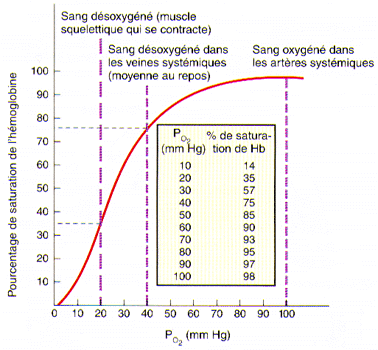
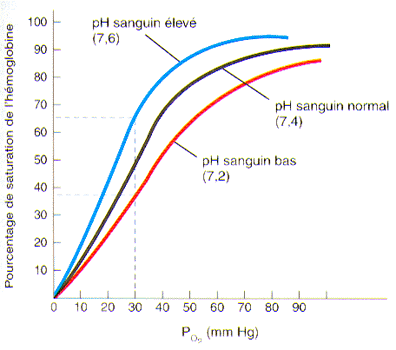
1°) L’effet de la PO2 sur la saturation de l’hémoglobine
Le facteur le plus déterminant de la dissociation de l’oxyhémoglobine est sans aucun doute la pression partielle en oxygène. En effet, plus il y a d’oxygène dans le sang, plus celle-ci pénètre dans le globule rouge et se fixe à l’hémoglobine et, inversement, moins il y a d’oxygène dans le sang, moins il y en a qui se fixe à l’hémoglobine.
(Tiré de Tortora et Grabowski aux éditions ERPI)
Cette figure nous montre le pourcentage de saturation de l’hémoglobine en fonction de la PO2 sanguine. On peut y voir qu’à une PO2 de 40 mmHg, soit celle que l’on retrouve dans le sang veineux à la sortie des tissus, il reste encore près de 75% de l’hémoglobine des globules rouges sous forme d’oxyhémoglobine. Ceci signifie que même après avoir oxygéné les cellules, le sang reste encore suffisamment riche en oxygène pour répondre à une demande rapide d’activité cellulaire. La saturation maximale de l’hémoglobine s’atteint vers les 100 mmHg de PO2.
Ce qui est important de réaliser ici, c’est que même lorsque la PO2 se situe entre 60 et 100 mmHg, l’hémoglobine est saturée à 90% et plus. C’est pourquoi même en altitude et dans certains cas de maladies pulmonaires et cardiaques, où la PO2 dans l’air inspiré est de beaucoup inférieure aux valeurs habituelles, l’approvisionnement aux tissus peut se poursuivre. Aussitôt entré dans la cellule, l’oxygène est immédiatement utilisé dans la mitochondrie afin de faire les combustions nécessaires à la production d’ATP. Il reste toutefois en circulation dans le cytoplasme de la cellule une certaine quantité d’oxygène telle que la PO2 intracellulaire est de 40 mmHg. Aussi, l’oxygène du plasma se dirige-t-elle vers la cellule, la PO2 plasmatique étant plus grande que la PO2 intracellulaire.
Vous remarquerez également que lorsque la PO2 baisse rapidement en-dessous de 40 mmHg, de fortes quantités d’oxygène se détachent de l’hémoglobine. Ceci est particulièrement intéressant dans les cellules en forte activité comme les cellules musculaires lors d’un exercice physique intense par exemple. En effet, tout travail supplémentaire au travail normal entraîne un approvisionnement plus rapide en oxygène.
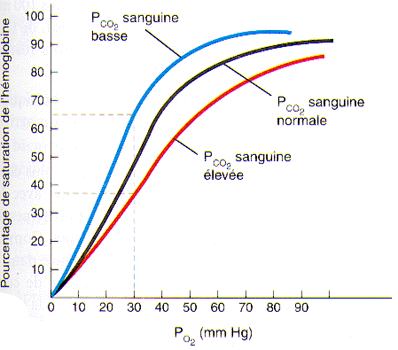
2°) L’effet de la pression partielle en gaz carbonique sur la saturation de l’hémoglobine
Le gaz carbonique a lui aussi une certaine affinité pour l’hémoglobine de telle sorte que lorsque la PCO2 augmente dans le sang, l’hémoglobine tend à se séparer plus facilement de l’oxygène. En fait, la PCO2 plasmatique et le pH sanguin sont deux facteurs connexes. En effet, lorsque la cellule est en activité, ses combustions, qui lui permettent de produire son énergie, produisent également du gaz carbonique qui se retrouve dans le sang. Ce gaz carbonique est alors transformé en acide carbonique par une enzyme présente dans les globules rouges, l’anhydrase carbonique. Cet acide carbonique se dissocie alors rapidement en ions hydrogène (H+) et en ions bicarbonates (HCO3-).
- CO2 + H2O -> HCO3- + H+
La conséquence de toute augmentation de CO2 dans le sang se traduit donc immédiatement par une baisse du pH sanguin et, par le fait même, par une augmentation de la dissociation de l’oxyhémoglobine. Les cellules, tout en travaillant, créent donc des modifications au niveau du sang qui leur favorisent un approvisionnement plus rapide en oxygène.
3°) L’effet du pH sur la saturation de l’hémoglobine
Lorsque le pH sanguin est plus acide, l’affinité de l’hémoglobine pour l’oxygène se fait moins grande de telle sorte que plus d’oxygène peut quitter le globule rouge pour se rendre vers les cellules. Nous verrons un plus loin que lorsque les cellules sont en activité elles produisent une grande quantité de gaz carbonique dont l’effet est une acidification du sang. Cette baisse du pH sanguin provoque alors un approvisionnement plus important en oxygène aux cellules en activité leur permettant de répondre à leur besoin accru de production d’énergie.
4°)L’effet de la température du sang sur la saturation de l’hémoglobine
La combustion cellulaire, nécessaire à la production d’ATP, produit de la chaleur qui se disperse alors dans le milieu interstitiel. Cette dispersion de chaleur a alors comme effet de réchauffer le sang. Ce réchauffement provoque une plus grande dissociation de l’oxyhémoglobine facilitant ainsi l’approvisionnement des cellules en oxygène.
Ainsi, à 37°C et pour une PO2 de 40 mmHg il reste encore tout près de 75% d’oxyhémoglobine dans les globules rouges alors qu’à 43°C il n’en reste qu’environ 40% et qu’à 20°C il en reste environ 95%. On comprendra pourquoi certaines interventions chirurgicales se font à basse température, ceci permettant de ralentir la consommation d’oxygène par les cellules et donc leur métabolisme.
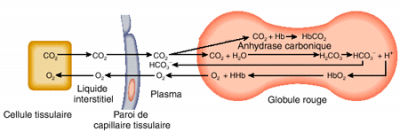
– Le transport du gaz carbonique
Le travail des différentes cellules de l’organisme constitue la source du CO2 présent dans le plasma. Ce gaz est considéré comme un déchet qui doit être éliminé. Pour ce faire, il est lui aussi transporté dans le plasma sanguin et éliminé au niveau des alvéoles.
Au niveau des tissus, le CO2 produit lors de la combustion nécessaire à la production d’ATP diffuse des cellules vers le milieu interstitiel. De là, il traverse les cellules endothéliales des capillaires pour se rendre dans le plasma sanguin.
(Tiré de Tortora et Grabowski aux éditions ERPI)
À ce niveau, le transport du CO2 peut se faire de trois façons :
Une fois dans le plasma sanguin, le CO2 diffuse à l’intérieur des globules rouges où un enzyme, l’anhydrase carbonique, facilite la combinaison du CO2 avec l’eau permettant ainsi la formation de l’acide carbonique (H2CO3). Cet acide carbonique peut à son tour se dissocier en H+ et HCO3-. Une partie des ions H+ est récupérée par l’hémoglobine qui sert alors de tampon cellulaire afin que le pH ne soit pas trop acide. Les ions bicarbonates diffusent hors des globules rouges vers le plasma. Ainsi, quelques 67 à 70% du CO2 est transporté sous forme d’ions bicarbonates (HCO3-).
CO2 + H2O -> H2CO3 -> H+ + HCO3-
21 à 25% du CO2 est transporté sous forme combinée avec l’hémoglobine ; on parle alors de carbamino-hémoglobine (HbCO2). Le CO2 s’associe de façon réversible avec la globine de l’hémoglobine surtout lorsque cette dernière n’est pas associée avec l’O2 (hémoglobine réduite). Cette situation est d’ailleurs celle qui prévaut au niveau cellulaire où l’hémoglobine tend à se défaire de l’oxygène de telle sorte que lorsque le CO2 est mis en présence de l’hémoglobine, il s’y attache.
7 à 8% du CO2 est transporté sous forme dissoute dans l’eau du plasma ; c’est cette quantité de CO2 qui détermine la PCO2 plasmatique.
Au niveau des poumons, les phénomènes s’inversent. Les ions HCO3- du plasma pénètrent dans les globules rouges. Les ions carbonates s’associent avec les ions H+ pour reformer H2CO3 qui se dissocie à son tour en eau et en CO2. Le CO2 libéré quitte les globules rouges et diffuse ensuite dans les alvéoles pour être éliminé de l’organisme. La réaction est donc réversible.
– Régulation de la respiration
Le rôle des mouvements respiratoires est d’assurer le renouvellement des gaz alvéolaires. Les humains possèdent un système respiratoire basé sur le va-et-vient continuel de l’air. Ce va-et-vient implique un mécanisme de contraction musculaire suivi d’un relâchement musculaire.
Contrairement au muscle cardiaque, le diaphragme et les muscles intercostaux sont des muscles squelettiques ordinaires qui ne peuvent pas se contracter spontanément mais doivent être stimulés par des influx nerveux.
– Le mécanisme ventilatoire
L’inspiration est un phénomène actif résultant de la décharge d’influx nerveux provenant des neurones inspiratoires situés dans le bulbe rachidien alors que l’expiration est un phénomène passif résultant de la diminution voire l’arrêt de l’envoi de ces influx nerveux inspiratoires.
C’est l’activité cyclique des neurones inspiratoires qui explique l’alternance des cycles inspiratoires et expiratoires.
La fréquence respiratoire est considérée comme le nombre de cycle inspiration-expiration dans une minute. Au repos, une inspiration dure habituellement deux secondes alors que l’expiration dure trois secondes. On calcule généralement cette fréquence sur une période d’une minute ; c’est pourquoi l’on parle de fréquence respiratoire par minute.
On croit que les neurones inspiratoires bulbaires regroupés dans le centre bulbaire possèdent une automaticité et une fréquence inhérente spontanée un peu comme les cellules du nœud sino-auriculaire du cœur (le pace maker du cœur) en possèdent un aussi. Il y a donc un moment où les neurones inspiratoires sont actifs et déchargent des influx nerveux dirigés vers les muscles inspiratoires lesquels se contractent et l’inspiration a lieu. Après deux secondes, ces neurones inspiratoires deviennent inactifs et, par conséquent, les muscles inspiratoires aussi et c’est le début de l’expiration. Après trois secondes, ils redeviennent spontanément actifs et le cycle recommence. On parle ici de fréquence de base de la respiration.
La fréquence respiratoire est intimement liée à la notion de profondeur des mouvements respiratoires. Lors d’une inspiration normale, seuls les muscles inspiratoires principaux soient les intercostaux externes et le diaphragme, participent à l’inspiration. D’autres muscles respiratoires dits accessoires, (lors d’une inspiration forcée), le scalène et le sterno-cléïdo-mastoïdien, ne sont pas nécessairement stimulés.
La profondeur des mouvements respiratoires va dépendre de la quantité de fibres musculaires stimulées lors de l’inspiration. Plus il y aura de fibres musculaires impliquées, plus l’expansion des poumons sera grande et plus l’air entrera dans les poumons. C’est ainsi que l’on peut avoir une inspiration normale ou forcée pouvant faire varier le volume courant d’air de 500 ml à 3000 ml.
Ces données de base étant expliquées, passons maintenant à la régulation de la respiration. Cette régulation se joue à deux niveaux principaux.
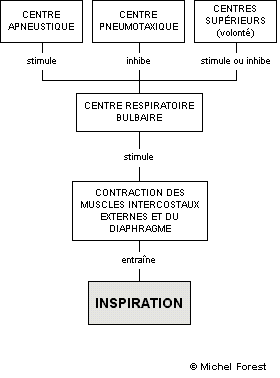
– Régulation nerveuse de la respiration
Nous pouvons modifier la fréquence de base de la respiration soit en l’augmentant, soit en la diminuant en fonction des besoins de l’organisme. Ainsi, la fréquence spontanée de la décharge des influx nerveux des neurones inspiratoires bulbaires peut être influencée voire modifiée par l’action de d’autres neurones provenant de la protubérance (située au-dessus du bulbe rachidien).
Dans la protubérance, se trouvent les deux centres nerveux : le centre pneumotaxique et le centre apneustique.
Le centre pneumotaxique envoie des influx nerveux inhibiteurs au centre bulbaire. L’effet de ces influx inhibiteurs est de limiter l’activité des neurones inspiratoires bulbaires ce qui entraîne un arrêt de l’inspiration et facilite l’expiration. La fréquence respiratoire peut ainsi être augmentée.
Le centre apneustique envoie des influx nerveux stimulateurs au centre bulbaire. L’effet de ces influx stimulateurs est d’activer l’activité des neurones inspiratoires ce qui entraîne une prolongation de l’inspiration et aussi l’inhibition de l’expiration. La fréquence de la respiration peut être ainsi diminuée.
D’une façon générale, le centre pneumotaxique a habituellement plus d’importance que le centre apneustique.
L’activité du centre respiratoire peut aussi être influencée par notre volonté c’est-à-dire par l’intermédiaire de notre cortex cérébral. Ainsi, nous pouvons volontairement arrêter de respirer comme lorsque nous voulons nous abstenir de respirer des gaz polluants et irritants par exemple ou nous pouvons volontairement augmenter notre fréquence respiratoire. Cependant, ces actions volontaires ne peuvent être faites sans relâche c’est-à-dire que nous ne pouvons retenir notre respiration très longtemps avant qu’elle ne se déclenche spontanément. Ceci est le fait d’une régulation chimique des mouvements respiratoires.
Les poumons ont une limite d’expansion qu’il ne faut naturellement pas dépasser. Il est donc normal qu’un mécanisme de contrôle veille à ce que la profondeur de l’inspiration ne dépasse pas ses limites.
Ainsi, lors d’une période active de ventilation où des inspirations forcées sont souvent exigées, des mécanorécepteurs situés dans les parois des bronches et des bronchioles sont étirés de façon excessive. Ils transmettent alors des influx nerveux afférents
- vers le centre bulbaire (neurones inspiratoires bulbaires) provoquant un arrêt des influx nerveux vers les muscles inspiratoires
- vers le centre apneustique qui n’active plus le centre bulbaire : l’inspiration est alors inhibée et l’expiration peut avoir lieu.
En plus, pour favoriser l’expiration, le centre bulbaire peut envoyer des influx nerveux à des neurones expiratoires bulbaires qui entraînent alors la contraction des muscles expirateurs, les muscles intercostaux internes et les abdominaux. Cette contraction entraîne une grande réduction du volume de la cage thoracique et provoque une expiration forcée.
Ces neurones expiratoires bulbaires ne seraient actifs que dans des conditions où la ventilation pulmonaire est accrue et plus forte. Ces conditions transmettraient donc des influx nerveux aux muscles expiratoires afin de faciliter une expiration. Ce processus, faisant intervenir les mécanorécepteurs, est en fait un mécanisme de défense qui tend à éviter que les poumons soient trop gonflés. De cette façon, l’organisme opère un contrôle efficace de la profondeur des mouvements inspiratoires. Ce phénomène est appelé le réflexe de Hering-Breuer.
– Les facteurs chimiques influençant le contrôle de la respiration
Rappelons que
- la ventilation permet l’entrée d’O2 et la sortie de CO2 dans les poumons,
- la PO2 correspond à la quantité d’O2 dissoute dans la plasma et la PCO2 correspond à la quantité de CO2 dissout dans le plasma,
- une ventilation inadéquate abaisse la PO2 parce que la consommation dépasse l’approvisionnement et élève la PCO2 parce que la production est supérieure à l’élimination,
- le CO2 se combine facilement à l’eau dans le plasma pour donner des ions H+ et HCO3- d’où l’augmentation de l’acidité plasmatique (état d’acidose ).
À partir de ces donnés, on peut raisonnablement penser que la PO2, la PCO2 et les ions H+ plasmatiques peuvent influencer l’activité respiratoire.
Mais alors, comment le centre respiratoire bulbaire est-il informé des besoins des différentes cellules de l’organisme ?
Le centre respiratoire reçoit des informations par voie afférente en provenance de deux types de chimiorécepteurs :
Les chimiorécepteurs périphériques. Ces récepteurs chimiques sont situés à la base des artères carotidiennes (cou) et au niveau de la crosse aortique. À noter que ces récepteurs sont situés au même endroit que les barorécepteurs régulant la pression artérielle. Ces chimiorécepteurs sont particulièrement sensibles aux variations de la PO2 artérielle, mais perçoivent aussi dans une proportion moindre les variations de la PCO2 artérielle et de la concentration artérielle en ions H+.
Les chimiorécepteurs centraux sensibles à la concentration en ions H+ du milieu interstitiel entourant le cerveau.
Ces chimiorécepteurs réagiront donc fortement aux variations de
- Pression partielle artérielle en oxygène
- Pression partielle artérielle en gaz carbonique
– Effet de la variation de la PO2 artérielle
Une PO2 faible dans le sang artériel provoque une augmentation de la ventilation pulmonaire c’est-à-dire une hyperventilation.
Selon notre modèle de régulation action-réaction, la diminution de la PO2 est d’abord perçue par les chimiorécepteurs périphériques. Ces derniers acheminent l’information au centre d’intégration représenté dans ce cas-ci par le centre bulbaire. Le centre bulbaire est aussitôt stimulé et les neurones inspiratoires bulbaires entrent en action en augmentant le nombre de décharges nerveuses et le nombre de fibres musculaires des muscles respiratoires inspiratoires (squelettiques) qui agissent comme effecteurs somatiques. Ceci a pour effet d’augmenter à la fois la fréquence et la profondeur de la respiration provoquant ainsi une plus grande entrée d’O2 et une plus grande élimination du CO2 de façon à permettre un retour à l’équilibre. De cette façon, l’organisme et principalement le cerveau ne manquent pas d’O2.
À noter qu’un tel processus peut être du à différentes situations telles que :
- une diminution de l’O2 dans l’air inspiré (haute altitude)
- une hypoventilation provoquée par :
- une augmentation de la résistance des voies aériennes, ex. : asthme
- une paralysie des muscles inspiratoires, ex. : polyomyélite.
- une inhibition du centre bulbaire respiratoire, ex. : par l’utilisation de drogues style morphine, par une mauvaise irrigation sanguine des neurones inspiratoires qui entraînent leur mort
- une diminution de l’élasticité des poumons, ex. : maladies des membranes hyalines
- un affaissement des poumons, ex. : un pneumothorax.
- une destruction du tissu alvéolaire, ex. : emphysème
une diffusion alvéolo-capillaire déficiente ou grandement diminuée, ex. : œdème pulmonaire (accumulation de liquide dans l’espace interstitiel), silicose et tuberculose (dépôt progressif de tissu fibreux dans le milieu interstitiel).
D’une façon générale, on doit comprendre que dans ces situations, la PO2 alvéolaire est diminuée entraînant une diminution de la PO2 artérielle d’où l’état d’hypoxie, laquelle diminution de la PO2 artérielle est perçue par les chimiorécepteurs périphériques qui stimulent la respiration (hyperventilation).
ATTENTION !
Un cas d’anémie n’entraînera pas d’augmentation de la ventilation même si la personne est en état d’hypoxie : c’est l’état d’hypoxie des anémies . La raison est que dans l’anémie, la faible teneur en O2 est due à la diminution des molécules d’hémoglobine fonctionnelle ou à la diminution du nombre des globules rouges, la teneur en O2 dissoute dans le plasma (PO2 ) n’étant pratiquement pas affectée. Par contre, cette situation n’empêchera pas les cellules de possiblement manquer d’oxygène. Ainsi, on se souvient que lorsque les cellules des reins viennent à manquer d’oxygène, elles libèrent une enzyme, l’érythrogénine, laquelle transforme une protéine plasmatique en une hormone appelée érythropoïétine. Cette dernière circule dans le sang jusqu’à la mœlle osseuse où elle déclenche la formation de nouveaux globules rouges.
Dans l’intoxication par le monoxyde de carbone, il n’y a pas non plus d’augmentation significative de la ventilation. Le monoxyde de carbone est un gaz qui réagit avec les mêmes sites que ceux de l’O2 sur la molécule de l’hémoglobine. Ce gaz a une telle affinité pour ces sites que même de petites quantités de monoxyde de carbone diminuent la capacité de combinaison de l’O2 avec l’hémoglobine. Par ailleurs, ce gaz n’affecte pas la PO2 et les récepteurs carotidiens et aortiques ne sont pas stimulés. L’individu perd connaissance et meurt par manque d’O2 sans même avoir augmenté sa respiration.
– Effet de la variation de la PCO2 artérielle
L’effet d’une augmentation de la PCO2 est drastique et majeure. Une faible augmentation de la valeur de la PCO2 entraîne une très grande augmentation de la ventilation alors qu’une légère baisse peut ralentir voire inhiber la ventilation. Cet effet passe par la transformation du CO2 en ions H+ lors de la combinaison du CO2 avec de l’eau contenue dans les liquides corporels.
CO2 + H2O -> H2CO3 -> H+ + HCO3-
La concentration des ions H+ dans les liquides interstitiels est alors considérablement augmentée. Une lecture est faite par les chimiorécepteurs centraux qui perçoivent l’augmentation de la concentration des ions H+ dans le liquide interstitiel cérébral. Le centre respiratoire est aussitôt stimulé et les neurones inspiratoires bulbaires entrent en action en augmentant le nombre de décharges nerveuses et le nombre de fibres musculaires des muscles inspiratoires. Ceci a pour effet d’augmenter à la fois la fréquence et la profondeur de la ventilation afin de pouvoir faciliter l’élimination du CO2 par les poumons.
ATTENTION : On doit comprendre que :
L’augmentation de la PCO2 stimule de façon marquée la ventilation (hyperventilation) :
Lorsqu’on arrête volontairement de respirer, il y a une accumulation du CO2 et par conséquent une augmentation de la PCO2 dans le plasma. Cette augmentation de PCO2 a un effet stimulant si fort qu’il surmonte l’inhibition volontaire du centre respiratoire afin que reprenne la ventilation. Ainsi, une personne qui se retrouve, par exemple, à l’intérieur d’un bâtiment en feu ou sous l’eau, ne pourra retenir indéfiniment sa respiration afin d’éviter d’inhaler la fumée ou de l’eau.
Lorsqu’on hyperventile, par exemple lorsque l’on fait de la nage sous-marine ou qu’un mari aide sa femme lors de son accouchement en faisant lui aussi les respirations rapides et saccadées, on élimine plus de CO2 que l’on en produit. La PCO2 plasmatique baisse et la ventilation est arrêtée jusqu’à ce que la PCO2 redevienne normale. Cette réaction peut entraîner une perte de conscience.
source : cours.cegep-st-jerome.qc.ca
— -
A voir
– La physiologie de l’apnée
– Les zones de West
– Analogie entre la plongée et l’anesthésie
Arnaud BASSEZ
IADE/enseignant CESU
Administrateur