Mécanisme d’action des principales molécules hypotensives
- La nicardipine repose principalement sur la vasodilatation et la baisse des résistances vasculaires systémiques par l’intermédiaire d’une voie calcium dépendante. Elle est faiblement inotrope négative. Elle n’agît pas sur la fréquence cardiaque ni sur la précharge.
- Les bloqueurs du système rénine-angiotensine-aldostérone (SRAA) : ils réduisent les résistances vasculaires systémiques et partiellement la précharge. Ils n’ont pas d’action inotrope ni chronotrope négative.
- Les bétabloquants vont agir en bloquant l’action des catécholamines endogènes sur les récepteurs beta-adrénergiques cardiaques et vasculaires. Ils réduisent la pression artérielle par une double action inotrope et chronotrope négative sur le myocarde. Ils ont également une action hypotensive de plus faible amplitude via la baisse des résistances vasculaires systémiques.
- Les dérivés nitrés agissent sur le muscle lisse via une voie non calcium dépendante. Ils vont induire une vasodilatation artérielle et veineuse responsable d’une baisse de la précharge et des résistances vasculaires systémiques. Une tachycardie réflexe peut être observée. Il n’y a pas d’action sur l’inotropisme.
- L’urapidil est un antagoniste des récepteurs alpha-1 post-synaptiques et des récepteurs séronotinergiques. Il réalise une vasodilatation réduisant la précharge et la postcharge cardiaque. Il n’entraine pas de modification de la fréquence ni de l’inotropisme cardiaque.
- Les diurétiques de l’anse vont inhiber la réabsorption de sodium, de potassium et de chlore en bloquant les récepteurs Na-K-Cl au niveau de la partie ascendante de l’anse de Henlé. Il en résulte une baisse de la volémie et donc de la précharge cardiaque. Ils exercent aussi une action vasodilatatrice veineuse à forte dose.
- Les alpha-2 agonistes (clonidine, dexmedetomidine) sont des antihypertenseurs d’action centrale (stimulation directe des récepteurs alpha-2 centraux). Ils associent une action vasodilatatrice avec un chronotropisme négatif. Ils ont également un effet sédatif et analgésique les rendant intéressant dans la prise en charge des HTA dans un contexte douloureux, anxieux ou de syndrome de sevrage.
D’après Antoine Parmentier. Protocole d’étude pilote prospective contrôlée randomisée ouverte comparant le traitement de l’hypertension artérielle en réanimation par voie entérale ou par voie intra-veineuse.
Médecine humaine et pathologie. 2022. dumas-03844326
| / | Fréquence cardiaque | Inotropisme | Précharge | Résistances vasculaires systémiques |
| Nicardipine | 0 | ↓ | 0 | ↓↓↓ |
| Bloqueurs du SRAA | 0 | 0 | ↓ | ↓↓↓ |
| Béta bloquants | ↓↓↓ | ↓↓ | 0 | ↓ |
| Dérivés nitrés | 0 ou ↑ | 0 | ↓↓ | ↓↓ |
| Diurétiques de l’anse | 0 | 0 | ↓↓ | 0 |
| Alpha 2 agonistes | ↓↓ | 0 | 0 | ↓↓ |
0 : pas d’action ↓ diminution de faible amplitude ↓↓ diminution de moyenne amplitude ↓↓↓ diminution de forte amplitude ↑ augmentation de faible amplitude SRAA Système rénine angiotensine-aldostérone
Hypertension artérielle

L’hypertension artérielle est la pathologie intercurrente la plus fréquente dont souffrent les malades adressés en milieu chirurgical. La finalité de la prise en charge de ces malades est de préserver leur pronostic fonctionnel afin de ne pas compromettre leur espérance de vie. Les modifications tensionnelles per- et postopératoires qui menacent les opérés hypertendus ont des effets délétères bien établis qui rendent compte du risque d’atteinte du potentiel cellulaire myocardique, cérébral et rénal.
Une attention particulière doit être portée aux trois temps pré-, per- et postopératoire qui conditionnent la maîtrise du risque opératoire. L’hypertension artérielle ne constituant pas un facteur prédictif indépendant du risque opératoire, l’évaluation préopératoire doit rechercher les deux pathologies associées pouvant être à l’origine de complications postopératoires : l’insuffisance coronarienne et l’existence d’une pathologie athéroscléreuse des artères à destinée cérébrale.
Le traitement antihypertenseur doit être adapté avant l’intervention. Alors que les médicaments interférant avec le système sympathique doivent être administrés avec la prémédication, les agents inhibant le fonctionnement du système rénine-angiotensine ne doivent pas être poursuivis jusqu’au matin de l’intervention. Il est également essentiel, pour limiter le risque opératoire chez l’hypertendu, de contrôler la cause principale des complications circulatoires périopératoires : les contraintes hémodynamiques et métaboliques qui caractérisent la période postopératoire.
La prévention de l’hypothermie, plusieurs techniques d’analgésie, intensives si besoin, et le recours à des médicaments qui limitent l’hyperactivité sympathique postopératoire comme les bêta bloquants et les alpha-2-agonistes permettent actuellement un contrôle satisfaisant de l’équilibre tensionnel postopératoire.
Si malgré ces mesures surviennent des élévations tensionnelles postopératoires, elles doivent être traitées sans retard par des vasodilatateurs ou des bêtabloquants.
source : em-consulte.com

Qu’est ce que la Pression artérielle ?
– PA= Q x R
- PA= pression artérielle
- Q= débit cardiaque
- R= Résistance vasculaire
La pression artérielle est la pression régnant à l’intérieur du vaisseau. La tension artérielle est la pression trans murale qui agit sur l’extérieur du vaisseau.
La Tension artérielle normale :
- < 140 mmHg de systolique
- < 90 mmHg de diastolique
- HTA : PA > 140/90 mmHg
- HTA grade 1 : 140 – 159/90-99 mmHg
- HTA grade 2 : 160-179/ 100-109 mmHg
- HTA grade 3 : > 180 mmHg/ > 110 mmHg
– Facteurs de risques
- Non modifiables
– Age
– Sexe
– Facteurs materno-foetaux
– Génétique
- Modifiables
– Consommation sodée
– Sédentarité
– Surcharge pondérale
– Alcool
– Stress
– Socio-économique

Six classes de médicaments, dits antihypertenseurs, sont utilisées pour le traitement de l’hypertension.
- Les diurétiques
Les diurétiques (thiazidiques) sont les médicaments les plus anciens utilisés contre l’hypertension. Ils favorisent l’élimination d’eau et de sel par les reins, diminuant de ce fait le volume de liquide qui circule dans les artères et abaissant la pression qui s’exerce sur leur paroi. Certains d’entre eux sont responsables d’une baisse du taux de potassium dans le sang qui doit être surveillé.
En 2014, la Revue Prescrire estimait que chez les personnes sans diabète et sans atteinte cardiovasculaire ni rénale, les diurétiques thiazidiques demeuraient le traitement de premier choix de l’hypertension artérielle.
- Les bêta-bloquants
Les bêta-bloquants entraînent un ralentissement de la fréquence cardiaque et une diminution de la force de contraction du cœur.
Ils bloquent l’action d’hormones telles que l’adrénaline en prenant la place de ces dernières sur les récepteurs mais provoquent moins de réaction de la part du récepteur.
Les bêtabloquants sont généralement prescrits aux personnes hypertendues ayant déjà subi un infarctus du myocarde, souffrant d’angine de poitrine ou dont la fréquence cardiaque de repos est rapide. Des effets secondaires le plus fréquemment rencontrés sont des troubles digestifs, une fatigue, une sensation de pieds et de mains froids, un ralentissement du rythme cardiaque, des troubles du sommeil et des troubles de l’érection.
- Les inhibiteurs de l’enzyme de conversion (IEC)
Les inhibiteurs de l’enzyme de conversion (IEC) bloquent la production de l’angiotensine, une hormone produite par les reins, qui favorise la contraction des vaisseaux.
Les IEC sont utilisés chez des personnes hypertendues qui présentent également des troubles cardiaques.
- Les antagonistes des récepteurs de l’angiotensine II (ARA2, ARAII ou sartans)
Les antagonistes (1) de l’angiotensine II (ARA2) s’opposent à l’action de l’angiotensine qui favorise la contraction des vaisseaux.
Une évaluation médico-économique de la HAS (Haute autorité française de santé) rendue publique en mai 2013 concluait que le coût deux fois plus élevé des ARAII comparativement à d’autres classes de médicaments antihypertenseurs n’est pas justifié au regard des bénéfices cliniques supplémentaires qu’ils apportent. Il s’agit pourtant de la classe la plus prescrite (38 % des prescriptions). La HAS préconisait de considérer plutôt les diurétiques, les IEC et les inhibiteurs calciques (ICa) en instauration de traitement.
Les ARA2 et les IEC sont des médicaments plus récents que les diurétiques et les bêtabloquants.
- Les antagonistes du calcium (inhibiteurs calciques)
Les antagonistes du calcium, ou inhibiteurs calciques, freinent l’entrée du calcium dans les muscles responsables de la contraction des artères. Ils entraînent ainsi la baisse de la tension artérielle par relâchement des artères. Ils sont également utilisés pour traiter l’angine de poitrine.
La liste des médicaments de cette classe en France en date du 23 mai 2013, est la suivante :
- Adalate,
- Amlodipine Génériques,
- Amlor,
- Baypress,
- Caldine,
- Chronadalate,
- Deltazen,
- Dilrène,
- Diltiazem Génériques,
- Félodipine Génériques,
- Flodil,
- Icaz,
- Iperten,
- Isoptine,
- Lercan,
- Lercanidipine Génériques,
- Loxen,
- Manidipine Génériques,
- Mono-Tildiem,
- Nidrel,
- Nifédipine Génériques,
- Nitrendipine Génériques,
- Vérapamil Génériques,
- Zanidip.
- Les inhibiteurs de la rénine (aliskirène)
Les inhibiteurs de la rénine bloquent l’action de la rénine, une enzyme produite par les reins, qui intervient dans la régulation de la pression artérielle. Actuellement, seul un inhibiteur de la rénine, l’aliskirène, est commercialisé. Il peut être utilisé seul ou en association avec d’autres antihypertenseurs.
Ces classes sont :
- • les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC)
- • les antagonistes des récepteurs de l’angiotensine II (ARA II ou sartans)
- • les inhibiteurs directs de la rénine (aliskirène).
Voici la liste, mise à jour par l’ANSM au 13 mars 2013, des médicaments de ces classes commercialisés en France :
– Les inhibiteurs de l’enzyme de conversion de l’angiotensine seuls ou associés (IEC)
- Benazepril (Cibacene et génériques)
- Benazepril + hydrochlorothiazide (Cibradex, Briazide et génériques)
- Captopril (Captéa, Lopril et génériques)
- Captopril + hydrochlorothiazide (Ecazide et génériques)
- Cilazapril (Justor)
- Enalapril (Renitec et génériques)
- Enalapril + hydrochlorothiazide (Corenitec et génériques)
- Enalapril + lercanidipine (Lercapress, Zanextra)
- Fosinopril (Fozitec et génériques)
- Fosinopril + hydrochlorothiazide (Foziretic et génériques)
- Lisinopril (Zestril, Prinivil et génériques)
- Lisinopril + hydrochlorothiazide (Zestoretic et génériques)
- Moexipril (Moex)
- Périndopril (Coversyl et génériques)
- Périndopril + hydrochlorothiazide (Bi-Preterax et génériques)
- Périndopril + amlodipine (Coveram)
- Quinapril (Acuitel et génériques)
- Quinapril + hydrochlorothiazide (Acuilix et génériques)
- Ramipril (Triatec et génériques)
- Ramipril + hydrochlorothiazide (Cotriactec et génériques)
- Trandolapril (Odrik et génériques)
- Trandolapril + vérapamil (Tarka)
- Zofénopril (Zofénil, Teoula et génériques)
- Zofénopril + hydrochlorothiazide (Zofénil duo, Coteoula)
- Les antagonistes des récepteurs de l’angiotensine II seuls ou associés (ARA II ou sartans)
- Azilsartan (Edarbi, Ipreziv)
- Candesartan (Atancand, Kenzen et génériques)
- Candesartan + hydrochlorothiazide (Hytacand, Cokenzen et génériques)
- Irbesartan (Aprovel et génériques)
- Irbesartan + hydrochlorothiazide (Coaprovel et génériques)
- Losartan (Cozaar et génériques)
- Losartan + hydrochlorothiazide (Hyzaar, Fortzaar et génériques)
- Olmesartan (Olmetec, Alteis)
- Olmesartan + hydrochlorothiazide (Coolmetec, Alteisduo)
- Olmesartan + amlodipine (Sevikar, Axeler)
- Olmesartan + amlodipine + hydrochlorothiazide (Trisevikar, Triaxeler)
- Telmisartan (Micardis, Pritor, Kinzalmono et génériques)
- Telmisartan + hydrochlorothiazide (Micardisplus, PritorPlus, Kinzalkomb et génériques)
- Telmisartan + amlodipine (Twynsta, Onduarp)
- Valsartan (Tareg, Nisis et génériques)
- Valsartan + hydrochlorothiazide (Cotareg, Nisisco et génériques)
- Valsartan + amlodipine (Exforge)
- Valsartan + amlodipine + hydrochlorothiazide (Exforge HCT)
– Les inhibiteurs directs de la rénine seuls ou associés
Les inhibiteurs de la rénine bloquent l’action de la rénine, une enzyme produite par les reins, qui intervient dans la régulation de la pression artérielle. Actuellement, seul un inhibiteur de la rénine, l’aliskirène, est commercialisé. Il peut être utilisé seul ou en association avec d’autres antihypertenseurs.
- Aliskiren (Rasilez)
- Aliskiren + hydrochlorothiazide (Rasilez HCT)
- Aliskiren + amlodipine (Rasilamlo)
- Aliskiren + amlodipine + hydrochlorothiazide (Rasitrio)
Dans un communiqué en date du 13 mars 2013, l’Agence française du médicament(ANSM) a mis en garde contre l’association de médicaments appartenant aux classes IEC, ARA-II et l’aliskirène. Ces associations ne présentent pas plus d’efficacité et exposent à des risques secondaires accrus, indiquait-elle.
- Schéma physiopathologique des mécanismes impliqués dans les conséquences de l’augmentation de la pression artérielle. HTA = hypertension artérielle, NAD(P)H oxydases = nicotinamide adénine dinucléotide oxydases, O2- = radicaux superoxydes, AP-1 = activator protein-1, NFκB = nuclear factor-κB, ARNm = acide ribonucléique messager, AT1R = récepteur à l’angiotensine II, Σ = système orthosympathique, ET-1 = endothéline-1, MAPK = mitogen activator protein kinase, LOX-1 = récepteur au LDL oxydé, CRP = protéine C-réactive.
- Le stress oxydant consécutif à l’augmentation de la contrainte pulsatile inactive le monoxyde d’azote (NO). Il en résulte une dépression de la relaxation des cellules musculaires lisses et de l’effet antiagrégant plaquettaire du NO. Par ailleurs les radicaux superoxydes oxydent le LDL-cholestérol (LDLox).
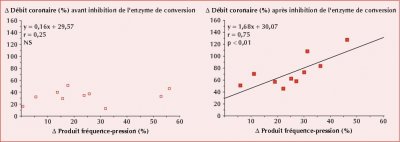
- À gauche : l’augmentation de la demande métabolique du myocarde pendant le test au froid n’entraîne pas d’augmentation du débit coronaire malgré l’augmentation de la demande métabolique du myocarde estimée par le produit fréquence-pression. À droite : après administration d’un inhibiteur de l’enzyme de conversion, on observe le rétablissement du couplage entre demande métabolique du myocarde et débit coronaire.
- Schéma représentant le rôle du stress oxydant dans l’induction de l’athérosclérose dans l’hypertension artérielle. Le LDL-cholestérol oxydé (LDLox) et les radicaux superoxydes sont tous deux des activateurs du NFκB qui, par l’intermédiaire des cytokines pro-inflammatoires, stimule la production des molécules d’adhésion (ICAM-1 = intercellular adhesion molecules-1, VCAM-1 = vascular cell adhesion molecules-1, sélectines P et E) et la migration des monocytes et des lymphocytes T vers l’intima de l’artère par le MCP-1 (monocyte chemo-attractant factor-1). La production d’interféron-α (INF-α) active les monocytes qui phagocytes le LDLox et se transforment en cellules spumeuses.
– A lire
– A consulter les articles en rapport avec le sujet. Ils sont issus de la catégorie pharmacie, de la rubrique Olympiade
- Les sympathomimétiques
- Les médicaments cardiovasculaires utiles en peropératoire
- Compatibilités des médicaments
- Référentiel national des interactions médicamenteuses
— -
Hypertension artérielle

Mesure de la pression artérielle
La mesure invasive de la pression artérielle est sujette à deux modulations physiologiques qui deviennent très significatives chez les gens âgés ou chez les hypertendus.
La mise sous tension du volume systolique par le VG induit une brusque onde de pression dans la masse sanguine et l’arbre artériel, qui se propage dans les gros vaisseaux sous forme d’une onde pariétale ; celle-ci précède normalement le flux sanguin pulsatile, car elle se déplace à une vélocité de 5.0 m/seconde alors que la masse sanguine avance plus lentement (0.4-1 m/s) [109].
Une élévation soudaine des résistances survient lorsque l’on passe des grandes artères aux artérioles ; cet endroit, anatomiquement réparti dans l’organisme, induit une réflexion de l’onde de pression pariétale, comme si elle butait contre un mur. Lorsqu’elle revient en direction du cœur, cette onde de pression réfléchie croise et se superpose à l’onde de flux sanguin (déplacement du volume systolique) avec un délai par rapport à la systole qui varie selon sa vitesse de propagation et selon le lieu de mesure de la pression dans l’arbre vasculaire.
Ces phénomènes font que la pression artérielle n’est pas identique dans toutes les artères, mais augmente d’amplitude au fur et à mesure que l’on s’éloigne du coeur (Figure 21.14) : la distensibilité diminue, les résistances augmentent, et le délai de la rencontre entre l’onde de pression réfléchie et la pression générée par l’avancement du volume systolique se raccourcit.
Le flux sanguin, exprimé par sa vélocité en m/s, se modifie également. Dans l’aorte ascendante, il n’est que systolique, la colonne de sang étant immobile en diastole, alors qu’il devient progressivement systolo-diastolique et de plus en plus « dépulsé » en périphérie (Figure 21.14). Tout se passe comme si la fonction des grandes artères était d’amortir la pulsatilité imposée par la systole ventriculaire et de délivrer en périphérie un flux continu à une pression moyenne aussi voisine que possible de celle de l’aorte ascendante [137].
Dans l’aorte ascendante, la pression est en général de basse amplitude grâce à l’élasticité des parois ; l’onde de pression réfléchie en périphérie y revient après la fermeture de la valve aortique et amplifie la pression protodiastolique. Avec l’âge, cette élasticité des vaisseaux diminue, et l’onde de pression se propage plus vite. La forme de la courbe aortique se modifie : le retour de l’onde réfléchie survient plus tôt et vient amplifier la pression en télésystole (Figure 21.7). L’hypertendu présente une courbe analogue, mais à des valeurs particulièrement élevées.
On peut ainsi décrire deux types de contours de pression artérielle dans l’aorte ascendante (Figure 21.15) [130] :
- Le type A : le retour précoce de l’onde réfléchie détermine le pic systolique qui survient en télésystole et représente 10-15% de la valeur totale de la pression systolique ; c’est la configuration de la personne âgée et de l’hypertendu ; il augmente la postcharge du VG ; il apparaît de façon marquée et précoce lors de clampage aortique.
- Le type C : chez l’individu jeune, le retour de l’onde réfléchie est plus tardif et moins marqué ; il survient en protodiastole ; le pic systolique, plus bas, n’est pas influencé par le retour de l’onde de pression ; c’est la pression protodiastolique qui est amplifiée. Une vasodilatation artérielle pharmacologique induit ce même type de courbe.
Il est rare que l’on mesure la pression dans l’aorte ascendante ! Or, plus le cathéter de mesure est périphérique, plus il enregistre une pression élevée et plus le pic de pression réfléchie s’imbrique dans la pression du flux systolique pulsatile (Figure 21.16) [126].
D’un point de vue pratique, l’artère radiale est plus distale que l’artère fémorale ; on y lit une pression systolique normalement plus haute que la pression centrale aortique, alors que la pression fémorale est plus basse parce que plus voisine de la pression aortique. Après la CEC, ce phénomène s’inverse : la pression radiale est plus basse que la pression fémorale à cause de la vasoconstriction catécholaminergique et hypothermique intense. L’ordre de grandeur de cette différence est de 20-50 mm Hg (Figure 21.17) [149]. En effet, l’extrémité du cathéter fémoral est dans l’artère iliaque externe, qui est une artère élastique non sujette à la vasoconstriction, contrairement à l’artère radiale qui est une artère musculaire. Le cathéter fémoral transmet la pression de perfusion réelle du cerveau et des coronaires, mais non le cathéter radial.
Les organes complexes bénéficient d’un système d’autorégulation qui maintient le flux sanguin constant sur une vaste plage de valeurs de pression artérielle. En deçà et au-delà de ces valeurs, le flux devient pression-dépendant. Pour le cerveau, la zone d’autorégulation s’étend normalement de 60 à 130 mmHg de pression moyenne (PAM) [143]. Dans les reins, l’autorégulation maintient le flux plasmatique rénal (FPR) sur une plage de PAM allant de 80 à 180 mmHg. Une PAM de 60-70 mmHg est donc en dessous de la zone d’autorégulation, et le FPR y devient dépendant de la pression ; la régulation s’étend plus loin vers les hautes que vers les basses pressions. Une PAM de 80 mmHg est le minimum vital pour le rein adulte. Chez le malade hypertendu, ces plages d’autorégulation sont déplacées vers le haut, ce qui sous-entend que le flux devient pression-dépendant déjà à des valeurs de PAM banales pour un individu normal.
Mesure de la pression artérielle
Les parois des grandes artères sont élastiques et amortissent les variations de pression systolo-diastoliques. Les artères périphériques sont musculaires et représentent la composante majeure des RAS. Dans l’aorte, la pression différentielle (PAsyst – PAdiast) est plus basse qu’en périphérie ; la PAsyst est inférieure et la PAdiast supérieure à celles de l’artère radiale. La pression la plus proche de celle de l’aorte (pression de perfusion cérébrale et coronarienne) est transmise par un cathéter fémoral.
La vasoconstriction artérielle (hypothermie, noradrénaline) affecte la lecture de la PA dans les artères musculaires (artère radiale) mais non dans les artères élastiques (artère fémorale).
Risque cardiovasculaire
Incidence de l’hypertension artérielle
L’hypertension artérielle (HTA) est probablement la maladie la plus fréquente de l’humanité, puisqu’on estime qu’elle touche un milliard d’individus et cause la mort de 7 millions de personnes par année [79]. C’est une affection dont l’incidence augmente avec l’âge ; du fait du vieillissement de la population, on la rencontre donc de plus en plus fréquemment en salle d’opération. Comme la pression artérielle s’élève avec les années à cause de la perte de souplesse de l’arbre vasculaire, on peut se demander à quel moment elle devient pathologique, puisque les accidents vasculaires auxquels elle est associée deviennent de plus en plus fréquents au fur et à mesure que l’on vieillit. Cela revient à dire que l’âge est une maladie !
C’est en tout cas un gigantesque marché pour l’industrie pharmaceutique, qui ne voit pas d’un mauvais œil la baisse du seuil de pression servant à définir la limite de l’hypertension.
L’hypertension est une affection multisystémique touchant principalement le coeur, l’arbre vasculaire, les reins et le cerveau. Le risque cardiovasculaire est d’autant plus grand que la pression est plus élevée, et pendant une plus longue durée.
Entre 40 et 70 ans, chaque augmentation de 20 mmHg de la pression systolique double le risque de développer une maladie vasculaire, particulièrement une ischémie coronarienne ou un accident vasculaire cérébral. Ce risque s’élève dès que la pression systolique dépasse 120 mmHg et la diastolique 75 mmHg [112]. Chez un adulte, les valeurs normales de la pression artérielle (PA) sont 120-129 mmHg de PAsyst et 80-84 mmHg de PAdiast. Une PA de 130-139 / 85-89 mmHg est considérée comme normale-supérieure (high normal) [115a].
Les principaux facteurs de risque associés à l’HTA sont l’âge, l’hypertrophie ventriculaire gauche, le syndrome métabolique, le tabagisme, la dyslipidémie et le diabète. Le risque de l’HTA est essentiellement lié aux lésions des organes-cibles : maladie cérébrovasculaire, coronaropathie, insuffisance ventriculaire, insuffisance rénale, polyartériopathie périphérique.
L’hypertension se définissait habituellement par l’augmentation de la pression diastolique. Cependant, l’analyse de grandes enquêtes épidémiologiques comme la Framingham Study ont révélé une association hautement significative entre le risque cardiovasculaire et la valeur de la pression systolique. Elle a aussi démontré une association très positive entre le risque cardiovasculaire et la pression différentielle ou pression pulsée (PAsyst – PAdiast), mais une association négative avec la valeur de la pression diastolique [61,62].
Ceci est logique, puisque l’HTA est liée à la fois aux résistances artérielles et à la rigidité des gros vaisseaux. Dès la quarantaine, la pression systolique est une bonne représentation des résistances vasculaires, mais elle sous-estime la rigidité des vaisseaux ; la pression pulsée est au contraire une bonne image de cette dernière.
Le manque de distensibilité des artères donne lieu à deux phénomènes :
- L’aorte et les grandes artères élastiques ont normalement la capacité de se distendre en systole, ce qui amortit la pression systolique, et de restituer le volume en diastole, ce qui augmente le flux, donc la pression diastolique (Figure 21.5) ; nous sommes en quelque sorte physiologiquement contre-pulsés. Chez l’hypertendu, la rigidité des gros vaisseaux supprime cet effet d’amortissement systolique et de renforcement diastolique, ce qui augmente la PAsyst et baisse la PAdiast ; la différentielle augmente.
- La rigidité des parois artérielles fait que l’onde de pression réfléchie en périphérie (Figure 21.6) se propage plus rapidement (10-12 m/s) et revient au niveau des grandes artères pendant la systole déjà, et non pendant la diastole (Figure 21.7) ; la PAsyst augmente, alors que la PAdiast baisse [179].
Simultanément, la pression de perfusion coronarienne est diminuée du fait de la diastolique abaissée, mais la charge ventriculaire augmentée à cause de l’élévation de la pression systolique (Figure 21.8). Les évènements cardiovasculaires sont davantage liés au stress pulsatile des gros vaisseaux pendant la systole qu’au stress stable lié aux résistances des petites artères en diastole [61]. Ainsi, une augmentation de la systolique est associée à un risque cardiovasculaire accru, quelle que soit la diastolique, mais pour une même valeur systolique, les patients qui ont une diastolique basse sont plus à risque que ceux qui ont une diastolique haute, car leur différentielle est plus grande (Figure 21.18) [70,179].
Définition de l’hypertension artérielle
L’hypertension est classifiée en trois stades [115] :
- HTA stade I : PAsyst 140-159 mmHg PAdiast 90-99 mmHg
- HTA stade II : PAsyst 160-179 mmHg PAdiast 100-109 mmHg
- HTA stade III : PAsyst ≥ 180 mmHg PAdiast ≥ 110 mmHg
Cette définition fait que le 40% de la population occidentale adulte peut être considéré comme hypertendu, et, de ce fait, doit être traité comme tel pour contrôler le risque cardiovasculaire [132]. Les qualificatifs de légère, modérée ou sévère ne s’utilisent plus guère pour l’hypertension, car ils n’ont pas de corrélation avec le risque cardiovasculaire. Ce dernier est lié à l’atteinte des organes-cibles ; il reste très faible même au stade II-III en l’absence de facteurs de risque ou de lésions organiques, alors qu’il est modéré à sévère au stade I en présence de diabète, d’ischémie myocardique, d’insuffisance rénale ou d’AVC [115]. L’évidence en faveur d’un traitement au stade I est très faible, et aucune donnée ne permet de justifier un traitement en dessous de 150 mmHg chez la personne âgée de > 70 ans [115a]. La courbe du risque en fonction de la valeur de PA a une forme en « J » : le gain est minime à abaisser la PA jusqu’à sa valeur normale (120-130/80-85 mmHg), sauf peut-être pour le risque d’AVC.
Risque périopératoire
L’HTA représente-t-elle un risque périopératoire significatif ? En d’autres termes, est-il justifié de renvoyer une intervention pour se donner le temps de contrôler l’hypertension ? D’une méta-analyse de 126 études, il ressort que l’hypertension est un facteur de risque mineur, qui a très peu d’influence sur le devenir périopératoire des patients [84]. Ce sont les dommages causés aux organes-cibles (hypertrophie et insuffisance ventriculaire gauche, coronaropathie, maladie cérébrovasculaire, néphropathie hypertensive) qui ont un impact définitif sur l’augmentation du risque opératoire, mais la maladie hypertensive en soi n’en n’a pas, sauf en cas de poussée maligne [105]. En préopératoire, il est important de rechercher scrupuleusement l’atteinte des organes-cibles.
- Cardiopathie hypertensive (HVG) :
– >ECG (QRS de haut voltage et de durée > 100 msec, déviation axiale gauche à > – 30°, S en V1 + R en V5, S en V3 + R en aVL) ; - Echocardiographie (hypertrophie concentrique du VG, dilatation de l’OG, insuffisance diastolique) ;
- Ischémie myocardique ;
- Anamnèse d’AIT ou d’AVC ;
- Dysfonction rénale : créatininémie > 150 mmol/L, clairance abaissée.
- En chirurgie cardiaque, toutefois, une hypertension systolique isolée sans élévation de la diastole, donc avec une pressions différentielle élevée, cause une augmentation faible mais significative (odds ratio 1.3) de la morbidité cardiovasculaire périopératoire [7]. La corrélation avec l’AVC, l’insuffisance rénale et la mortalité est claire lorsque la pression pulsée (PAs - PAd) est > 80 mmHg [59a].
Instabilité hémodynamique
Les patients hypertendus sont connus pour être instables en anesthésie ; les fluctuations dépassent les 20% de la pression de base. La baisse de pression qui a lieu à l’induction est importante surtout parce que la pression à l’état de veille est haute, mais le nadir atteint est le même que chez les patients normotendus [74]. La réactivité vasculaire périphérique aux stimuli sympathiques est exagérée. La vasoconstriction chronique conduit à un rétrécissement du volume circulant, qui devient faible, donc très influencé par les interactions cardio-respiratoires. De plus, les médicaments antihypertenseurs interfèrent avec les régulations hémodynamiques lors de l’anesthésie et rendent le contrôle de la pression plus difficile. Le coeur est l’organe-cible le plus touché. L’augmentation chronique de la postcharge du VG a plusieurs conséquences [144].
Hypertrophie ventriculaire gauche (HVG) concentrique (réplication en parallèle des sarcomères) ; la vélocité de contraction est basse ; le volume intraventriculaire est petit ; la fraction d’éjection est normale ou élevée.
Dysfonction ventriculaire diastolique : le myocarde épais est rigide, la vitesse de relaxation est abaissée, la compliance est faible (apparition d’un B4 à l’auscultation) et la précharge optimale est élevée ; 30-50% du remplissage diastolique est assuré par la contraction auriculaire (le passage en FA peut être catastrophique) (voir Figure 21.4).
Le remodelage anatomique donne la silhouette d’un petit VG épais et d’une dilatation de l’oreillette gauche. Une stase en amont et une dyspnée peuvent survenir par dysfonction diastolique, alors que la fonction systolique est encore dans les limites de la norme (FE > 0.5) ; comme le septum est une paroi commune aux deux ventricules, le VD développe également une insuffisance diastolique progressive.
Demande en O2 augmentée : la tension de paroi et la force de compression intra-myocardique sont élevées. Simultanément, l’épaisseur du muscle et la compression des couches profondes de la paroi ventriculaire compromettent la perfusion coronarienne sous-endocardique. D’autre part, la baisse de la pression diastolique diminue l’apport. Le risque d’ischémie est élevé.
La dépendance extrême des conditions de remplissage et le petit volume circulant rendent ces patients très sensibles aux variations de la précharge : agents anesthésiants (midazolam, propofol), curares (pooling veineux intramusculaire), ventilation en pression positive (baisse du retour veineux au coeur droit), position sur table.
Hypertension aiguë postopératoire
Une poussée hypertensive passagère se développe environ 2 heures après l’intervention chez 0.6-2.0% des patients [59a]. La pression systolique augmente de 20% et la pression diastolique dépasse 100 mmHg, à cause de l’activation du système sympathique et du système rénine-angiotensine. Cette poussée est liée au réveil, à la douleur, aux frissons, à l’hypovolémie, à la rétention urinaire, à l’hypoventilation et à la présence d’une HTA sous-jacente. Elle est la plus fréquente après chirurgie carotidienne ou intracrânienne et après chirurgie de l’aorte abdominale. L’interruption préopératoire du traitement anti-hypertenseur, notamment de la clonidine, est fréquemment en cause.
Risques cardiovasculaires de l’HTA
- Les risques cardiovasculaires de l’HTA sont liés à la PA différentielle (PAsyst – PAdiast). Ils sont significatifs lorsque la PAdiff est > 80 mmHg.
- Le risque opératoire en cas d’hypertension artérielle (HTA) est déterminé par les lésions sur les organes-cibles (cerveau, cœur, reins), mais non par la valeur de la pression artérielle.
- Répercussions cardiaques de l’HTA : hypertrophie ventriculaire gauche concentrique, dysfonction diastolique, risque ischémique sous-endocardique.
Traitement antihypertenseur
Les patients hypertendus sont très généralement sous une thérapie chronique préopératoire multi-médicamenteuse. Les cinq classes de substances de premier choix sont : les antagonistes du calcium, les inhibiteurs de l’enzyme de conversion, les antagonistes de l’angiotensine II, les β-bloqueurs et les diurétiques. Ceci pose deux problèmes à l’anesthésiste : quelles en sont les implications physiopathologiques du médicament et quelle attitude adopter face à l’interruption du traitement ?
Les β -bloqueurs
Dans le cadre d’une HTA, les β -bloqueurs freinent la sécrétion de rénine, diminuent la performance cardiaque systolique (sauf en administration chronique dans l’insuffisance cardiaque) et présentent un effet hypotenseur central [197]. Les β 2-bloqueurs sont les seuls médicaments associés à une baisse de l’incidence d’événements ischémiques peropératoires en chirurgie coronarienne et non-cardiaque, probablement grâce à la baisse de la fréquence cardiaque qu’ils entraînent [31,177]. Il y a donc largement plus d’intérêt à les continuer jusqu’à l’opération qu’à les interrompre en préopératoire. De plus, l’interruption du β-blocage provoque un effet rebond et un risque ischémique accru dans les 48 heures. Il était de routine de remplacer, à dose équipotente, les β-bloqueurs de longue durée d’action par des substances d’activité courte et cardio-sélective comme le metoprolol (Loprésor® 50-100 mg). Actuellement, la tendance est de ne plus modifier le traitement en cours, et de le maintenir inchangé en préopératoire. L’effet pourra être prolongé à la demande par des doses répétées ou une perfusion d’esmolol (Brévibloc®, bolus de 10 mg répétés). Le but est d’obtenir une fréquence de 60-65 battements/minute (voir Tableau 4.21).
Les β -bloqueurs ne sont efficaces que pour autant que la fréquence cardiaque soit très strictement contrôlée. Lorsque les patients sont au bénéfice d’un traitement chronique à long terme, la chirurgie vasculaire est associée à un taux d’infarctus postopératoire supérieur à la moyenne et l’incidence d’ischémie périopératoire n’est pas modifiée si la fréquence est identique à celle des malades non β -bloqués [164,175]. Les malades β-bloqués depuis longtemps présentent une régulation à la hausse de leurs récepteurs β-adrénergiques (up-regulation), qui les rend hypersensibles à la stimulation catécholaminergique aiguë survenant au cours de la chirurgie ; l’effet inotrope et chronotrope est alors excessif, d’où le risque ischémique aggravé [73].
D’autre part, le remplacement d’un agent à longue durée d’action par un agent plus court augmente le risque d’un effet rebond qui survient dans la période postopératoire immédiate lorsque les prises d’entretien sont omises à cause de l’instabilité hémodynamique ou de l’impossibilité de la voie digestive [148] ; or c’est précisément la période la plus dangereuse. Le problème de la prise en charge des malades sous β-bloqueurs est la fixité de leur fréquence cardiaque, qui limite significativement l’adaptabilité du débit cardiaque aux variations de la demande métabolique et de la volémie peropératoire, même si la réponse neuro-humorale au stress n’est pas modifiée [208].
Les β1 -activateurs
Le fenoldopam induit une vasodilatation périphérique en stimulant les récepteurs béta-dopaminergiques, notamment au niveau rénal où il provoque une augmentation du flux et une diurèse accrue. Il s’administre en perfusion (0.03-0.3 mcg/kg/min) après une dose de charge de 0.1 mcg/kg/min [59a]. Il est essentiellement indiqué chez les patients souffrant de dysfonction rénale.
Les α-bloqueurs
Les α1-bloqueurs sont peu utilisés en-dehors du traitement de la poussée hypertensive aiguë à cause de la tachycardie réflexe et de l’hypotension orthostatique qu’ils occasionnent (phentolamine, prazocine). L’urapidil (Ebrantil®) est un nouvel antagoniste α1 sélectif ; comme il possède en outre un effet α-2 stimulant et un effet sympathicolytique central de type sérotoninergique, il ne provoque pas de tachycardie.
L’α-blocage est pratique en association avec un β-blocage ; malheureusement, les deux effets ont des pharmacocinétiques différentes dans les substances qui les combinent ; c’est le cas du carvédilol (Dilatrend®, 12.5 mg per os) et du labétalol (Trandate®, 100-200 mg per os, 1-2 mg/min iv). Chez ce dernier, la puissance de l’effet β-bloqueur est 7 fois plus importante que celle de l’effet α par voie intra-veineuse et 3 fois par voie orale ; la durée d’action de l’effet α est plus courte que celle de l’effet β (2-4 heures) [170].
Les α2-agonistes
Les α2-agonistes centraux (clonidine, dexmedetomidine) limitent la tachycardie et l’hypertension, et induisent de plus une sédation et une analgésie ; ces effets sont tout bénéfice en peropératoire, et diminuent l’incidence de complications cardiaques postopératoires [135]. Toutefois, ils inhibent la libération de nor-adrénaline aux terminaisons sympathiques, et interfèrent de ce fait avec l’activité de la dopamine, qui est atténuée, et celle de la dobutamine, qui est accentuée [134]. Les α2-agonistes ne doivent pas être arrêtés en préopératoire pour quatre raisons :
Leur omission entraîne un effet rebond ;
- Ils sont sédatifs ;
- Ils assurent une stabilisation hémodynamique pendant l’intervention ;
- Ils diminuent le risque ischémique.
Les inhibiteurs de l’enzyme de conversion (IEC)
Les IEC sont des antihypertenseurs de choix car ils baissent les résistances périphériques (vaisseaux résistifs) et le retour veineux (vaisseaux capacitifs) sans provoquer de tachycardie. Ils améliorent la survie des patients en insuffisance cardiaque congestive [23] et freinent le développement de l’hypertrophie et du remodelage ventriculaires [33]. Ils diminuent la mortalité lors d’infarctus avec dysfonction ventriculaire [181] et présentent un effet anti-ischémique lors d’angor silencieux [86]. Les antagonistes du récepteur à l’angiotensine II (ARA, sartans) ont les mêmes propriétés. Le système rénine-angiotensine est impliqué dans la régulation du volume circulant, de la pression sanguine et des circulations régionales ;
il est activé par la baisse du volume sanguin effectif. Alors que l’on en dépend peu en normovolémie, sa contribution au maintien de la pression artérielle devient cruciale en hypovolémie [38]. Lorsque le système rénine-angiotensine est bloqué, la pression artérielle dépend des deux autres régulations physiologiques : le tonus sympathique, système à régulation rapide, et la vasopressine endogène, système compensatoire lent qui agit sur les vaisseaux résistifs et non capacitifs [34].
L’anesthésie générale ou rachidienne causent une inhibition de l’activité sympathique ; si le patient est sous IEC/ARA, le débit cardiaque ne s’adapte plus aux variations de charge que par la vasopressine (régulation lente), et la pression devient volo-dépendante (Figure 21.19) [26]. Il existe donc un risque majeur d’hypotension sévère à l’induction et d’amplification des oscillations de pression lors des variations de volume et de stimulation centrale, particulièrement chez les malades hypovolémiques ou souffrant de dysfonction diastolique [37].
Si l’indication aux IEC est une insuffisance ventriculaire gauche congestive, l’incidence d’hypotension à l’induction est moins sévère [32]. Comme il n’existe pas d’effet rebond à l’arrêt du traitement chez les hypertendus, il est recommandé de stopper les IEC/ARA 12 heures avant l’intervention pour diminuer le risque d’hypotension à l’induction [35]. Le risque de poussée hypertensive peropératoire n’est pas aggravé ; d’ailleurs, les IEC n’en protègent pas le malade [38]. Lorsque les IEC sont prescrits pour le traitement de l’insuffisance congestive chronique, il est préférable de les maintenir puisqu’ils améliorent la fonction ventriculaire gauche, et que les variations de précharge modifient peu le débit d’un VG défaillant dont la courbe de Starling est aplatie (voir Figure 21.2).
Traiter l’hypotension survenue au cours de l’anesthésie peut être ardu car la réponse adrénergique est atténuée et la nor-adrénaline peut manquer d’efficacité ; dans les cas sévères, seule la vasopressine (Pitressine®) a un effet significatif. Ces remarques s’appliquent aussi aux antagonistes de l’angiotensine II (ARA). Les recommandations pour le délai depuis la dernière prise, formulées en fonction des demi-vies d’élimination, sont indiquées dans le Tableau 21.3.
Par ailleurs, les IEC/ARA inhibent la vasoconstriction artériolaire efférente du glomérule, ce qui diminue la filtration glomérulaire en cas d’hypotension ou lors d’utilisation de substances qui inhibent la vasodilatation de l’artériole afférente comme l’aprotinine. Une étude clinique a démontré une association significative entre la combinaison d’aprotinine - IEC et l’insuffisance rénale postopératoire [94]. Cette crainte a disparu avec le retrait commercial de l’aprotinine.
Les anti-calciques
Les bloqueurs calciques inhibent l’entrée du calcium dans les cellules musculaires lisses et induisent une vasodilatation artériolaire systémique et pulmonaire sans toucher les vaisseaux de capacitance [197]. Ils ne sont pas recommandés pendant la phase aiguë de l’infarctus. A part leur action antiangineuse, leurs effets hémodynamiques sont variables selon les préparations (Tableau 21.3). Il est recommandé que les bloqueurs calciques soient poursuivis jusqu’à l’intervention, car leur interruption paraît pouvoir occasionner une ischémie aiguë. Leur maintien peut augmenter le besoin en catécholamines et en volume, et prolonger l’effet des curares. Leurs effets inotropes et chronotropes potentialisent ceux des halogénés (risque de bradycardie et de dépression myocardique). Vasodilatateurs des vaisseaux de résistance mais non de capacitance, ils provoquent une hypotension qui est fonction du niveau des RAS. La nifédipine (Adalat®) et l’isradipine (Lomir®) induisent une tachycardie réflexe, alors que le diltiazem (Dilzem®) et le vérapamil (Isoptin®) ont des effets inotrope et chronotrope négatifs (voir Tableau 4.20).
L’association d’un IEC (bénazépril, Lotensil®) et d’un anticalcique de type dihydropyridine (amlodipine, Alzar®, Lotrel® en combinaison avec bénazépril) s’est révélée être la meilleure combinaison pour diminuer le risque cardiovasculaire et l’infarctus myocardique chez des hypertendus à haut risque [87]. L’association de l’IEC avec un diurétique est moins efficace.
Autres substances
L’α-méthyl-dopa (Aldomet®) est un précurseur de l’α-méthyl-noradrénaline, qui stimule les récepteurs α2 centraux. Cet antihypertenseur n’est plus guère utilisé que pendant la grossesse compte tenu de la sécurité qu’il procure dans cette situation.
Les dérivés nitrés doivent être maintenus aux dosages habituels jusqu’à l’intervention ; ils sont administrés le matin du jour opératoire, car leur arrêt brusque peut induire une ischémie, une hypervolémie relative ou une défaillance droite. Il existe encore une série de vasodilatateurs à action vasculaire directe. Ils sont passés de mode en traitement chronique à cause de la tachycardie qu’ils provoquent : hydralazine (Néprésol®), minoxidil (Loniten®), réserpine (Serpasil®), etc. La kétansérine (Sufrexal®) est un antagoniste des récepteurs HT2 de la sérotonine et un faible α1-bloqueur ; il ne provoque pas de tachycardie ni d’effet shunt intrapulmonaire.
Les diurétiques (thiazides) réduisent le volume plasmatique et causent une légère vasodilatation. Ils entraînent un risque d’hypotension par hypovolémie et baisse de précharge, ainsi que les risques liés à l’hypokaliémie, l’hyponatrémie et l’alcalose métabolique. Il est préférable de ne pas administrer les diurétiques le jour de l’intervention, de manière à conserver un volume circulant élevé ; cette précharge haute facilite l’équilibre lors de l’induction et de la ventilation mécanique.
Traitement de la crise hypertensive
Le nitroprussiate de Na (Nipruss®) donne directement naissance à du NO•, contrairement aux dérivés de la nitroglycérine qui agissent par le biais de composés sulfydryls spécifiques. Le NO• formé active la guanylate cyclase (formation de GMPc) et freine l’augmentation de Ca2+ dans la cellule musculaire lisse vasculaire. La libération de NO• s’accompagne de celle de CN- ; cet anion réagit avec la méthémoglobine (0.5% de l’Hb totale) pour former de la cyanméthémoglobine non-toxique, puis est converti en thiocyanate par transsulfuration par les rhodanases hépatiques. La capacité totale de ce système permet de détoxifier 50 mg de nitroprussiate [63]. Le risque d’accumulation de CN- débute pour une perfusion continue supérieure à 4-5 mcg/kg/min pendant 24 heures [199] ; il se caractérise par un blocage progressif de la phosphorylation oxydative avec anoxie tissulaire et acidose lactique (lactate > 10 mM/L). Un signe caractéristique est le développement soudain d’une tachyphylaxie.
Le traitement de l’intoxication est le suivant :
- Arrêt immédait de la perfusion de nitroprussiate ;
- Ventilation à 100% O2, même en cas de saturation normale ;
- Correction de l’acidose métabolique par du bicarbonate de Na ;
- Bleu de méthylène, 1-2 mg/kg (amp. 10 mg/ml) ;
- Nitrite de Na 3%, 5 mg/kg iv ;
- Thiosulfate de Na, 200 mg/kg iv (15 min) ;
- Hydroxycobalamine (vitamine B12) en perfusion (25 mg/h).
Le Nipruss® est un vasodilatateur artériolaire systémique et pulmonaire puissant, rapide, et efficace quelle que soit l’étiologie de l’hypertension. Il inhibe la vasoconstriction pulmonaire hypoxique et augmente la pression intracrânienne. La vitesse de démarrage de la perfusion est de 0.3 mcg/kg/min ; la vitesse maximale de sécurité est de 10 mcg/kg/min pendant 10 minutes et 5 mcg/kg/min pendant 24 heures. Pendant la CEC, le Nipruss® garde son efficacité en hypothermie, mais les rhodanases hépatiques sont inhibées par le froid ; le métabolisme est ralenti et les risques toxiques augmentés. Sa très large utilisation dans cette situation montre que ce risque est faible ; cependant, la prudence réclame de mesurer fréquemment l’équilibre acido-basique en hypothermie et de traiter agressivement toute acidose métabolique suspecte (voir Chapitre 4 Vasodilatateurs et Tableau 4.19).
Les dérivés nitrés libèrent du NO• par l’intermédiaire des groupes sulfhydryls de la cystéine présente dans la cellule musculaire lisse. Il n’y a aucune toxicité significative connue. Une veinodilatation des vaisseaux de capacitance s’installe dès les faibles doses et n’augmente pratiquement pas avec les concentrations croissantes de produit ; cet effet diminue la précharge, la tension de paroi et le débit cardiaque ; la mVO2 baisse essentiellement par ce biais.
A doses élevées, une vasodilatation artériolaire dose-dépendante apparaît, qui est responsable d’une tachycardie réflexe lorsque l’hémodynamique de base est normale, mais non en cas d’insuffisance cardiaque. Alors qu’elle abaisse le débit cardiaque de l’individu normal, la nitroglycérine améliore la performance ventriculaire lors d’insuffisance cardiaque congestive. Son excellent effet vasodilatateur pulmonaire peut induire un effet shunt et une baisse de la PaO2. En administration continue, une tolérance se développe rapidement.
Au niveau du lit coronaire, les nitrés ont une action complexe [1] :
- Dilatation des petits vaisseaux proportionnellement plus importante que celles des vaisseaux épicardiques ;
- Dilatation des collatérales ;
- Renversement des spasmes coronariens ;
- Amélioration du flux à travers les sténoses par relâchement de la vasoconstriction locale, indépendamment de l’intégrité endothéliale ;
- Amélioration du rapport de flux sous-endocardique / sous-épicardique.
Comme hypotenseur, la nitroglycérine est indiquée s’il existe une composante de surcharge volumique ou d’ischémie coronarienne. A une vitesse de 1-2 mcg/kg/min, seule la précharge diminue ; la vasodilatation artérielle apparaît à des dosages supérieurs à 3 mcg/kg/min.
Parmi les anticalciques, les dérivés dihydropyridines sont les plus utilisés comme anti-hypertenseurs sur les vaisseaux de résistance ; les plus récents, tels la nicardipine et l’isradipine, sont dépourvus d’effets tachycardisant et cardiodépresseur ; ce dernier devient cependant significatif en cas de β -blocage associé. Bien qu’ils aient moins d’effet anti-angineux que le diltiazem, ils sont préférables au nitroprussiate chez le patient coronarien, parce qu’ils ne provoquent pas de « vol » intramyocardique ni de tachycardie. A l’exception de la nicardipine dont la durée d’action en bolus i.v. est de 10-15 minutes, l’effet des dihydropyridines est plus lent et plus prolongé, donc moins aisément manipulable, que celui des nitrés. Le diltiazem (Dilzem®) est fréquemment utilisé en cas de tachycardie associée, vu son effet chronotrope négatif.
La nicardipine (Loxen®) est un puissant vasodilatateur cérébral et coronarien, qui ne provoque pas de syndrome de vol. Le vérapamil (Isoptin®) n’est pas recommandé dans le cadre de l’hypertension en chirurgie cardiaque à cause de son effet inotrope négatif marqué et du risque élevé de bloc atrio-ventriculaire complet (augmenté après CEC). La clevidipine (Cleviprex®) est un vasodilatateur artériel sélectif du réseau systémique et coronarien sans effet sur les vaisseaux de capacitance ni sur la précharge ; il ne provoque pas de tachycardie. Par voie iv, il a une demi-vie de 10 min (métabolisation par les estérases plasmatiques). Le dosage est 1-2 mg/h en perfusion, que l’on peut doubler toutes les 3-5 minutes jusqu’à l’effet désiré (dose maximale : 32 mg/h). Aussi efficace que le nitroprussiate sur la pression systémique sans en avoir la toxicité, la clevidipine dilate les coronaires sans occasionner de vol [59a].
Lorsqu’une poussée hypertensive survient dans le cadre d’une ischémie coronarienne aiguë, un dérivé à effet chronotrope et inotrope négatif est préférable aux dihydropiridines essentiellement vasodilatatrices et spasmolytiques : diltiazem (effets marqués) ou nifédipine (effets plus faibles). Dans le cadre d’une défaillance ventriculaire, le choix se porte sur un agent sans effet myocardique : isradipine ou nicardipine. Sur le réseau coronarien, les anticalciques ont un effet complexe [169] :
- Augmentation de l’apport en O2 : augmentation du flux coronaire, vasodilatation, levée de spasme coronarien, amélioration de la perfusion sous-endocardique ;
- Diminution de la demande en O2 : diminution de la postcharge, diminution de la contractilité et baisse de la fréquence (vérapamil, diltiazem), modification du couplage électro-mécanique
L’esmolol (Brevibloc®) est un β1-bloqueur sélectif, sans acivité sympathico-mimétique intrinsèque ; sa courte durée d’action (10 minutes) est due à sa biotransformation rapide par les estérases des érythrocytes. Comme antihypertenseur, il se justifie chez le patient coronarien pour baisser la consommation d’oxygène dans le cadre d’une hyperactivité sympathique accompagnée d’une tachycardie et d’une fonction systolique normale. N’ayant pas d’effet vasodilatateur propre, il n’altère pas la vasoconstriction pulmonaire hypoxique.
L’urapidil (Ebrantil®) combine une activité d’α1-blocage périphérique, de stimulation α2 et de stimulation sérotoninergique centrale ; il ne déclenche pas de tachycardie, ni d’effet shunt intrapulmonaire, ni d’augmentation de la pression intracrânienne. En bolus iv, son action s’installe en 5 minutes.
Les dosages recommandés de ces différentes substances sont décrits dans le Tableau 21.4.
Traitement anti-hypertenseur
Traitement préopératoire :
– β-bloqueurs : poursuivre en continu et maintenir la FC à 60-65 batt/min
– IEC/ARA : stop 12-24 heures en préopératoire si prescrits pour l’HTA ; maintenir en continu si prescrits pour insuffisance cardiaque
– α2-agonistes : maintenir le traitement
– Anticalciques : maintenir en périopératoire
– Dérivées nitrés : maintenir en périopératoire
– Diurétiques : pas d’administration le jour opératoireTraitement de la crise hypertensive peropératoire :
– Approfondissement de l’anesthésie/analgésie
– Isoflurane 5%
– Phentolamine, bolus répétés 1 mg
– Nitroprussiate de Na, 0.3-3 mcg/kg/min– clevidipine, 1-10 mg/h
En cas d’ischémie myocardique associée :
– Nitroglycérine, bolus 20 mcg, perfusion 1-10 mcg/kg/min
– Esmolol, bolus répétés 10 mg
– Si spasmes coronariens : diltiazem 0.1-0.3 mg/kg/h
Anesthésie en cas d’HTA
Renvoi de l’opération
Le risque cardiaque peropératoire n’est augmenté que de 1.3 fois chez l’hypertendu sévère non équilibré [84]. La présence d’une hypertension de stade I ou II, même découverte la veille de l’intervention, n’est donc pas une raison suffisante pour renvoyer l’opération, bien qu’il faille s’attendre à davantage d’instabilité hémodynamique [173]. Une étude contrôlée sur des hypertendus sévères n’a pas pu mettre en évidence de bénéfice à renvoyer l’intervention pour régulariser la pression artérielle avant la chirurgie [204]. L’HTA préopératoire en soi n’est pas associée à une augmentation du taux d’évènements cardiaques ; c’est l’hypotension peropératoire (baisse > 33% de la valeur de base pendant > 10 min) qui est un prédicteur indépendant de complications postopératoires [112].
On sait aussi que les risques opératoires sont liés aux lésions des organes-cibles comme le cœur (HVG, coronaropathie), le cerveau (AVC) ou les reins (néphropathie hypertensive), mais non à l’HTA elle-même [79]. Une hypertension de stade III (PAsyst > 180 mmHg, PAdiast > 110 mmHg) augmente le risque d’ischémie myocardique et d’arythmies, mais n’est pas un obstacle à une intervention chirurgicale nécessaire ou vitale ; seule une intervention majeure et parfaitement élective peut justifier un délai pour investiguer une cardiopathie associée et instaurer un traitement anti-hypertenseur. La seule contre-indication opératoire est une poussée d’hypertension maligne symptomatique (PA > 220/120 mmHg).
Il existe essentiellement deux motifs pour justifier le renvoi d’une intervention chirurgicale [79,173] :
- Améliorer l’état pathologique lié à des lésions d’un organe-cible si cela peut diminuer le risque opératoire (exemples : ischémie coronarienne, sténose carotidienne)
- Investiguer une lésion organique suspectée si les résultats peuvent modifier la prise en charge du patient (exemple : phéochromocytome).
Un certain nombre de facteurs sont aggravants pour l’hypertendu : l’âge, le diabète, les lésions cardiovasculaires ou cérébrovasculaires ou l’anamnèse d’accident cardiovasculaire (Tableau 21.5) [59].
Contrôle tensionnel peropératoire
Le but est de maintenir une pression stable et d’éviter les épisodes d’hypotension puisque leur importance est un prédicteur indépendant de complications cardio- et cérébro-vasculaires [112]. Une fluctuation de plus de 20% de la PAM chez les hypertendus sévères prédit une augmentation des complications postopératoires [30]. Malheureusement, l’hypertendu, traité ou non, est sujet à des variations tensionnelles peropératoires plus amples et plus rapides (sur 5-10 battements) que le sujet normal pour plusieurs raisons :
- Dysrégulation idiopathique de la pression artérielle ;
- Arbre vasculaire peu compliant ;
- Insuffisance diastolique ;
- Volume circulant contracté (diurétique) ;
- Traitement chronique bloquant les régulations autonomes.
Plus le système sympathique est bloqué par le traitement, plus la pression devient dépendante du volume circulant. Chez l’hypertendu, les épisodes de stimulation sympathique peropératoire sont souvent la cause d’un échappement tensionnel vers le haut qui peut conduire à une hémorragie intracrânienne, une décompensation gauche ou des arythmies graves. Il faut éviter un dépassement de plus de 20% de la pression moyenne de base et corriger immédiatement toute variation significative. En chirurgie cardiaque, les moments critiques à cet égard sont l’intubation, l’incision, l’ouverture du sternum, la péricardiotomie, la manipulation de la racine aortique, l’hypothermie de CEC et la fermeture du sternum.
Un spray laryngé (xylocaïne 4%) facilite le contrôle tensionnel lors de l’intubation. Il est capital que la pression artérielle soit basse au moment de la canulation et de la décanulation aortiques, car la paroi du vaisseau peut se déchirer en étoile au point de ponction ou se laisser cisailler par la bourse de fermeture. Non seulement l’anesthésie doit être profonde à ces moments-là (isoflurane 5%), mais il faut souvent administrer en appoint un hypotenseur à effet rapide et de courte durée d’action (phentolamine) ou un β-bloqueur (esmolol) si le patient est simultanément tachycarde.
L’hypertendu avec bonne fonction ventriculaire est souvent hyperkinétique : sa fréquence et sa contractilité sont élevées. Dans ce cas, le β-blocage avec un agent de courte durée d’action (esmolol) est indiqué avant la CEC, car il diminue la fréquence cardiaque et la consommation d’oxygène. Après la mise en charge, la stimulation sympathique par les amines endogènes est intense, mais la fonction cardiaque est toujours amoindrie par l’hypothermie, la cardioplégie et l’ischémie.
Le β-blocage n’est envisageable qu’avec infiniment de circonspection, et seulement après un contrôle rigoureux de la performance myocardique (échocardiographie, cathéter pulmonaire de Swan-Ganz). Le choix de l’hypotenseur se porte primairement sur un vasodilatateur artériel (isoflurane, phentolamine, nitroprussiate, anticalcique) et sur l’approfondissement de l’anesthésie. Les anticalciques dérivés de la dihydropyridine (nifédipine, nicardipine, isradipine) sont peu ou pas tachycardisants et ne dépriment pas la fonction ventriculaire, mais leur durée d’action est longue. Leur indication préférentielle est la prévention ou le traitement du spasme artériel mammaire ou coronarien.
Il n’y a pas de technique d’anesthésie propre à l’hypertension artérielle en chirurgie cardiaque, alors que l’anesthésie loco-régionale ou combinée présente probablement un certain avantage en chirurgie non cardiaque. Pour l’anesthésie générale, l’isoflurane est particulièrement indiqué parce qu’il a un effet vasodilatateur artériel significatif mais pas d’effet veinodilatateur. Les diazépines et le propofol, au contraire, abaissent la précharge et causent d’amples variations de la pression artérielle chez ces patients dont le volume systolique dépend du remplissage de manière critique. Les fentanils ont très peu d’effet vasodilatateur direct.
Chez le patient hypertendu, la pression de perfusion normale des organes est déplacée vers le haut ; la courbe d’autorégulation cérébrale et rénale est translatée vers la droite ; une pression moyenne dite « normale » peut être insuffisante pour assurer la perfusion du rein ou du cerveau. La PA ne doit pas s’abaisser à moins de 20% de sa valeur de base au repos. En CEC, la PAM doit être maintenue à au moins 80 mmHg. Une poussée hypertensive contraint le perfusionniste à baisser le débit de la machine, ce qui diminue la perfusion tissulaire. Bien qu’elle soit maintenue en hypothermie modérée (28°C), l’autorégulation cérébrale peut être dépassée par l’hypertension. La perfusion devient pression-dépendante et excessive (perfusion luxuriante) ; elle engendre alors un risque élevé d’oedème cérébral et d’hémorragie intracrânienne à cause de l’anticoagulation complète.
Traitement de l’hypertension peropératoire
En phase peropératoire, la poussée hypertensive peut se présenter sous des aspects variables, mais la première mesure est de s’assurer que la profondeur de l’anesthésie est adéquate et que l’analgésie est suffisante. Ensuite, une palette de substances sont à disposition (Tableau 21.6).
Le choix entre ces différentes possibilités est motivé par un certain nombre de critères cliniques :
- Danger de la tachycardie pour le patient coronarien ;
- Action inotrope négative ;
- Action préférentielle sur la postcharge ou la précharge ;
- Effet sur les coronaires : augmentation du flux distal, risque de vol, durée d’action ;
- Simplicité d’administration et coût.
Les modifications du débit cardiaque dépendent de la fonction myocardique. La baisse des conditions de charge par la nitroglycérine entraîne une tachycardie réflexe chez le coeur normal mais non en cas d’insuffisance congestive ; dans cette situation, la baisse de précharge soulage le ventricule. D’une manière générale, l’augmentation du débit par la baisse de la postcharge n’est significative que pour le coeur en insuffisance systolique, mais non pour le patient normal ni pour celui qui est en hypovolémie.
En cours de CEC, la situation est un peu particulière, puisque l’hypertension est exclusivement liée à une augmentation des résistances périphériques (hypothermie, dépulsation du flux, etc). Le coeur est hors-circuit et le débit est réglé par la pompe, dont la précharge dépend du retour veineux central. Le choix de l’hypotenseur se porte sur un médicament vasodilatateur artériel pur de courte durée d’action, par ordre de préférence :
- 1 - isoflurane, jusqu’à 5% ;
- 2 - phentolamine, jusqu’à 20 mg en doses fractionnées de 1 mg ;
- 3 - nitroprussiate en perfusion sur la voie centrale (risque toxique augmenté en hypothermie).
La nitroglycérine n’est efficace qu’à hautes doses et gêne le retour veineux vers la pompe, contraignant le perfusionniste à augmenter le volume circulant. Les β-bloqueurs n’ont pas de sens puisque le coeur est arrêté. Lorsqu’elle est indiquée pour une insuffisance ventriculaire réfractaire ou une hypertension pulmonaire, la dose de charge d’anti-phosphodiestérase-3 (milrinone 50 mg) administrée en CEC a un effet vasodilatateur puissant.
Cas particulier : le phéochromocytome
Le phéochromocytome est une tumeur du tissu chromaffine sécrétant des catécholamines, située habituellement dans la médullo-surrénale mais pouvant se localiser ailleurs dans la chaîne sympathique, ou rarement dans une paroi cardiaque. Selon la prédominance de l’hormone sécrétée, les malades présentent une hypertension artérielle (sécrétion de nor-adrénaline), ou des arythmies, des sudations et des accès de panique (sécrétion d’adrénaline et de dopamine). La sécrétion étant variable au cours du temps, la symptomatologie évolue en dent de scie. L’augmentation de postcharge induit une hypertrophie concentrique du VG, mais peut conduire à un épuisement du ventricule et à une cardiomyopathie dialtée.
L’excès de stimulation sympathique et l’intense sécrétion d’amines a et b s’accompagnent d’une hypovolémie chronique. La préparation préopératoire est essentielle.
Alpha-blocage : la phénoxybenzamine et la prazocine ne sont plus guère utilisées. Elles tendent à être remplacées par des anticalciques (nifédipine, nicardipine, diltiazem) qui inhibent les mouvements du calcium suscités par la nor-adrénaline dans la cellule musculaire lisse.
- Béta-blocage : indiqué en cas de palpitations, d’arythmies et d’hyperglycémie ; en général combiné au blocage a.
- Blocage mixte α et β : labétalol (Trandate® per os et iv), carvédilol (Dilatrend® per os) ; très pratiques pour le traitement oral préopératoire, ces agents sont peu adaptés à la thérapeutique aiguë peropératoire, car on ne peut pas dissocier les effets a des effets b ; de plus la durée d’action des deux effets n’est pas identique.
- Expansion du volume circulant par administration liquidienne sur une dizaine de jours.
- La préparation est adéquate lorsque la pression est stabilisée à < 160/90 mmHg sans hypotension orthostatique et que les extrasystoles sont < 1 par 5 minutes.
La phase peropératoire est caractérisée par trois éléments.
- Poussées massives de sécrétion catécholaminergique lors des manipulations chirurgicales de la tumeur ;
- Hypertension, arythmies et hyperglycémie avant le clampage des veines qui drainent la tumeur ;
- Hypotension et hypoglycémie dès que la veine est clampée, à cause de la chute brutale des catécholamines endogènes.
La prise en charge peropératoire est axée sur la gestion de l’hypertension très instable qui précède la résection tumorale et de l’hypotension qui peut s’en suivre [114a].
- Perfusion continue de nitroprussiate ; nitroglycérine en cas d’insuffisance congestive ;
- Administration de phentolamine en bolus lors des poussées hypertensives ;
- Administration d’esmolol en bolus ou en perfusion en cas d’arythmies, de tachycardie ou d’ischémie myocardique ;
- Magnésium iv : hypotenseur et anti-arythmique d’appoint ;
- Clévidipine : nouvel anti-calcique intra-veineux de très courte durée d’action (pic d’action en 2-4 minutes, demi-vie d’élimination de 15 minutes) ; perfusion de 1-2 mg/h augmentée progressivement jusqu’à 4-6 mg/h ;
- Administration liquidienne généreuse.
Après la résection, il s’installe en général une période d’hypotension qui peut être assez réfractaire au traitement habituel (arrêt des hypotenseurs, administration liquidienne, néosynéphrine, nor-adrénaline) et réclamer un traitement plus agressif.
Vasopressine : agit par une voie indépendante des récepteurs alpha ; à pression artérielle égale, elle produit moins de vasoconstriction rénale, pulmonaire et coronaire que les autres vasopresseurs ;
Bleu de méthylène : agent de sauvetage dans les cas de vasoplégie intense.
Anesthésie et HTA
Le risque opératoire est lié aux lésions des organes-cibles (cerveau, cœur, reins) mais non à la valeur de la pression artérielle. L’HTA n’est pas une raison de renvoi de l’opération, sauf en cas d’hypertension maligne (PA > 220/120 mmHg) symptomatique ou d’investigations nécessaires sur des lésions organiques pouvant modifier la prise en charge.
Les fluctuations peropératoires de la PA sont importantes, mais le risque est surtout associé à l’hypotension : ne pas laisser la PAM descendre à < 20% de sa valeur de base chez le patient.Traitement de la crise hypertensive peropératoire :
- - Approfondissement de l’anesthésie/analgésie
- - Isoflurane 5%
- - Phentolamine, bolus répétés 1 mg
- - Nitroprussiate de Na, 0.3-3 mcg/kg/min
En cas d’ischémie myocardique associée :
- - Nitroglycérine, bolus 20 mcg, perfusion 1-10 mcg/kg/min
- - Esmolol, bolus répétés 10 mg
- - Si spasmes coronariens : diltiazem 0.1-0.1 mg/kg/h
Phéochromocytome : tumeur sécrétant majoritairement de la nor-adrénaline mais aussi de l’adrénaline et de la dopamine. Préparation préopératoire : labétalol, carvédilol, anti-calcique, expansion liquidienne.
En peropératoire :
- - avant la résection, hypotenseurs (nitroprussiate, phentolamine, clevidipine), béta-bloqueur ;
- - poussées hypertensives lors des manipulations chirurgicales de la tumeur ;
- - après la résection : hypertenseurs, expansion liquidienne.
source : l’excellentissime site precisdanesthesiecardiaque.ch que je vous invite à consulter sans modération.
§§§
A consulter
– l’indispensable monographie Vidal sur la classification pharmacothérapeutique des antihypertenseurs
– Plus simple, hypertension-online.com classe les médicaments anti-hypertenseurs par ordre alphabétique (classement des dénominations courantes, c’est à dire des noms des médicaments)
Arnaud BASSEZ
IADE/enseignant CESU
Administrateur